
Щелочные металлы

Происхождение названий щелочных металлов
- Li (1817) лат. " литос" - камень
- Na (1807) араб. "натрум" -сода
- К (1807) араб. "алкали" - щелочь
- Rb (1861) лат. "рубидус" - темно-красный
- Cs (1860) лат. "цезиус" - небесно-голубой
- Fr (1939) от названия страны Франция.

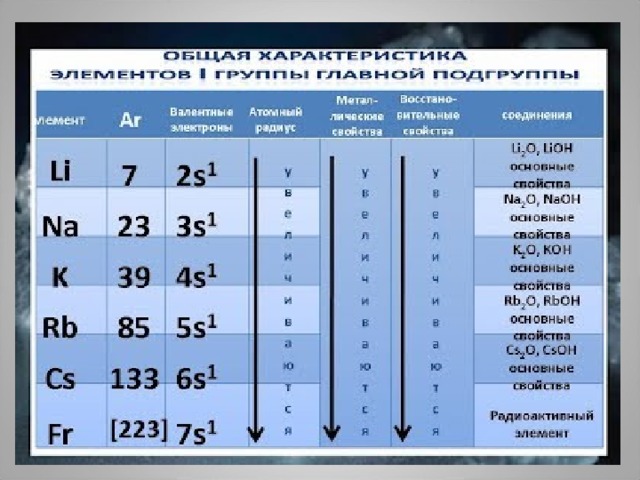
Положение в периодической системе химических элементов Д.И.Менделеева
- I группа главная подгруппа.
Увеличивается радиус атомов ,
растет восстановительная способность
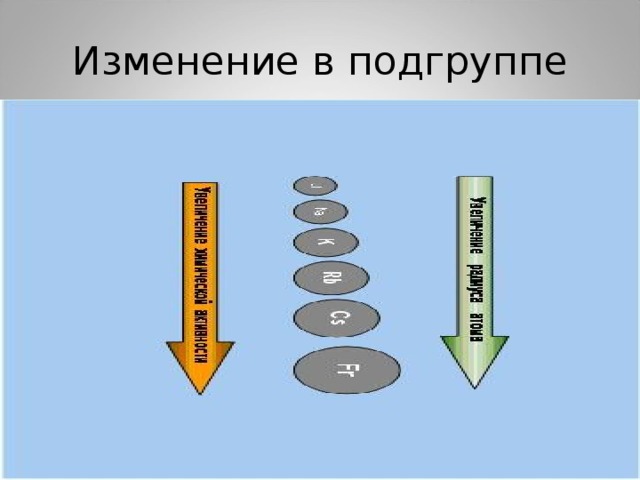
Изменение в подгруппе
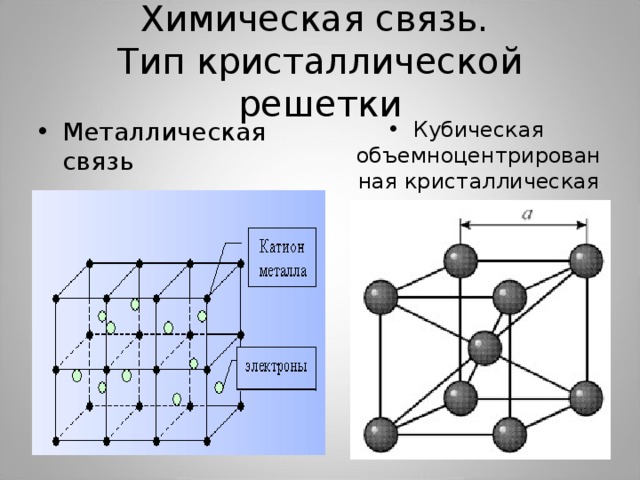
Химическая связь. Тип кристаллической решетки
- Кубическая объемноцентрированная кристаллическая решетка



Щелочные металлы – простые вещества
Литий и натрий - мягкие щелочные металлы серебристо-белого цвета
Натрий – мягкий металл, его можно резать ножом .
Натрий
Литий

Щелочные металлы
Калий и рубидий
мягкие щелочные металлы серебристо-белого цвета
Калий
Рубидий

Щелочные металлы
цезий
Цезий 99,99999% в ампуле
Мягкий щелочной металл золотисто-белого цвета

Франций
Уран(235),
из которого поучают франций
- Франций - щелочной металл, обладающий как радиоактивностью, так и высокой химической активностью . Не имеет стабильных изотопов
Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов

Химические свойства щелочных металлов
- Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Взаимодействуют с водой воде с образованием гидроксидов (R–OH)– щёлочей.
- Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды (кроме лития).
- Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs

Химические свойства
03.11.18
- 2Na + Cl 2 = 2NaCl ( в атмосфере F 2 и Cl 2 щелочные Me самовоспламеняются)
- 4Li + O 2 = 2Li 2 O 2Na + O 2 = Na 2 O 2 K + O 2 = KO 2
оксид Li пероксид Na надпероксид K
3) 2Na + Н 2 = 2NaН (при нагревании 200-400 o C)
4) 6Li + N 2 = 2Li 3 N ( Li - при комнатной T , остальные щелочные Me - при нагревании)
5 ) 2Na + 2Н 2 О = 2NaОН + Н 2
( Li - спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н 2
Rb и Cs реагируют не только
с жидкой Н 2 О , но и со льдом. .
6 ) 2Na+ Н 2 S О 4 = Na 2 S О 4 + Н 2
(протекают очень бурно)

Качественное определение щелочных металлов
03.11.18
Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки.
Li+ - карминово-красный K+ - фиолетовый Cs+ фиолетово-синий
Na+ - желтый Rb + - красный
Li+ Na+ K+
15

Получение щелочных металлов
1) Электролиз расплавов соединений щелочных металлов:
2МеCl = 2Ме + Cl 2
4МеOH = 4Ме + 2Н 2 О + О 2
2) Восстановление оксидов и гидроксидов щелочных металлов:
2Li 2 O + Si = 4Li + SiO 2
KOH + Na = NаOH + K

Применение щелочных металлов
Питьевая сода применяется в кулинарии, для выпечки кондитерских изделий.
Хлорид натрия - как добавка к пище
Раствор хлорида натрия (0,9%) применяется в медицине. Такой раствор называется физиологическим
Калийные удобрения играю важную роль в жизни растений.
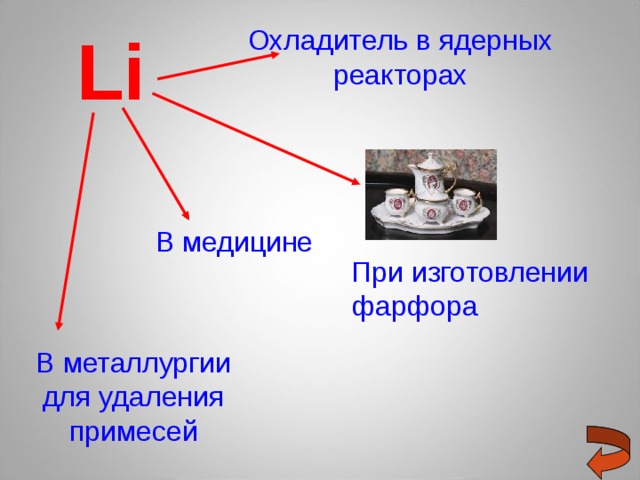
Li
Охладитель в ядерных реакторах
В медицине
При изготовлении фарфора
В металлургии для удаления примесей
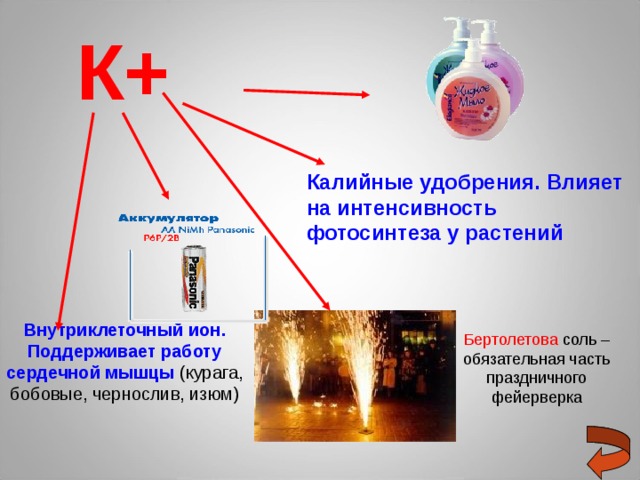
К+
Калийные удобрения . Влияет на интенсивность фотосинтеза у растений
Внутриклеточный ион . Поддерживает работу сердечной мышцы (курага, бобовые, чернослив, изюм)
Бертолетова соль – обязательная часть праздничного фейерверка
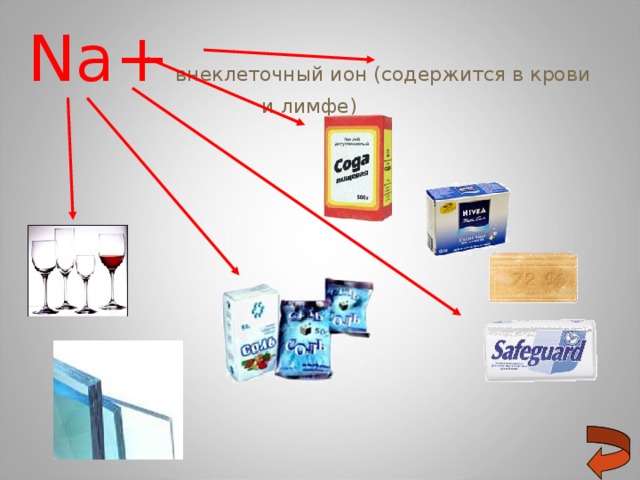
Na+ внеклеточный ион (содержится в крови и лимфе)
![03.11.18 Фотография Описание минерала Химический состав LiAl[Si 2 O 6 ] Цвет Бесцветный, красный, желтый, зеленый Плотность Твердость 3,1—3,2 г/см 3 6,5 Сподуменн](https://fsd.multiurok.ru/html/2018/11/03/s_5bddd1b4d0f12/img20.jpg)
03.11.18
Фотография
Описание минерала
Химический состав
LiAl[Si 2 O 6 ]
Цвет
Бесцветный, красный, желтый, зеленый
Плотность
Твердость
3,1—3,2 г/см 3
6,5
Сподуменн
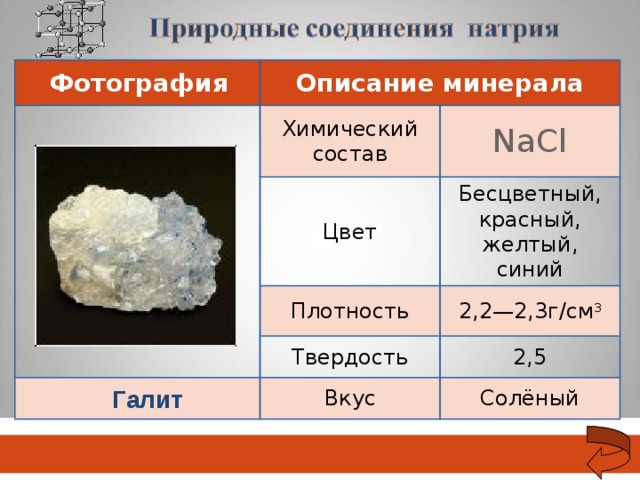
03.11.18
Фотография
Описание минерала
Химический состав
Na С l
Цвет
Бесцветный, красный, желтый, синий
Плотность
2,2—2,3г/см 3
Твердость
2,5
Вкус
Солёный
Галит

03.11.18
Фотография
Описание минерала
Химический состав
КС l
Цвет
Бесцветный, молочно-белый, темно-красный, розовый
Плотность
1,97-1,99 г/см 3
Твердость
1,5
Вкус
Едкий
Сильвин

03.11.18
Фотография
Описание минерала
Химический состав
MgCl 2 ·KCl·6H 2 O
Цвет
Красный, желтый, белый, бесцветный
Плотность
1,6г/см 3
Твердость
1,5
Вкус
Жгучий соленый
Карналит
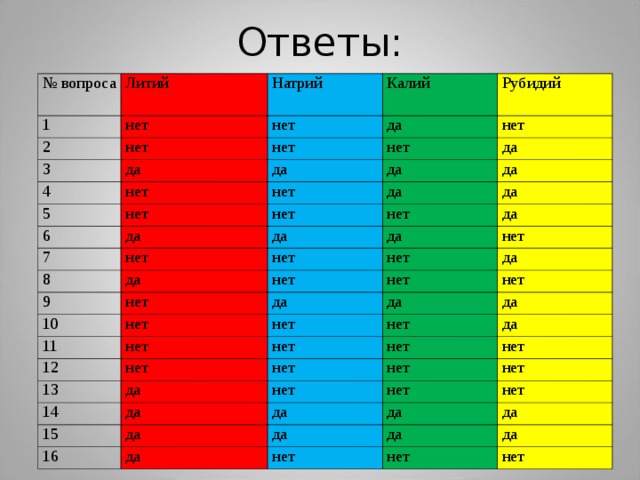
Ответы:
№ вопроса
Литий
1
Натрий
2
нет
нет
нет
Калий
3
да
да
Рубидий
нет
4
нет
да
нет
нет
5
да
нет
да
нет
6
да
да
да
7
нет
да
нет
да
8
нет
9
да
нет
да
да
нет
10
нет
нет
нет
нет
да
нет
да
11
нет
нет
да
нет
12
13
нет
нет
нет
да
да
да
нет
нет
14
15
да
нет
нет
нет
16
нет
да
да
нет
да
да
нет
да
да
да
нет
да
нет
нет

Проверка выполненных заданий:
- 2 М + 2H 2 O → 2 М OH + H 2 ( щелочь и водород)
- 2 М + Cl 2 → 2 М Cl ( галогениды)
- 4Li + O 2 → 2Li 2 O( оксид лития)
- 2 Na + O 2 → Na 2 O 2 ( пероксид натрия)
- K + O 2 → KO 2 ( надпероксид калия)
- 2М + Н2 → 2 М H (гидриды)
- 6 М + N 2 → 2 М 3 N ( нитриды)

сегодня на уроке…
было интересно… было трудно… я выполнял задания… я понял, что… теперь я могу… я почувствовал, что… я научился… я приобрел… у меня получилось … я смог… я попробую… меня удивило… урок дал мне для жизни… мне захотелось…
- было интересно… было трудно… я выполнял задания… я понял, что… теперь я могу… я почувствовал, что… я научился… я приобрел… у меня получилось … я смог… я попробую… меня удивило… урок дал мне для жизни… мне захотелось…

Домашнее задание
- Дайте характеристику химическим свойствам калия (записать уравнения реакций и рассмотреть их с точки зрения ОВР). Предложите применение щелочных металлов. Подумайте на тему: «Соединения щелочных металлов в природе.
- учебник § 11, стр.52-54


























![03.11.18 Фотография Описание минерала Химический состав LiAl[Si 2 O 6 ] Цвет Бесцветный, красный, желтый, зеленый Плотность Твердость 3,1—3,2 г/см 3 6,5 Сподуменн](https://fsd.multiurok.ru/html/2018/11/03/s_5bddd1b4d0f12/img20.jpg)


























