
Гидролиз

1.Что такое электролитическая диссоциация?
2.Какие вещества относятся к электролитам, какие к неэлектролитам?
3.Дайте определение кислот, щелочей, солей с точки зрения ТЭД.
4. Приведите примеры сильных и слабых электролитов.
5. К каким электролитам относится вода?
6.Какую реакцию среды имеют кислоты, основания, соли? Почему?
7.Как экспериментально определить характер среды?
8.Как лакмус изменяет окраску в растворах кислот и щелочей, солей?
Вторая страница
![Окраска индикаторов в различных средах Индикатор лакмус Кислая [H + ] красный Нейтральная фенолфталеин Метиловый оранжевый бесцветный Щелочная [OH - ] фиолетовый [H + ] =[OH - ] синий розовый бесцветный оранжевый малиновый желтый](https://fsd.multiurok.ru/html/2023/12/14/s_657b4f66e4bc7/img2.jpg)
Окраска индикаторов в различных средах
Индикатор
лакмус
Кислая
[H + ]
красный
Нейтральная
фенолфталеин
Метиловый оранжевый
бесцветный
Щелочная [OH - ]
фиолетовый
[H + ] =[OH - ]
синий
розовый
бесцветный
оранжевый
малиновый
желтый
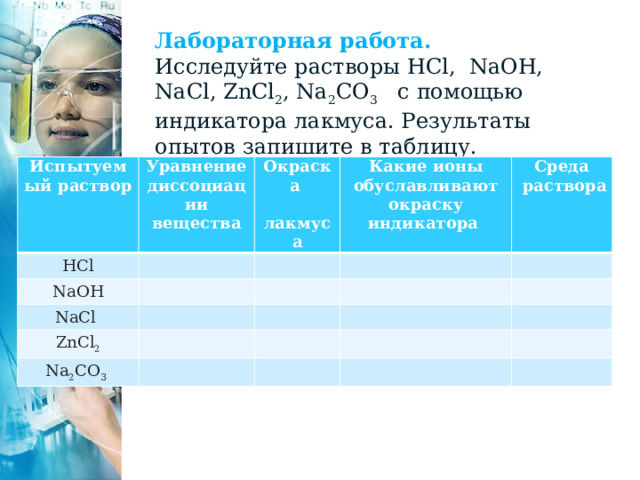
Лабораторная работа.
Исследуйте растворы HCl, NaOH, NaCl, ZnCl 2 , Na 2 CO 3 с помощью индикатора лакмуса. Результаты опытов запишите в таблицу.
Испытуемый раствор
Уравнение диссоциации вещества
HCl
Окраска
NaOH
лакмуса
Какие ионы обуславливают окраску индикатора
NaCl
ZnCl 2
Среда
раствора
Na 2 CO 3
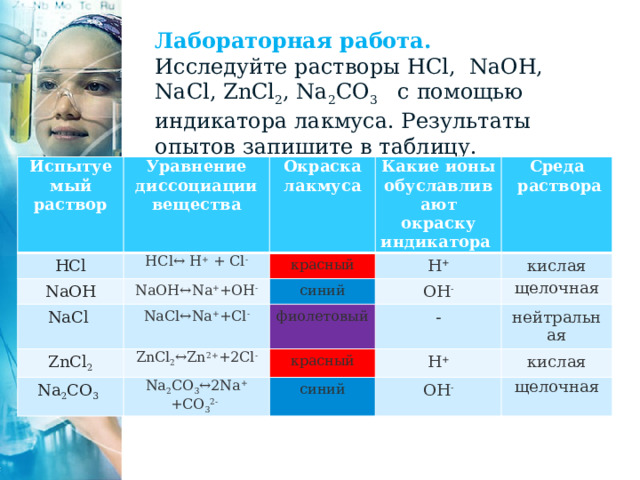
Лабораторная работа.
Исследуйте растворы HCl, NaOH, NaCl, ZnCl 2 , Na 2 CO 3 с помощью индикатора лакмуса. Результаты опытов запишите в таблицу.
Испытуемый раствор
Уравнение диссоциации вещества
HCl
NaOH
HCl↔ H + + Cl -
Окраска лакмуса
NaOH↔Na + +ОН -
Какие ионы обуславливают окраску индикатора
NaCl
красный
ZnCl 2
NaCl↔Na + +Cl -
синий
Среда
Н +
ОН -
раствора
ZnCl 2 ↔Zn 2+ +2Cl -
кислая
фиолетовый
Na 2 CO 3
щелочная
-
красный
Na 2 CO 3 ↔2Na + +CO 3 2-
Н +
нейтральная
синий
ОН -
кислая
щелочная

Тема: Гидролиз
Цель: изучить сущность гидролиза солей в водных
растворах.
Задачи :
сформулировать определение понятия «гидролиз»;
научиться объяснять химические процессы, протекающие в водных растворах солей;
научиться составлять полные и сокращенные ионные уравнения реакций гидролиза солей;
научиться записывать уравнения обратимого, необратимого, ступенчатого гидролиза и предсказывать среду растворов различных солей;
научиться применять теоретические знания в выполнении тестовых заданий по подготовке к ЕГЭ;
познакомиться с ролью гидролиза в природе, хозяйственной деятельности и повседневной жизни человека.
![Что представляет собой вода с точки зрения ТЭД? Н 2 О ↔Н + + ОН - [H + ] = [OH - ] Реакция чистой воды рН = 7, нейтральная. Для определения среды водных растворов пользуются водородным показателем – рН. рН = -lg[H + ] Водородный показатель (рН) – это отрицательный десятичный логарифм концентрации ионов водорода.](https://fsd.multiurok.ru/html/2023/12/14/s_657b4f66e4bc7/img6.jpg)
Что представляет собой вода с точки зрения ТЭД?
Н 2 О ↔Н + + ОН - [H + ] = [OH - ]
Реакция чистой воды рН = 7, нейтральная.
Для определения среды водных растворов пользуются водородным показателем – рН.
рН = -lg[H + ]
Водородный показатель (рН) – это отрицательный десятичный логарифм концентрации ионов водорода.
 7 нейтральная Концентрация ионов [H+] щелочная [H + ] = [OH - ] рН [OH - ] [H + ] кислотная [H + ] [OH - ] " width="640"
7 нейтральная Концентрация ионов [H+] щелочная [H + ] = [OH - ] рН [OH - ] [H + ] кислотная [H + ] [OH - ] " width="640"
Среды водных растворов
Значение рН
Среда
рН = 7
раствора
рН 7
нейтральная
Концентрация ионов [H+]
щелочная
[H + ] = [OH - ]
рН
[OH - ] [H + ]
кислотная
[H + ] [OH - ]

«ГИДРОЛИЗ» - от греческого « гидро » - вода « лизис » - разложение
Гидролиз – это реакция обмена между солями и водой приводящая к образованию слабого электролита .
Гидролизу подвергаются соединения различных классов: соли, углеводы, белки, жиры, сложные эфиры и др.

Любую соль можно представить как продукт взаимодействия основания с кислотой.
В зависимости силы основания и кислоты можно выделить 4 типа солей :
1.Соль, образованная сильным основанием и сильной кислотой.
2.Соль, образованная сильным основанием и слабой кислотой.
3.Соль, образованная слабым основанием и сильной кислотой.
4.Соль, образованная слабым основанием и слабой кислотой.

АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ
1. Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль.
2. Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды, помня, что слабые основания прочно удерживают гидроксид ионы, а слабые кислоты- протоны водорода; в результате получить краткое ионное уравнение гидролиза.
3. Написать на основании краткого ионного уравнения молекулярное уравнение. Исходные вещества известны – соль и вода. Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.

Схема гидролиза NaCl
В составе соли нет иона, который мог бы при взаимодействии с водой образовывать слабый электролит.

Схема гидролиза NaCl
В составе соли нет иона, который мог бы при взаимодействии с водой образовывать слабый электролит.

Сформулируем вывод:
Соль, образованная _________ основанием и _______ кислотой, имеет _________________ среду, так как в растворе __________.
Гидролиз ___________________.

Соль, образованная сильным основанием и сильной кислотой , имеет нейтральную среду , так как в растворе одинаковое количество ионов водорода и гидроксид-ионов . Гидролиз не идёт.
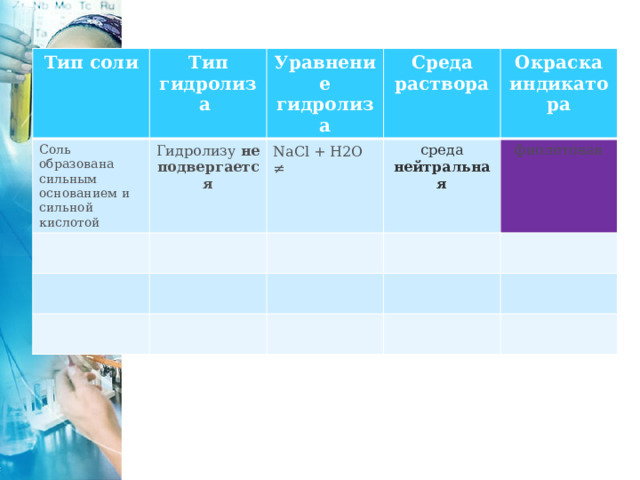
Тип соли
Тип гидролиза
Соль образована сильным основанием и сильной кислотой
Уравнение гидролиза
Гидролизу не подвергается
Среда раствора
NaCl + H2O ≠
Окраска индикатора
среда нейтральная
фиолетовая
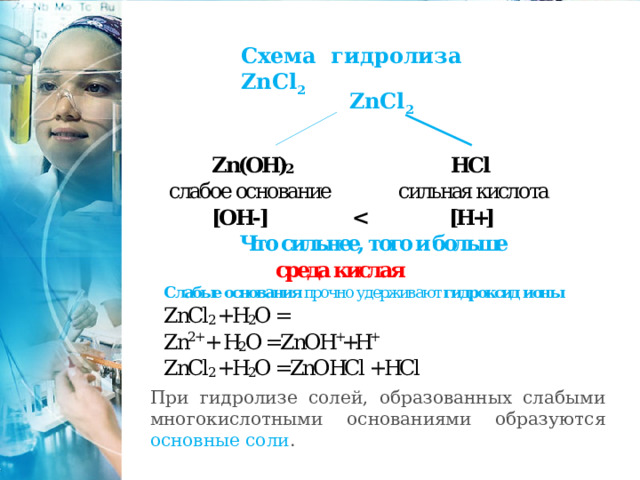
Схема гидролиза ZnCl 2
ZnCl 2
При гидролизе солей, образованных слабыми многокислотными основаниями образуются основные соли .

Сформулируем вывод:
Соль, образованная _________ основанием и _______ кислотой, имеет _________________ среду, так как в растворе __________.
Гидролиз ___________________.

Соль, образованная слабым основанием и сильной кислотой , имеет кислую среду , так как в растворе избыток ионов водорода .
Гидролиз идёт по катиону.
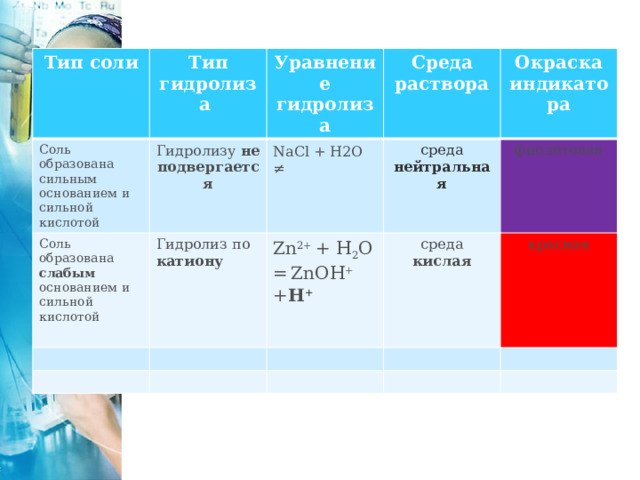
Тип соли
Тип гидролиза
Соль образована сильным основанием и сильной кислотой
Уравнение гидролиза
Гидролизу не подвергается
Соль образована слабым основанием и сильной кислотой
Гидролиз по катиону
NaCl + H2O ≠
Среда раствора
среда нейтральная
Окраска индикатора
Zn 2+ + H 2 O = ZnOH + + H +
среда кислая
фиолетовая
красная

Схема гидролиза Na 2 CO 3
Na 2 CO 3
При гидролизе солей, образованных слабыми многоосновными кислотами образуются кислые соли .

Сформулируем вывод:
Соль, образованная _________ основанием и _______ кислотой, имеет _________________ среду, так как в растворе __________.
Гидролиз ___________________.

Соль, образованная сильным основанием и слабой кислотой , имеет щелочную среду , так как в растворе избыток гидроксид-ионов . Гидролиз идёт по аниону.
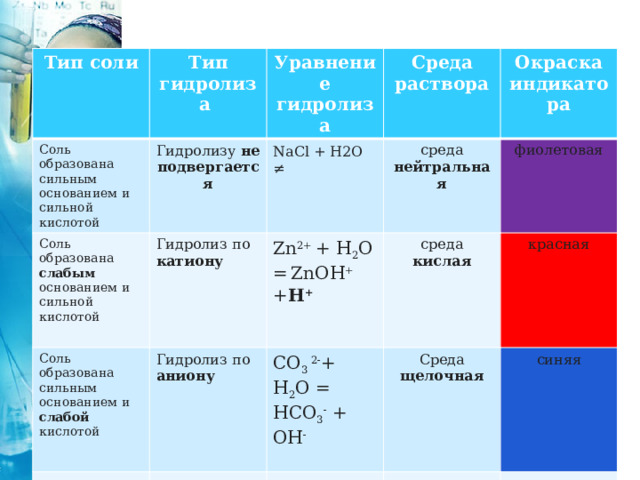
Тип соли
Тип гидролиза
Соль образована сильным основанием и сильной кислотой
Соль образована слабым основанием и сильной кислотой
Уравнение гидролиза
Гидролизу не подвергается
Соль образована сильным основанием и слабой кислотой
Гидролиз по катиону
Среда раствора
NaCl + H2O ≠
среда нейтральная
Окраска индикатора
Zn 2+ + H 2 O = ZnOH + + H +
Гидролиз по
CO 3 2- + H 2 O = HCO 3 - + OH -
аниону
фиолетовая
среда кислая
Среда щелочная
красная
синяя

Схема гидролиза Al 2 S 3
Al 2 S 3
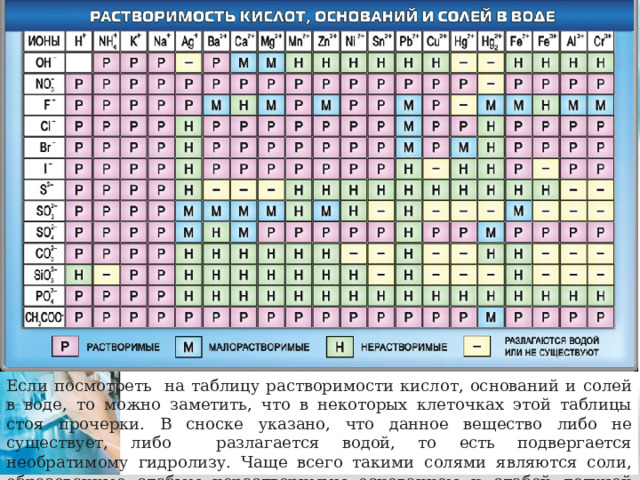
Если посмотреть на таблицу растворимости кислот, оснований и солей в воде, то можно заметить, что в некоторых клеточках этой таблицы стоя прочерки. В сноске указано, что данное вещество либо не существует, либо разлагается водой, то есть подвергается необратимому гидролизу. Чаще всего такими солями являются соли, образованные слабым нерастворимым основанием и слабой летучей кислотой.

.
По направлению реакции гидролиз может быть обратимый (соли 2 и 3 типа) и необратимый (полный) (соли 4 типа), когда хотя бы один из продуктов реакции гидролиза уходит из сферы реакции.

Сформулируем вывод:
Соль, образованная _________ основанием и _______ кислотой, полностью_____________ водой. Идет __________ гидролиз.

Соль, образованная слабым основанием и слабой кислотой , полностью разлагается водой . Идёт необратимый гидролиз .
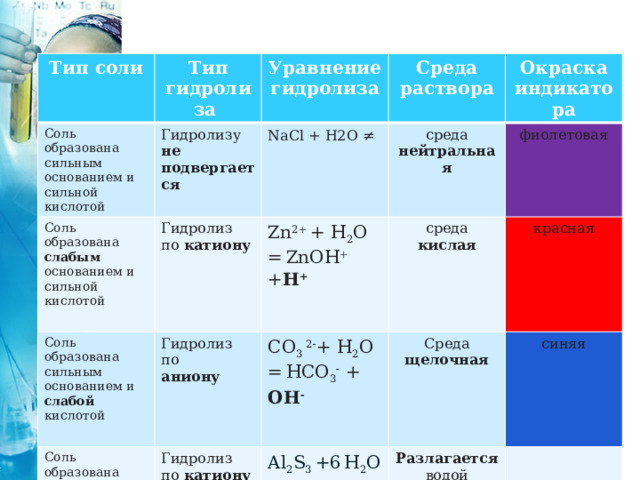
Тип соли
Тип гидролиза
Соль образована сильным основанием и сильной кислотой
Соль образована слабым основанием и сильной кислотой
Уравнение гидролиза
Гидролизу не подвергается
Среда раствора
Соль образована сильным основанием и слабой кислотой
NaCl + H2O ≠
Гидролиз по катиону
Zn 2+ + H 2 O = ZnOH + + H +
Соль образована слабым основанием и слабой кислотой
Гидролиз по
среда нейтральная
Окраска индикатора
CO 3 2- + H 2 O = HCO 3 - + OH -
аниону
Гидролиз по катиону и аниону
фиолетовая
среда кислая
красная
Среда щелочная
Al 2 S 3 +6 H 2 O =2Al(OH) 3 ↓ +3H 2 S↑
синяя
Разлагается водой

Реакция среды солей образованных слабым основанием и слабой кислотой
может быть нейтральная , или слабокислая , или слабощелочная , что зависит от констант диссоциации кислоты и основания.

Гидролиз органических веществ
Схема производства гидролизного спирта
(С 6 Н 10 О 5 ) n → С 6 Н 12 О 6 → С 2 Н 5 ОH
целлюлоза, опилки глюкоза спирт
Получение мыла
жиры + вода→ мыло + глицерин

Роль гидролиза
в повседневной жизни человека
Гидролиз – это начальная стадия пищеварения. Высокомолекулярные вещества (белки, жиры, полисахариды и др.), поступающие в организм с пищей, подвергаются в пищеварительном тракте ферментативному гидролизу с образованием низкомолекулярных соединений (аминокислот, жирных кислот и глицерина, глюкозы и др.), так как высасываться в кишечнике способны только относительно небольшие молекулы. Из этих «кирпичиков» организм в ходе пластического обмена строит свои собственные белки, жиры и углеводы. Эти процессы требуют значительного количества энергии.


Роль гидролиза
в повседневной жизни человека
Энергетический обмен- гидролиз АТФ
АТФ +Н 2 О→ АДФ+Н 3 РО 4 + 40 кДж

Роль гидролиза в природе
Преобразование земной коры.
Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород.
Известный нам малахит (Cu2(OH)2CO2) – не что иное, как продукт гидролиза природных карбонатов.

Роль гидролиза в природе
В Мировом океане соли также интенсивно взаимодействуют с водой. Выносимые речной водой гидрокарбонаты кальция и магния придают морской воде слабощелочную реакцию. Именно в такой слабощелочной среде прибрежных вод рН~9 наиболее интенсивно протекает фотосинтез в морских растениях, и наиболее быстро развиваются морские животные. А если вспомнить о составе рН крови млекопитающих, в том числе и человека, то можно не только сделать вывод о единстве животного мира на Земле но и сформулировать и некоторые гипотезы происхождении жизни на планете.

Роль гидролиза в народном хозяйстве
Подготовка тканей к окрашиванию: Образующийся при взаимодействии сульфата алюминия с водой мелкодисперсный осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая на ткань, и прочно соединяясь с ней, гидроксид алюминия легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани.
Очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия.
Гидролиз солей карбоната и фосфата натрия применяется для очистки воды и уменьшения ее жесткости.

Роль гидролиза в народном хозяйстве
Если кислотность почвы недостаточная, у растений появляется болезнь — хлороз. Ее признаки - пожелтение или побеление листьев, отставание в росте и развитии. В почву вносят удобрение сульфат аммония, которое способствует повышению кислотности, благодаря гидролизу по катиону, проходящему в почве.
Известкование почв с целью понижения их кислотности также основано на реакции гидролиза CO 3 2- + НОН →НСО 3 - + ОН -
Посредством гидролиза в промышленности из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы) вырабатывается ряд ценных продуктов: этиловый спирт, белковые дрожжи, бумага, мыло, глюкоза, сухой лед.

Роль гидролиза в повседневной жизни человека
Еще в древности в качестве моющего средства использовали золу. В золе содержится карбонат калия, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов ОН.
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые или калиевые соли высших жирных карбоновых кислот: стеараты, пальмиаты, которые гидролизуются.
В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения рН среды.

Бытовая химия: удобство во вред здоровью
Фосфаты- распространенные компоненты стиральных порошков, способные эффективно извлекать загрязнения из волокон тканей. Фосфаты отрицательно воздействуют на кожу, вызывая тяжелые дерматиты, а также сквозь поры попадают в кровоток, меняя биохимический состав крови. Кроме того, фосфаты могут стать причиной резкого обострения хронических заболеваний, нарушения обмена веществ, работы печени, почек, скелетных мышц.
Фосфаты практически не выполаскиваются из синтетических, хлопчатобумажных и шерстяных тканей. Чтобы их выполоскать требуется 8-10 раз прополоскать ткань в ГОРЯЧЕЙ воде, а современные программы автоматических стиральных машин прополаскивают в основном в холодной воде и не более 2-4 раз!!!

Бытовая химия: удобство во вред здоровью
Чтобы хоть как-то защитить себя и своих близких от влияния фосфатов, следует:
1. Прополаскивать более 8 раз в горячей воде одежду, белье.
2. Надевайте перчатки на руки не только с целью беречь нежную кожу, но и с целью защиты организма от вредных веществ.
3. Во время стирки старайтесь не находится в том же помещении и проветривайте квартиру при этом.
4. После стирки обязательно проведите влажную уборку в квартире.
5. Выбирайте моющие средства с ПАВ и фосфатами не более 5%, сертифицированные, без резкого запаха, герметично упакованные
6. Используйте минимальное количество любого дезодорирующего средства
7. Никогда не смешивайте различные средства для дезинфекции
8. Одевайте маску и перчатки при уборке и стирке.

Бытовая химия: удобство во вред здоровью
Попадая в природные водоемы, фосфаты вызывают цветение воды, поскольку служат удобрением для водорослей, а это приводит к гибели живых организмов рек, озер. На сегодняшний день многие производители отказываются от добавления в продукцию бытовой химии фосфатов, а в состав вводят поликарбоксилаты и цеолиты, как более экологичные вещества.

Домашнее задание
§18, №3,7








![Окраска индикаторов в различных средах Индикатор лакмус Кислая [H + ] красный Нейтральная фенолфталеин Метиловый оранжевый бесцветный Щелочная [OH - ] фиолетовый [H + ] =[OH - ] синий розовый бесцветный оранжевый малиновый желтый](https://fsd.multiurok.ru/html/2023/12/14/s_657b4f66e4bc7/img2.jpg)



![Что представляет собой вода с точки зрения ТЭД? Н 2 О ↔Н + + ОН - [H + ] = [OH - ] Реакция чистой воды рН = 7, нейтральная. Для определения среды водных растворов пользуются водородным показателем – рН. рН = -lg[H + ] Водородный показатель (рН) – это отрицательный десятичный логарифм концентрации ионов водорода.](https://fsd.multiurok.ru/html/2023/12/14/s_657b4f66e4bc7/img6.jpg)
 7 нейтральная Концентрация ионов [H+] щелочная [H + ] = [OH - ] рН [OH - ] [H + ] кислотная [H + ] [OH - ] " width="640"
7 нейтральная Концентрация ионов [H+] щелочная [H + ] = [OH - ] рН [OH - ] [H + ] кислотная [H + ] [OH - ] " width="640"






















































