
Тема урока: Гидролиз
солей

Что должны узнать на уроке:
- определение понятия «гидролиз»,
- научиться объяснять химические процессы, протекающие в водных растворах солей,
- научиться записывать уравнения реакций гидролиза.
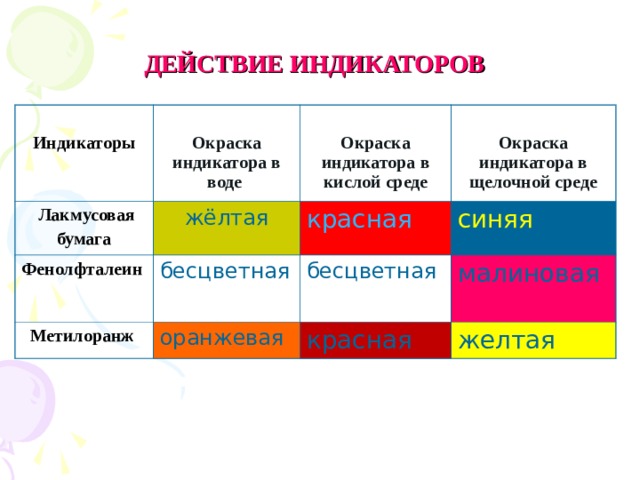
ДЕЙСТВИЕ ИНДИКАТОРОВ
Индикаторы
Окраска индикатора в воде
Лакмусовая
бумага
жёлтая
Окраска индикатора в кислой среде
Фенолфталеин
Метилоранж
Окраска индикатора в щелочной среде
красная
бесцветная
оранжевая
синяя
бесцветная
малиновая
красная
желтая

«Сильные и слабые электролиты» .
Основания
Сильные
Кислоты
Гидроксиды щелочных и щелочноземельных металлов: LiOH , KOH , NaOH , RbOH , CsOH , Ca ( OH ) 2 , Ba ( OH ) 2 , Sr ( OH ) 2
Слабые
HCl, H 2 SO 4 , HNO 3 , HI, HBr, HClO 4 , HClO 3
NH 4 OH и все нерастворимые основания
H 2 CO 3 , H 2 S, HClO, HClO 2 , H 3 PO 4 ,H 2 SiO 3 , HNO 2 , H 2 SO 3

« Почему растворы солей ведут себя по-разному?»

Внимание!
При работе не забывайте о правилах ТБ при обращении с химическими веществами.
 7 NaCl Нейтральная, слабощелочная или слабокислая ОН - Гидролизу не подвергается Н + и ОН - нейтральная рН = 7 Н + и ОН - " width="640"
7 NaCl Нейтральная, слабощелочная или слабокислая ОН - Гидролизу не подвергается Н + и ОН - нейтральная рН = 7 Н + и ОН - " width="640"
Гидролиз солей
№ п/п
Тип соли
1.
2.
Примеры
Образована слабым основанием и сильной кислотой.
Гидролиз
3.
Al Cl 3
Образована сильным основанием и слабой кислотой.
Образована слабым основанием и слабой кислотой.
Na 2 C O 3
Гидролиз по катиону
Среда раствора
и pH
4.
Кислая
рН
Гидролиз по аниону
Наличие ионов.
AI 2 S 3
Образована сильным основанием и сильной кислотой.
Н +
Гидролиз по катиону, и по аниону
Щелочная
рН 7
NaCl
Нейтральная,
слабощелочная или слабокислая
ОН -
Гидролизу
не подвергается
Н + и ОН -
нейтральная
рН = 7
Н + и ОН -
![AlCl 3 что сильнее, того и больше! Al ( OH ) 3 HCl слабое основание сильная кислота [ ОН] - Уравнение гидролиза: AICl 3 + НОН ↔ НС I + AIOHCl 2 AI 3+ + ЗС I - +НОН ↔ Н + +С I - + AI OH 2+ +2С I - AI 3+ + НОН ↔ AI OH 2+ + Н +](https://fsd.multiurok.ru/html/2020/05/31/s_5ed3aa405ca34/img7.jpg)
AlCl 3 что сильнее, того и больше!
Al ( OH ) 3 HCl
слабое основание сильная кислота
[ ОН] -
Уравнение гидролиза:
AICl 3 + НОН ↔ НС I + AIOHCl 2
AI 3+ + ЗС I - +НОН ↔ Н + +С I - + AI OH 2+ +2С I -
AI 3+ + НОН ↔ AI OH 2+ + Н +
 [ H ] + Уравнение гидролиза: Na 2 CO 3 + НОН ↔ NaOH + NaHCO 3 2Na + +СO 3 2- +НОН↔Na + +ОН - +Na + +HCO 3 - СO 3 2- + НОН ↔ ОН - + НСO 3 - " width="640"
[ H ] + Уравнение гидролиза: Na 2 CO 3 + НОН ↔ NaOH + NaHCO 3 2Na + +СO 3 2- +НОН↔Na + +ОН - +Na + +HCO 3 - СO 3 2- + НОН ↔ ОН - + НСO 3 - " width="640"
Na 2 CO 3
NaOH H 2 CO 3
сильное основание слабая кислота
[ ОН] - [ H ] +
Уравнение гидролиза:
Na 2 CO 3 + НОН ↔ NaOH + NaHCO 3
2Na + +СO 3 2- +НОН↔Na + +ОН - +Na + +HCO 3 -
СO 3 2- + НОН ↔ ОН - + НСO 3 -
![NaCl NaOH HCl сильное основание сильная кислота [ ОН] - = [ H ] + Уравнение гидролиза: NaCl + НОН ↔ NaOH + НС I Na + + С I - + НОН ↔ Na + + ОН - + Н + + С I - НОН ↔ ОН - + Н +](https://fsd.multiurok.ru/html/2020/05/31/s_5ed3aa405ca34/img9.jpg)
NaCl
NaOH HCl
сильное основание сильная кислота
[ ОН] - = [ H ] +
Уравнение гидролиза:
NaCl + НОН ↔ NaOH + НС I Na + + С I - + НОН ↔ Na + + ОН - + Н + + С I -
НОН ↔ ОН - + Н +
![Al 2 S 3 Al ( OH ) 3 H 2 S слабое основание слабая кислота [ ОН] - = [ H ] + Уравнение гидролиза: Al 2 S 3 + 6 НОН = 2 Al ( OH ) 3 + 3 H 2 S](https://fsd.multiurok.ru/html/2020/05/31/s_5ed3aa405ca34/img10.jpg)
Al 2 S 3
Al ( OH ) 3 H 2 S
слабое основание слабая кислота
[ ОН] - = [ H ] +
Уравнение гидролиза:
Al 2 S 3 + 6 НОН = 2 Al ( OH ) 3 + 3 H 2 S

гидролиз – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.

- Какую реакцию будут иметь водные растворы следующих солей:
1 вариант 2 вариант
а) нитрата цинка а) сульфида натрия
• Составьте молекулярное и сокращенное ионное уравнения гидролиза этих солей.

I вариант
Реакция раствора соли – кислая
Zn(NO 3 ) 2 + HOH ↔ HNO 3 + ZnOHNO 3
Zn 2+ + HOH ↔ ZnOH + + H +
II вариант
Реакция раствора соли – щелочная
Na 2 S + HOH ↔ NaOH + NaHS
S 2- + HOH ↔ OH - + HS -

Поставьте в тетрадках “+”, если вы с этим утверждением согласны:
1 – мне было комфортно на уроке
2 – я получил ответ на все интересующие меня вопросы
3 – я принимал активное участие во всех этапах урока.

Домашнее задание:
§16, стр.171-181, упр.2-6, приведите свои примеры солей, которые будут иметь кислую, щелочную и нейтральную реакцию и напишите к ним ионные уравнения гидролиза.













 7 NaCl Нейтральная, слабощелочная или слабокислая ОН - Гидролизу не подвергается Н + и ОН - нейтральная рН = 7 Н + и ОН - " width="640"
7 NaCl Нейтральная, слабощелочная или слабокислая ОН - Гидролизу не подвергается Н + и ОН - нейтральная рН = 7 Н + и ОН - " width="640"
![AlCl 3 что сильнее, того и больше! Al ( OH ) 3 HCl слабое основание сильная кислота [ ОН] - Уравнение гидролиза: AICl 3 + НОН ↔ НС I + AIOHCl 2 AI 3+ + ЗС I - +НОН ↔ Н + +С I - + AI OH 2+ +2С I - AI 3+ + НОН ↔ AI OH 2+ + Н +](https://fsd.multiurok.ru/html/2020/05/31/s_5ed3aa405ca34/img7.jpg)
 [ H ] + Уравнение гидролиза: Na 2 CO 3 + НОН ↔ NaOH + NaHCO 3 2Na + +СO 3 2- +НОН↔Na + +ОН - +Na + +HCO 3 - СO 3 2- + НОН ↔ ОН - + НСO 3 - " width="640"
[ H ] + Уравнение гидролиза: Na 2 CO 3 + НОН ↔ NaOH + NaHCO 3 2Na + +СO 3 2- +НОН↔Na + +ОН - +Na + +HCO 3 - СO 3 2- + НОН ↔ ОН - + НСO 3 - " width="640"
![NaCl NaOH HCl сильное основание сильная кислота [ ОН] - = [ H ] + Уравнение гидролиза: NaCl + НОН ↔ NaOH + НС I Na + + С I - + НОН ↔ Na + + ОН - + Н + + С I - НОН ↔ ОН - + Н +](https://fsd.multiurok.ru/html/2020/05/31/s_5ed3aa405ca34/img9.jpg)
![Al 2 S 3 Al ( OH ) 3 H 2 S слабое основание слабая кислота [ ОН] - = [ H ] + Уравнение гидролиза: Al 2 S 3 + 6 НОН = 2 Al ( OH ) 3 + 3 H 2 S](https://fsd.multiurok.ru/html/2020/05/31/s_5ed3aa405ca34/img10.jpg)























