
10 класс
Оксиды и гидроксиды металлов
Бозаджи Н.М.,
учитель химии,
высшая категория
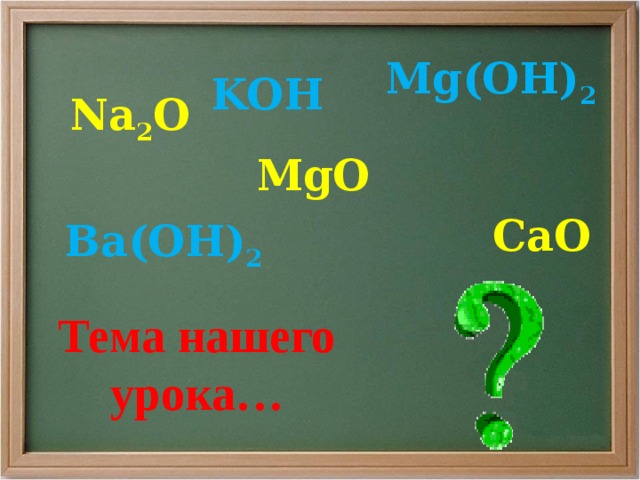
Mg(OH) 2
KOH
Na 2 O
MgO
CaO
Ba(OH) 2
Тема нашего урока…

... 05 .17г
Тема урока:
«Оксиды и гидроксиды металлов»

В результате изучения темы, вы будете способны:
- Давать определение МеО и МеОН
- Давать определение МеО и МеОН
2. Рассматривать способы получения МеО и МеОН
3. Рассматривать хим.св-ва МеО и МеОН
4. Осуществлять ЦП.
5. Решать задачи на смеси Ме
6.Осуществлять рефлексию своей деятельности
- 4. Осуществлять ЦП. 5. Решать задачи на смеси Ме 6.Осуществлять рефлексию своей деятельности

Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород .
Основания - сложные вещества, состоящие из атомов металла, соединенных с одной или несколькими гидроксогруппами.
- Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная степень окисления элементов.
- Na 2 O, Mg +2 O , Al 2 O 3
NaO Н , Mg +2 O Н , Al ( O Н) 3
- В главных подгруппах основные свойства оксидов и гидроксидов возрастают сверху вниз.
+3
+1
основные амфотерный
+1
+3
щелочь
Амфотерный
гидроксид
Слабое
основание



I. ПОЛУЧЕНИЕ ОКСИДОВ
1. Окислением простых веществ:
2 Cu + О 2 = 2 Cu О
2 .Горением сложных веществ:
FeS///////////////
3.Разложением сложных веществ при t o :
1. Нерастворимых оснований
Cu ( O Н) 2 = Cu О + H 2 O
2 . Некоторых солей
СаСО 3 = СО 2 + СаО
t 0
t 0

I. ПОЛУЧЕНИЕ ОКСИДОВ
1. Окислением простых веществ:
2 Cu + О 2 = 2 Cu О
2 .Горением сложных веществ:
FeS///////////////
3.Разложением сложных веществ при t o :
1. Нерастворимых оснований
Cu ( O Н) 2 = Cu О + H 2 O
2 . Некоторых солей
СаСО 3 = СО 2 + СаО
t 0
t 0


Оксиды щелочных металлов( I гр.гл)
- Общая формула Ме 2 О
- Твердые, кристаллические вещества белого цвета
- Типичные основные оксиды:
- Взаимодействуют с водой, образуя щелочи:
Na 2 О + H 2 O →
2 . Взаимодействуют с кислотами, образуя соль и воду: К 2 О + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: Na 2 О + SO 3 →
4. Взаимодействуют с амфотерными оксидами образуя соли: Na 2 О + ZnO(Zn(OH) 2) → Na 2 ZnO 2

Оксиды металлов II группы, главной подгруппы
- Общая формула МеО
- Твердые, кристаллические вещества белого цвета
- ВеО – амфотерный оксид
- Оксиды Mg, Ca, Sr, Ba – основные оксиды
![Оксиды металлов II группы, главной подгруппы Взаимодействуют с водой(кроме ВеО), образуя щелочи( MgO – слабое основание): СаО + H 2 O → 2 . Взаимодействуют с кислотами, образуя соль и воду: Mg О + Н Cl → 3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 → 4. ВеО взаимодействует со щелочами: ВеО + 2NaOH + H 2 O → Na 2 [ Ве (OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedfccb3ef07/img12.jpg)
Оксиды металлов II группы, главной подгруппы
- Взаимодействуют с водой(кроме ВеО), образуя щелочи( MgO – слабое основание):
СаО + H 2 O →
2 . Взаимодействуют с кислотами, образуя соль и воду: Mg О + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 →
4. ВеО взаимодействует со щелочами:
ВеО + 2NaOH + H 2 O → Na 2 [ Ве (OH) 4 ]


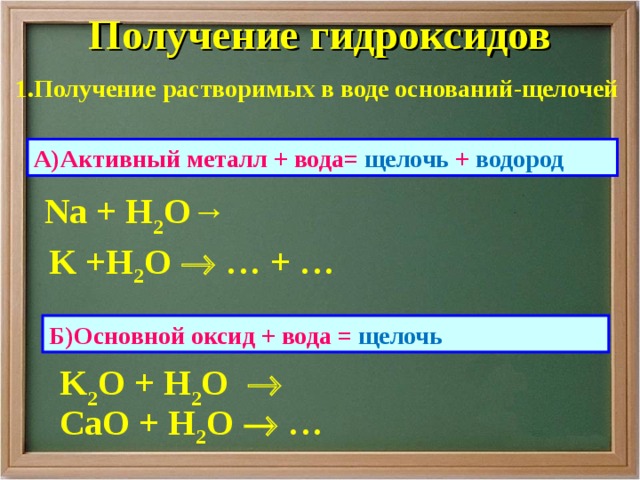
Получение гидроксидов
1.Получение растворимых в воде оснований-щелочей
А)Активный металл + вода= щелочь + водород
Na + H 2 O→
K +H 2 O … + …
Б)Основной оксид + вода = щелочь
K 2 O + H 2 O
Са O + H 2 O …



Гидроксиды щелочных металлов
- Общая формула – МеОН
- Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
Щелочи. Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH

Гидроксиды щелочных металлов
1. Изменяют цвет индикаторов:
Лакмус – на ….
Фенолфталеин – на ….
Метил-оранж – на ….
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → … + …
3. Взаимодействуют с кислотными оксидами.
NaOH + SO 3 → … + …
4. Взаимодействуют с растворами солей, если образуется газ или осадок.
NaOH + CuSO 4 → … + …
![Гидроксиды щелочных металлов 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными гидроксидами 2 NaOH + Zn (ОН) 2 → Na 2 [Zn(OH) 4 ] Zn(OH) 2 +2NaOH=Na 2 ZnO 2 +2H 2 O](https://fsd.multiurok.ru/html/2018/05/05/s_5aedfccb3ef07/img20.jpg)
Гидроксиды щелочных металлов
5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором)
2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑
6. Взаимодействуют с амфотерными гидроксидами
2 NaOH + Zn (ОН) 2 → Na 2 [Zn(OH) 4 ]
Zn(OH) 2 +2NaOH=Na 2 ZnO 2 +2H 2 O

Гидроксиды металлов II гр.гл.подгр
- Общая формула – Ме(ОН) 2
- Белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов. Ве(ОН) 2 – в воде нерастворим.
- Основные свойства усиливаются в ряду:
Ве(ОН) 2 → Mg (ОН) 2 → Ca (ОН) 2 → Sr (ОН) 2 → В a (ОН) 2

Гидроксиды металлов II гр.гл.подгр
- Ве(ОН) 2 – амфотерный гидроксид
- Mg (ОН) 2 – слабое основание
- Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи.
1. Изменяют цвет индикаторов:
Лакмус – ….
Фенолфталеин – …..
Метил-оранж – ….
2. Взаимодействуют с кислотами, образуя соль и воду:
Ве(ОН) 2 + Н 2 SO 4 →
3 . Взаимодействуют с кислотными оксидами.
Са(ОН) 2 + SO 3 →
![Гидроксиды металлов II гр.гл.подгр 4. Взаимодействуют с растворами солей, если образуется газ или осадок. Ва(ОН) 2 + K 2 SO 4 → Гидроксид бериллия взаимодействует со щелочами: Ве(ОН) 2 + 2NaOH → Na 2 [ Ве (OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedfccb3ef07/img23.jpg)
Гидроксиды металлов II гр.гл.подгр
4. Взаимодействуют с растворами солей, если образуется газ или осадок.
Ва(ОН) 2 + K 2 SO 4 →
- Гидроксид бериллия взаимодействует со щелочами:
Ве(ОН) 2 + 2NaOH → Na 2 [ Ве (OH) 4 ]


Рефлексия
Задание 1.
Осуществите цепочку превращений: упр.1 стр.232

Рефлексия
Задание 2 . Решите задачу:
Задача 1 . В результате полного восстановления 30,4 г смеси оксида железа ( II) FeO и оксида железа (III ) Fe 2 O 3 избытком CO было получено 11,2 л (н. у.) углекислого газа. Определите массовую долю оксидов железа в смеси.
Решение:
х г х моль
FeO +CO═Fe+ CO 2
72 г/моль 1 моль
у г у моль
Fe 2 O 3 + 3 CO═ 2 Fe+ 3 CO 2
160 г/моль 3 моль
|
{
30,4г
11,2л или 0,5 моль

Рефлексия
Задание 2 . Решите задачу:
Задача 1 . В результате полного восстановления 30,4 г смеси оксида железа ( II) FeO и оксида железа (III ) Fe 2 O 3 избытком CO было получено 11,2 л (н. у.) углекислого газа. Определите массовую долю оксидов железа в смеси.
Решение:
x+3y=0 , 5
72х+160у=30,4
х= 0,2моль
у=0,1моль
Ответ: w (FeO)=0,4737 или 47,37%
w (Fe 2 O 3 )=0,5263 или 52,63%
{

Рефлексия
Задание 2 . Решите задачу:
Задача 2. Масса воды после восстановления
водородом 31,9 г смеси оксида меди (II) и
оксида железа (II I ) составляет 9 г. Вычислить
состав смеси оксидов (в процентах по массе).
Решение:
х г х моль
С uO+H 2 ═Cu+ H 2 O
80 г/моль 1 моль
у г у моль
Fe 2 O 3 + 3 H 2 ═ 2 Fe+ 3 H 2 O
160 г/моль 3 моль
|
{
30,4г
9 г или 0,5 моль

Рефлексия
Задание 2 . Решите задачу:
Задача 2. Масса воды после восстановления
водородом 31,9 г смеси оксида меди (II) и
оксида железа (II I ) составляет 9 г. Вычислить
состав смеси оксидов (в процентах по массе).
Решение:
x+3y=0 , 5
80х+160у=30,4
х= 0,14моль
у=0,12моль
Ответ: w (С u O)=0,3684 или 36 , 84 %
w (Fe 2 O 3 )=0,6316 или 63,16%
{

Задача 3. На полную нейтрализацию раствора,
содержащего 34,2 г смеси гидроксидов натрия и
кальция, было израсходовано 29,4 г фосфорной
кислоты. Определите количественный состав исходной смеси.
Задача 4*. При взаимодействии 12 г смеси
оксидов меди (II) и магния с азотной кислотой
образовалось 33,6 г нитратов этих металлов.
Определить массовые доли оксидов в
исходной смеси.

Рефлексия
1.На уроке я работал… 2.Своей работой на уроке я… 3.Урок для меня показался… 4.За урок я… 5.Мое настроение… 6.Материал урока мне был…
активно, доволен, коротким, не устал, полезен, стало лучше, понятен, интересен, легким.

- Выучить конспект.
- Разобрать параграф: § 7.6
- Решить задачи конспекта

















![Оксиды металлов II группы, главной подгруппы Взаимодействуют с водой(кроме ВеО), образуя щелочи( MgO – слабое основание): СаО + H 2 O → 2 . Взаимодействуют с кислотами, образуя соль и воду: Mg О + Н Cl → 3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 → 4. ВеО взаимодействует со щелочами: ВеО + 2NaOH + H 2 O → Na 2 [ Ве (OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedfccb3ef07/img12.jpg)







![Гидроксиды щелочных металлов 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными гидроксидами 2 NaOH + Zn (ОН) 2 → Na 2 [Zn(OH) 4 ] Zn(OH) 2 +2NaOH=Na 2 ZnO 2 +2H 2 O](https://fsd.multiurok.ru/html/2018/05/05/s_5aedfccb3ef07/img20.jpg)


![Гидроксиды металлов II гр.гл.подгр 4. Взаимодействуют с растворами солей, если образуется газ или осадок. Ва(ОН) 2 + K 2 SO 4 → Гидроксид бериллия взаимодействует со щелочами: Ве(ОН) 2 + 2NaOH → Na 2 [ Ве (OH) 4 ]](https://fsd.multiurok.ru/html/2018/05/05/s_5aedfccb3ef07/img23.jpg)


























