
Учитель биологии : Бородина О.В. МБОУ г. Горловак « Школа № 68»

- Повторить классификацию неорганических веществ
- Обобщить и систематизировать знания учащихся о классах неорганических веществ
- Показать значение неорганических веществ в повседневной жизни

- Вещества
- Простые вещества
- Сложные вещества
- Оксиды
- Основания
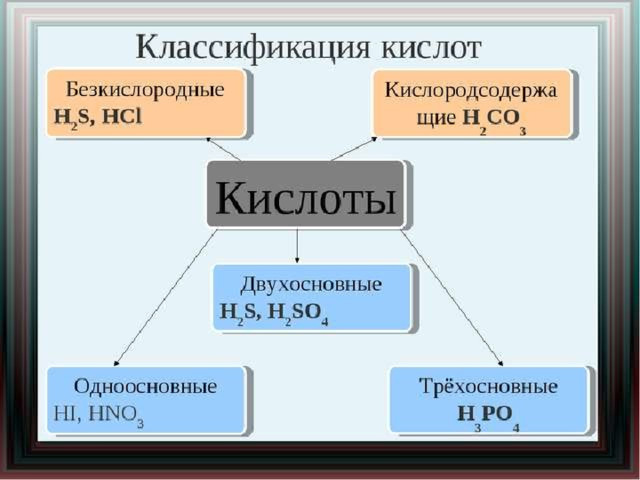
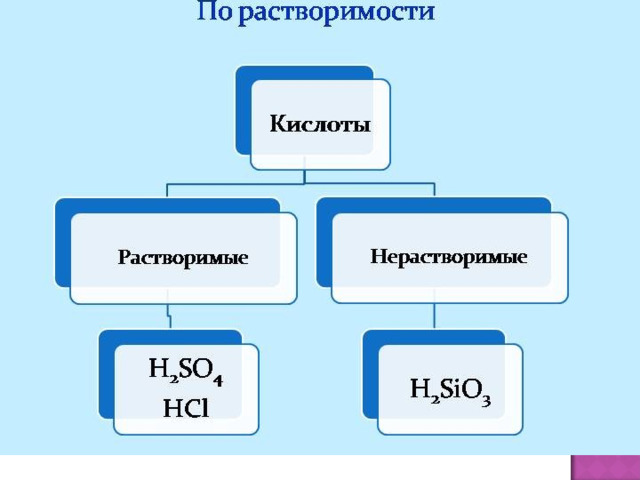
- Кислоты
- Соли
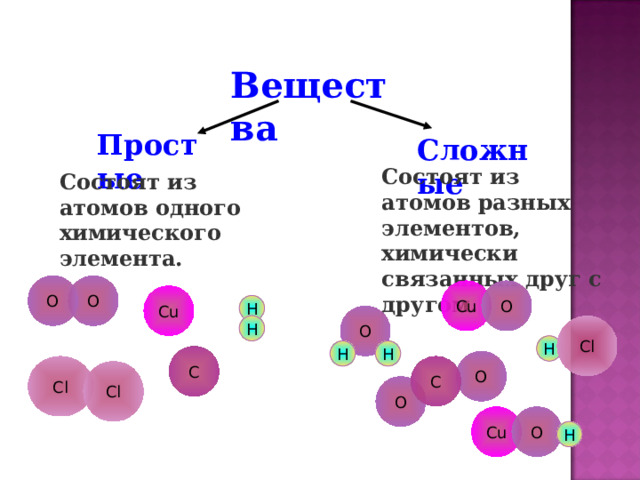
Вещества
Простые
Сложные
Состоят из атомов разных элементов, химически связанных друг с другом.
Состоят из атомов одного химического элемента.
О
О
Cu
О
Cu
Н
О
Cl
Н
Н
Н
Н
C
О
C
Cl
Cl
О
О
Cu
Н
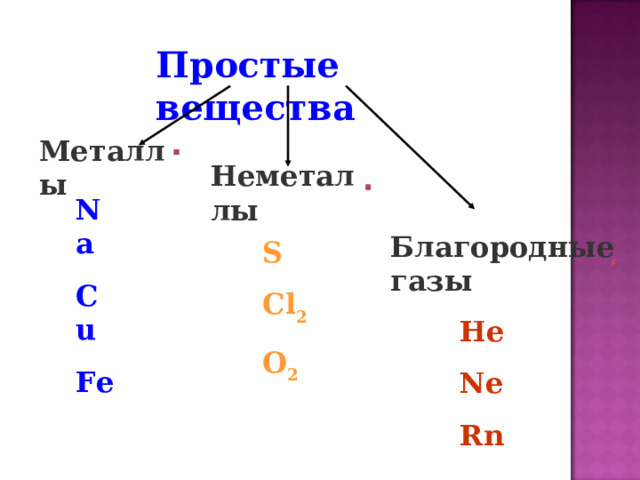
Простые вещества
Металлы
Неметаллы
Na
Cu
Fe
Благородные газы
S
Cl 2
O 2
He
Ne
Rn

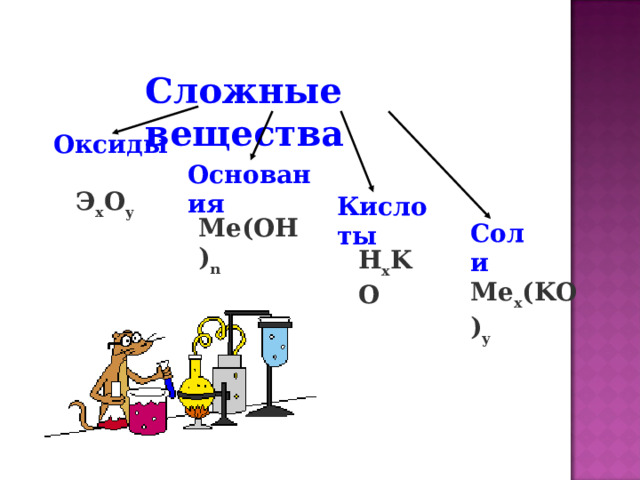
Сложные вещества
Оксиды
Основания
Э x O y
Кислоты
Me(OH) n
Соли
H x KO
Me x (KO) y
8


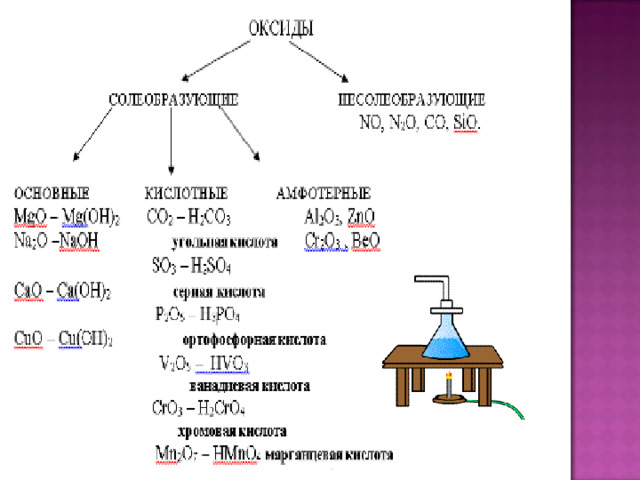
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления (-2).

Оксиды делят на несолеобразующие – они не реагируют ни с кислотами, ни с щелочами, не образуют солей. Это всего четыре оксида: CO, SiO, N 2 O, NO
Остальные оксиды являются солеобразующими. Среди них выделяют две группы. Кислотные оксиды , этим оксидам соответствуют кислоты, и, как правило – это оксиды неметаллов, или металлов побочных подгрупп в высшей степени окисления. Вторая группа основные оксиды – это оксиды металлов в степени окисления +1, +2, +3
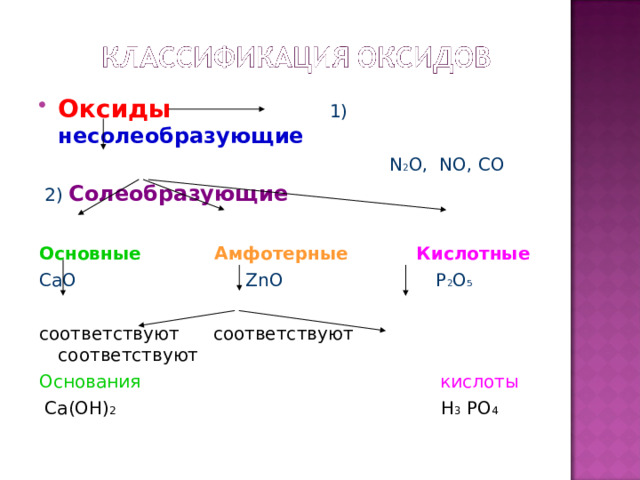
- Оксиды 1) несолеобразующие
N 2 O, NO, CO
2) Солеобразующие
Основные Амфотерные Кислотные
CaO ZnO P 2 O 5
соответствуют соответствуют соответствуют
Основания кислоты
Ca(OH) 2 H 3 PO 4

- Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
- Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами.
- Амфотерными оксидами , называют оксиды которые проявляют свойства как кислот, так и оснований .

Примеры основных оксидов:
Оксид кальция ;
Оксид магния ;
Оксид бария ;
Оксид меди(II) ;
Оксид ртути(II) ;
Оксид калия ;
Оксид натрия ;
Оксид лития ;

- Оксид серы( IV ) ;
- Оксид серы( VI ) ;
- Оксид углерода( IV) ;
- Оксид кремния( IV) ;
- Оксид фосфора( V) ;
- Оксид азота( V) ;
- Оксид хлора( VII) ;
- Оксид марганца ( VII)

- Оксид цинка ;
- Оксид бериллия ;
- Оксид свинца(II) ;
- Оксид олова(II) ;
- Оксид алюминия ;
- Оксид хрома(III ) ;
- Оксид железа (III ) ;
- Оксид ванадия(V) .
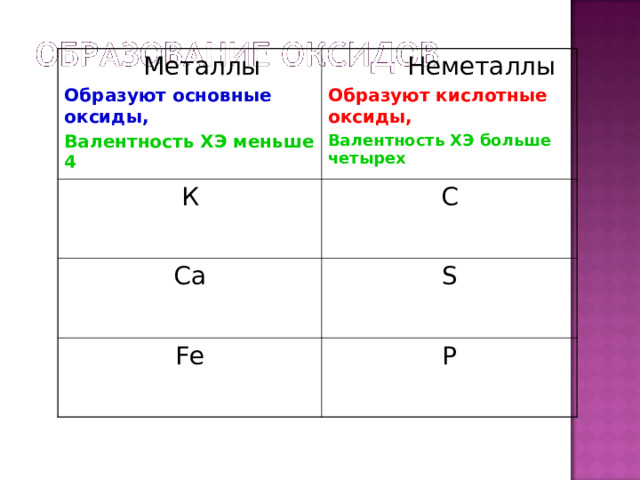
Металлы
Образуют основные оксиды,
Неметаллы
К
Валентность ХЭ меньше 4
Образуют кислотные оксиды,
С
С a
Валентность ХЭ больше четырех
S
Fe
P


- 1Ряд веществ, являющихся оксидами
А) Na 2 O, Na 2 O 2 , CuO, Cu 2 S
Б) FeO, Fe 2 O 3 , Fe 3 O 4 , FeCl 2
B) CO 2 , Cu 2 O, MgO, OF 2
Г ) Li 2 O, SO 3 , BeO, Cl 2 O 7 .
2Ряд основных оксидов .
.
А) ZnO, BeO, Al 2 O 3, Cr 2 O 3
Б ) ZnO, BeO, K 2 O, MgO
B) CO 2 , Cu 2 O, BaO, Al 2 O 3
Г ) CrO 3 , MnO, FeO, Na 2 O.
3 Ряд амфотерных оксидов:
А) SO 2 , SO 3 , V 2 O 5 , CuO
Б ) CaO, K 2 O, MgO, Li 2 O
B) ZnO, Mn 2 O 7 , MnO, Al 2 O 3
Г) P 2 O 5 , BeO, BaO, CO 2 .

Ряд кислотных оксидов :
А) Al 2 O 3 , SO 3 , BeO, Cl 2 O 7
Б) P 2 O 5 , Cl 2 O 7 , CrO 3 , Mn 2 O 7
B) Li 2 O, SO 3 , BeO, Cl 2 O 7
Г) SO 2 , SO 3 , CuO, Mn 2 O 3 .
5 Ряд несолеобразующих оксидов:
А) Li 2 O, SO 3 , BeO, Cl 2 O 7 .
Б) ZnO, Mn 2 O 7 , MnO, Al 2 O 3
В) CO, N 2 O, NO, SiO
Г) CrO 3 , MnO, FeO, Na 2 O.

Установите соответствие между формулами оксидов и характером их свойств.
Формулы оксидов
1) P 2 O 5 и SO 3
2) ZnO и SO 2
3) CO 2 и CO
4) СаО и FеО
Характер свойств оксидов
А) кислотный и кислотный
Б) основный и основный
В) амфотерный и кислотный
Г) амфотерный и основный
Д) солеобразующий и несолеобразующий

- 1-Г
- 2-Б
- 3-В
- 4-Б
- 5-В
- 6 1А 2В 3Д 4Б

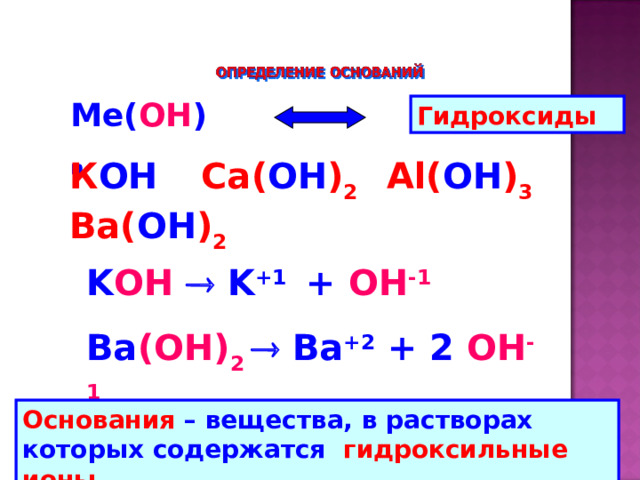
Ме( ОН ) n
Гидроксиды
К ОН Ca ( ОН ) 2 Al ( ОН ) 3 Ba ( ОН ) 2
K OH K +1 + OH -1
Ba (ОН) 2 Ba +2 + 2 OH -1
Основания – вещества, в растворах которых содержатся гидроксильные ионы
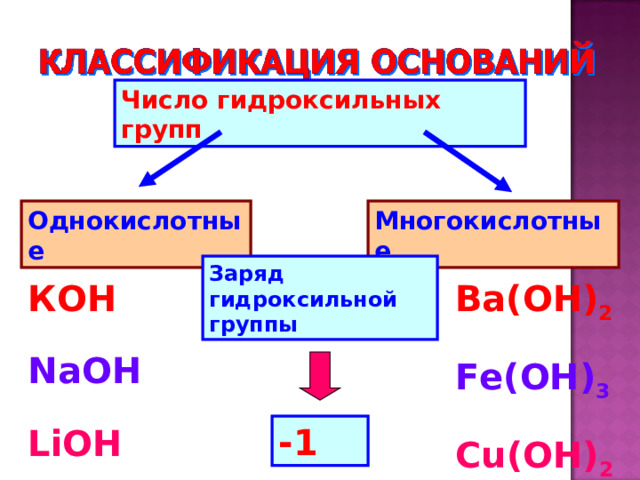
Число гидроксильных групп
Однокислотные
Многокислотные
Заряд гидроксильной группы
КОН
Ba( ОН ) 2
Fe(OH) 3
NaOH
Cu(OH) 2
LiOH
-1
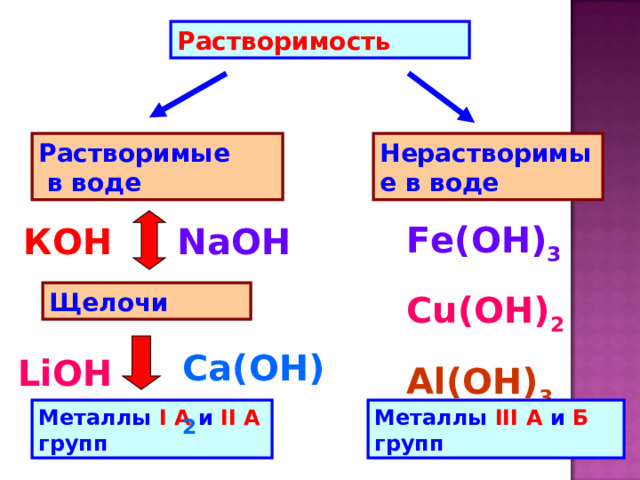
Растворимость
Растворимые в воде
Нерастворимые в воде
Fe(OH) 3
Cu(OH) 2
Al (ОН) 3
КОН
NaOH
Щелочи
Ca (ОН) 2
LiOH
Металлы I А и II А групп
Металлы III А и Б групп

Сильные основания
Слабые основания
NaOH гидроксид натрия (едкий натр)
KOH гидроксид калия (едкое кали)
LiOH гидроксид лития
Ba(OH) 2 гидроксид бария
Ca(OH) 2 гидроксид кальция
Mg(OH) 2 гидроксид магния
Fe(OH) 2 гидроксид железа (II)
Zn(OH) 2 гидроксид цинка
NH 4 OH гидроксид аммония
Fe(OH) 3 гидроксид железа (III)
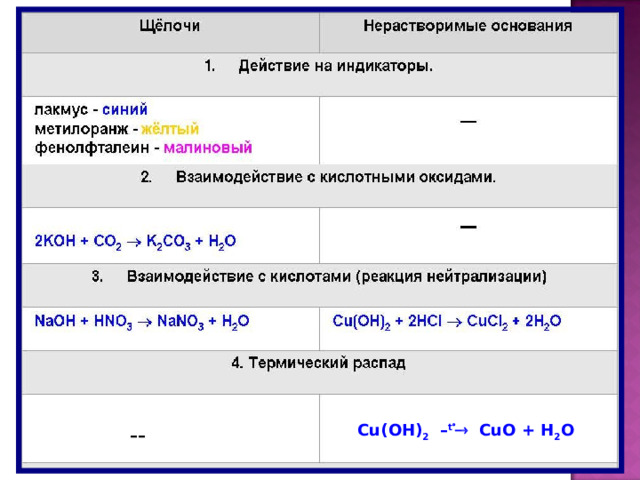
Cu(OH) 2 – t CuO + H 2 O
––







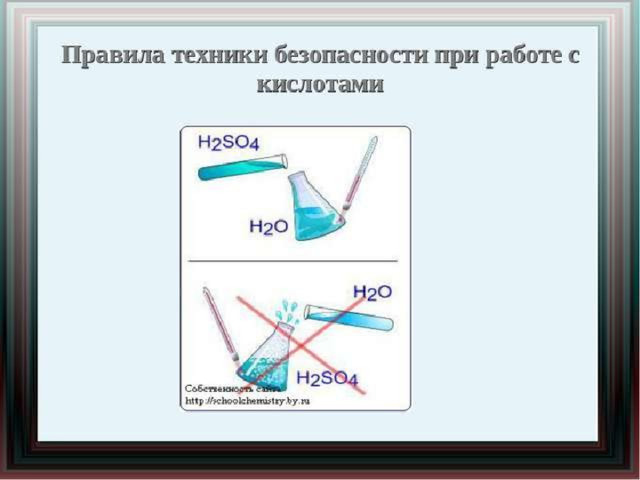
27
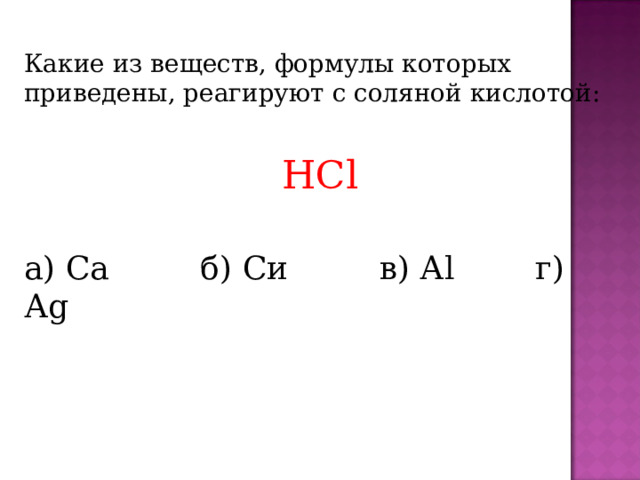
Какие из веществ, формулы которых приведены, реагируют с соляной кислотой:
HCl
а) С a б) Си в) А l г) А g

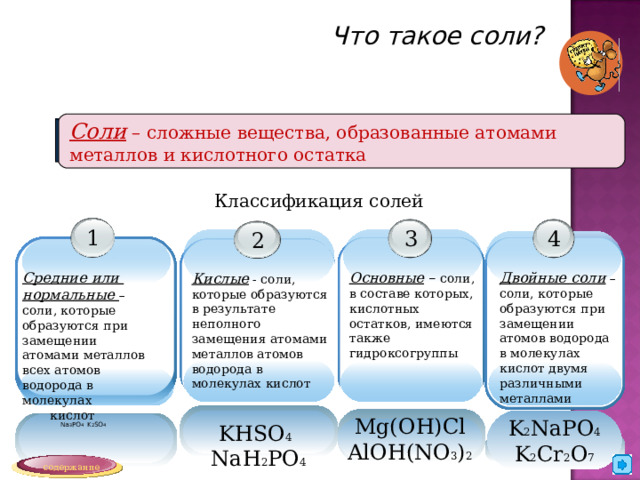
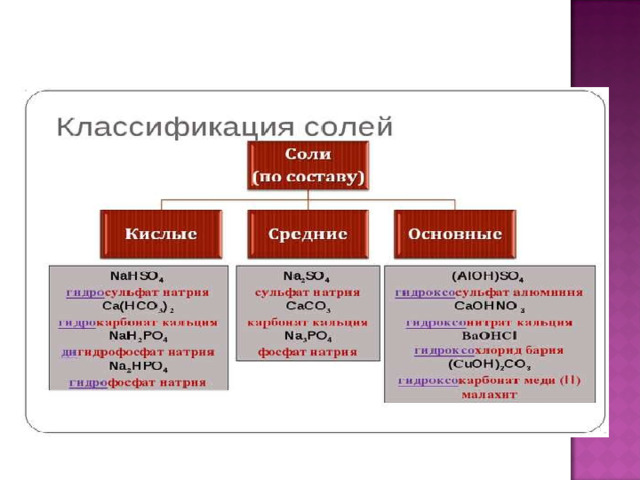
Что такое соли?
Соли – сложные вещества, образованные атомами металлов и кислотного остатка
Классификация солей
1
3
4
2
Средние или
нормальные – соли, которые образуются при замещении атомами металлов всех атомов водорода в молекулах
кислот
Основные – соли, в составе которых, кислотных остатков, имеются также гидроксогруппы
Двойные соли – соли, которые образуются при замещении атомов водорода в молекулах кислот двумя различными металлами
Кислые - соли, которые образуются в результате неполного замещения атомами металлов атомов водорода в молекулах кислот
K 2 NaPO 4
K 2 Cr 2 O 7
KHSO 4
NaH 2 PO 4
Na 3 PO 4 K 2 SO 4
Mg(OH)Cl
AlOH(NO 3 ) 2
содержание

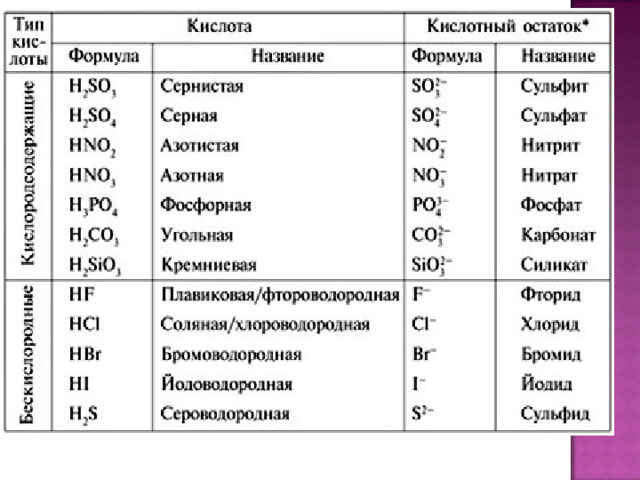

Экспресс-работа
Задание 1.
Найдите в каждом ряду «лишнее вещество» и объясните свой выбор: 1) CaO, NO, SO 2, MgO
2) NaOH, KOH, Ba(OH) 2 , Cu(OH) 2
3) HCl, NaOH, H 2 SO 4 , HNO 3
4) Na 2 SO 4 , Cu(NO 3 ) 2, CaCl 2 , KOH
Задание 2.
Распределить вещества по классам:
Fe(OH) 2 , H 2 SO 4 , NaCl , K 2 O , SO 3 , Mg (OH) 2 , CuO, Ca(NO 3 ) 2 , NaOH, HBr, CO 2 , HClO 4 , Ca (OH) 2 , HCl .
Назвать вещества.
3
2
2 O
2
2
2
2 SO 4
4
3 ) 2
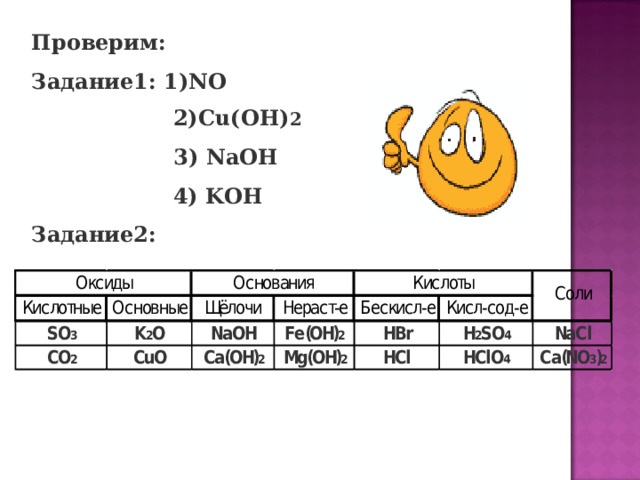
Проверим:
Задание1: 1) NO
2)Cu(OH) 2
3) NaOH
4) KOH
Задание2:
3
2
2 O
2
2
2
2 SO 4
4
3 ) 2

Составьте уравнения реакций, схема которой дана ниже:
CaCO3 CaO Ca(OH)2 CaCO3 Ca(NO3)2
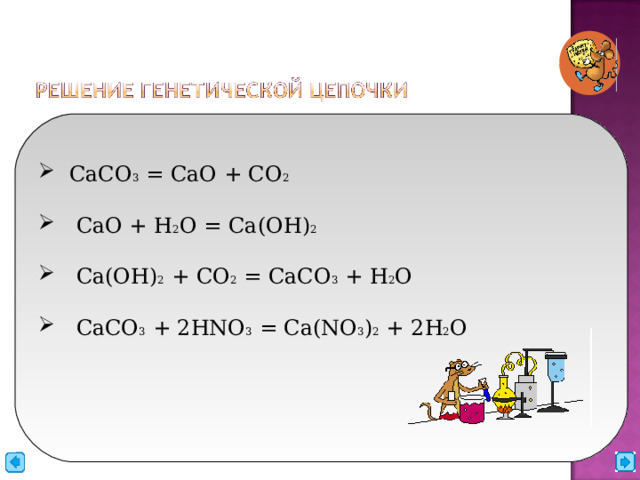
- СaCO 3 = CaO + CO 2
- CaO + H 2 O = Ca(OH) 2
- Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
- CaCO 3 + 2HNO 3 = Ca(NO 3 ) 2 + 2H 2 O









































































