
Применение первого закона термодинамики к решению графических задач
Автор: ИОЦУК Марина Владимировна,
учитель физики ГБОУ «Дьяковская гимназия имени И.М.Стрельченко»ЛНР

вспомни
- Какие формулировки первого закона термодинамики вам известны?
- Какие формулы используются?
= A
+ Q
Δ U
- Применение первого закона термодинамики к изобарному
процессу
+ A
Δ U
Q =
- Применение первого закона термодинамики к изотермическому процессу
Q = A
Т= const , Δ U = 0
Q = 0 + A
Q = Δ U
- Применение первого закона термодинамики к
изохорному процессу
Q = 0 + Δ U
V = const , A = 0
- Какой процесс называется адиабатным?
Δ U = А
- Применение первого закона термодинамики к
адиабатному процессу
Δ U = - А
Q = 0 , Δ U = 0 + А , Δ U = 0 - А
 0 - газ получает тепло , А 0 и 1-2 : V А Q = Δ U + A газ отдает тепло 2 -1: V 2 V р = const V T V 2 V 1 Каков характер теплообмена с окружающей средой? 2 р Изохора, т.е . V = const , А = 0 р 2 2 Т (т.к. переходим на изотерму, лежащую выше) 1-2: или второй способ рассуждения: т.к. р ,то и Т и Q = Δ U + A 0 - газ получает тепло значит, Δ U 0 Т (т.к. переходим на изотерму, лежащую ниже) 2 -1: 1 р 1 или : т.к. р , то и Т V значит, Δ U и Q = Δ U + A газ отдает тепло V " width="640"
0 - газ получает тепло , А 0 и 1-2 : V А Q = Δ U + A газ отдает тепло 2 -1: V 2 V р = const V T V 2 V 1 Каков характер теплообмена с окружающей средой? 2 р Изохора, т.е . V = const , А = 0 р 2 2 Т (т.к. переходим на изотерму, лежащую выше) 1-2: или второй способ рассуждения: т.к. р ,то и Т и Q = Δ U + A 0 - газ получает тепло значит, Δ U 0 Т (т.к. переходим на изотерму, лежащую ниже) 2 -1: 1 р 1 или : т.к. р , то и Т V значит, Δ U и Q = Δ U + A газ отдает тепло V " width="640"
Проанализируй графики
р
Определим характер теплообмена в ходе
процесса, изображенного на графике
1 .
1
Изотерма, т.е. Т = const , Δ U = 0 ,
Q = Δ U + A 0 - газ получает тепло
, А 0 и
1-2 :
V
А
Q = Δ U + A газ отдает тепло
2 -1:
V
2
V
р
= const
V
T
V 2
V 1
Каков характер теплообмена с окружающей средой?
2
р
Изохора, т.е . V = const , А = 0
р 2
2
Т (т.к. переходим на изотерму, лежащую выше)
1-2:
или второй способ рассуждения: т.к. р ,то и Т
и Q = Δ U + A 0 - газ получает тепло
значит, Δ U 0
Т (т.к. переходим на изотерму, лежащую ниже)
2 -1:
1
р 1
или : т.к. р , то и Т
V
значит, Δ U
и Q = Δ U + A газ отдает тепло
V
 0 1 р Изменяется ли внутренняя энергия при адиабатном процессе ? 3 T 1 РЕШЕНИЕ: 1 – 2 : При адиабатном расширении Т ( т.к. «переходим» с изотермы, лежащей выше на изотерму, лежащую ниже) 2 T 2 Δ U внутренняя энергия уменьшается V При адиабатном сжатии Т 2 -1 : т.к. «переходим» с изотермы, лежащей ниже на изотерму, лежащую выше) р внутренняя энергия увеличивается 4 В ходе изотермического или адиабатного процесса давление изменяется сильнее? Ответ обосновать. РЕШЕНИЕ: изотерма Очевидно, что в ходе адиабатного и изотермического расширения на величину Δ V . адиабата давление сильнее уменьшилось на адиабате. При изотермическом процессе давление уменьшается лишь за счет увеличения объема, а при адиабатном еще и за счет уменьшения температуры. V Δ V " width="640"
0 1 р Изменяется ли внутренняя энергия при адиабатном процессе ? 3 T 1 РЕШЕНИЕ: 1 – 2 : При адиабатном расширении Т ( т.к. «переходим» с изотермы, лежащей выше на изотерму, лежащую ниже) 2 T 2 Δ U внутренняя энергия уменьшается V При адиабатном сжатии Т 2 -1 : т.к. «переходим» с изотермы, лежащей ниже на изотерму, лежащую выше) р внутренняя энергия увеличивается 4 В ходе изотермического или адиабатного процесса давление изменяется сильнее? Ответ обосновать. РЕШЕНИЕ: изотерма Очевидно, что в ходе адиабатного и изотермического расширения на величину Δ V . адиабата давление сильнее уменьшилось на адиабате. При изотермическом процессе давление уменьшается лишь за счет увеличения объема, а при адиабатном еще и за счет уменьшения температуры. V Δ V " width="640"
Δ U 0
1
р
Изменяется ли внутренняя энергия при адиабатном процессе ?
3
T 1
РЕШЕНИЕ:
1 – 2 :
При адиабатном расширении Т
( т.к. «переходим» с изотермы, лежащей
выше на изотерму, лежащую ниже)
2
T 2
Δ U
внутренняя энергия уменьшается
V
При адиабатном сжатии Т
2 -1 :
т.к. «переходим» с изотермы, лежащей
ниже на изотерму, лежащую выше)
р
внутренняя энергия увеличивается
4
В ходе изотермического или адиабатного
процесса давление изменяется сильнее?
Ответ обосновать.
РЕШЕНИЕ:
изотерма
Очевидно, что в ходе адиабатного и
изотермического расширения на величину Δ V .
адиабата
давление сильнее уменьшилось на адиабате.
При изотермическом процессе давление уменьшается
лишь за счет увеличения объема, а при адиабатном
еще и за счет уменьшения температуры.
V
Δ V
 S 2 значит , А 1 A 2 V 3. Согласно первому закону термодинамики, так как Δ U 1 = Δ U 2 и А 1 A 2 , то Q 1 Q 2 ВАЖНО: При совпадении начального и конечного состояний, газ совершает большую работу и получает большее количество теплоты в ходе того процесса, график которого лежит выше в координатах Р V " width="640"
S 2 значит , А 1 A 2 V 3. Согласно первому закону термодинамики, так как Δ U 1 = Δ U 2 и А 1 A 2 , то Q 1 Q 2 ВАЖНО: При совпадении начального и конечного состояний, газ совершает большую работу и получает большее количество теплоты в ходе того процесса, график которого лежит выше в координатах Р V " width="640"
A
Идеальный газ переходит из состояния А в состояние В сначала в ходе процесса 1, а затем в ходе процесса 2. Сравните, в ходе процессов 1 и 2 :
- одинаково ли изменяется внутренняя энергия
- одинаковая ли совершается работа
- одинаковое ли количество теплоты получает газ
5
РЕШЕНИЕ:
P
Запишем первый закон термодинамики
Q = Δ U + A
1. Внутренняя энергия – это функция состояния, а так как начальное и конечное состояния газа в ходе процессов 1 и 2 одинаковы, то и изменение внутренней энергии одинаково:
1
2
B
Δ U 1 = Δ U 2
2. Сравним площади фигур под графиками процессов 1 и 2 :
S 1 S 2 значит , А 1 A 2
V
3. Согласно первому закону термодинамики,
так как Δ U 1 = Δ U 2 и А 1 A 2 , то Q 1 Q 2
ВАЖНО: При совпадении начального и конечного состояний, газ совершает большую работу и получает большее количество теплоты в ходе того процесса, график которого лежит выше в координатах Р V
 0 2 1 Q = Δ U + A 0 - газ получает тепло 3 2-4 : т.к. V = const , A = 0 Т 2 Т 4 , т.е. T 4 Δ U v Q = Δ U + A газ отдает тепло V 4 V 1 V 3 3-4 : V 4 Т 4 т.е . V и А V p Δ U = const Т.к. T Q = Δ U + A газ отдает тепло " width="640"
0 2 1 Q = Δ U + A 0 - газ получает тепло 3 2-4 : т.к. V = const , A = 0 Т 2 Т 4 , т.е. T 4 Δ U v Q = Δ U + A газ отдает тепло V 4 V 1 V 3 3-4 : V 4 Т 4 т.е . V и А V p Δ U = const Т.к. T Q = Δ U + A газ отдает тепло " width="640"
Определить характер теплообмена идеального газа с окружающей средой в ходе его перехода
из состояний 1, 2, 3 в состояние 4
6
р
1- 4 : Т= const , Δ U = 0
V 1
(изотерма)
A 0
2
1
Q = Δ U + A 0 - газ получает тепло
3
2-4 : т.к. V = const , A = 0
Т 2 Т 4 , т.е. T
4
Δ U
v
Q = Δ U + A газ отдает тепло
V 4
V 1
V 3
3-4 : V 4
Т 4
т.е . V
и А
V
p
Δ U
= const
Т.к.
T
Q = Δ U + A газ отдает тепло
 0 , т.к. Т ,значит, Q = Δ U 0 2 газ получает тепло 1 V , значит, , A 2 Т , значит, Δ U газ отдает тепло 3 т 3 Δ U = 0, т.к. Т = const V , значит, A 0 , т.о. Q 0 газ получает тепло " width="640"
0 , т.к. Т ,значит, Q = Δ U 0 2 газ получает тепло 1 V , значит, , A 2 Т , значит, Δ U газ отдает тепло 3 т 3 Δ U = 0, т.к. Т = const V , значит, A 0 , т.о. Q 0 газ получает тепло " width="640"
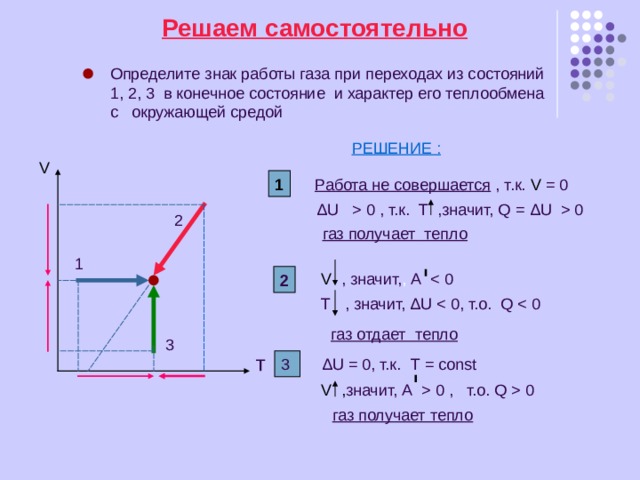
Решаем самостоятельно
Определите знак работы газа при переходах из состояний
1, 2, 3 в конечное состояние и характер его теплообмена
с окружающей средой
РЕШЕНИЕ :
V
1
Работа не совершается , т.к. V = 0
Δ U 0 , т.к. Т ,значит, Q = Δ U 0
2
газ получает тепло
1
V , значит, , A
2
Т , значит, Δ U
газ отдает тепло
3
т
3
Δ U = 0, т.к. Т = const
V , значит, A 0 , т.о. Q 0
газ получает тепло

Одинаковую ли работу выполнил газ во время переходов из состояния 1 в состояние 2 в ходе процессов а и б ?
р
РЕШЕНИЕ :
2
Нет, работа газа различна в ходе процессов
а и б несмотря на то, что площади фигур,
ограниченных графиками циклов, равны.
б
а
На участке 1-а работа отрицательна
( т.к. объем уменьшается), а на участке а-2 она положительна ( т.к. объем газа увеличивается. В итоге, работа газа в ходе процесса а положительна
1
V
На участке 1-б работа газа положительна ( т.к. объем увеличивается ), а на участке б-2 она отрицательна ( т.к. объем газа уменьшается).
В итоге, работа газа в ходе процесса б отрицательна.
Таким, образом, большая работа выполняется газом в ходе процесса а
V
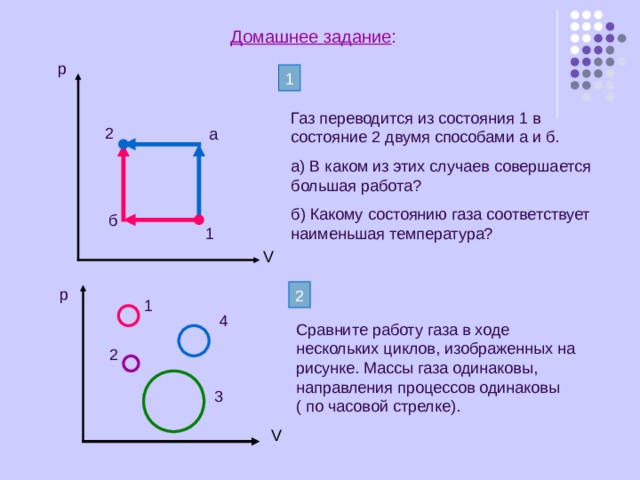
Домашнее задание :
р
1
Газ переводится из состояния 1 в состояние 2 двумя способами а и б.
а) В каком из этих случаев совершается большая работа?
б) Какому состоянию газа соответствует наименьшая температура?
2
а
б
1
р
2
1
4
Сравните работу газа в ходе нескольких циклов, изображенных на рисунке. Массы газа одинаковы, направления процессов одинаковы ( по часовой стрелке).
2
3
V

Использованная литература
- Г.Я.Мякишев и др. «Физика 10 класс»











 0 - газ получает тепло , А 0 и 1-2 : V А Q = Δ U + A газ отдает тепло 2 -1: V 2 V р = const V T V 2 V 1 Каков характер теплообмена с окружающей средой? 2 р Изохора, т.е . V = const , А = 0 р 2 2 Т (т.к. переходим на изотерму, лежащую выше) 1-2: или второй способ рассуждения: т.к. р ,то и Т и Q = Δ U + A 0 - газ получает тепло значит, Δ U 0 Т (т.к. переходим на изотерму, лежащую ниже) 2 -1: 1 р 1 или : т.к. р , то и Т V значит, Δ U и Q = Δ U + A газ отдает тепло V " width="640"
0 - газ получает тепло , А 0 и 1-2 : V А Q = Δ U + A газ отдает тепло 2 -1: V 2 V р = const V T V 2 V 1 Каков характер теплообмена с окружающей средой? 2 р Изохора, т.е . V = const , А = 0 р 2 2 Т (т.к. переходим на изотерму, лежащую выше) 1-2: или второй способ рассуждения: т.к. р ,то и Т и Q = Δ U + A 0 - газ получает тепло значит, Δ U 0 Т (т.к. переходим на изотерму, лежащую ниже) 2 -1: 1 р 1 или : т.к. р , то и Т V значит, Δ U и Q = Δ U + A газ отдает тепло V " width="640"
 0 1 р Изменяется ли внутренняя энергия при адиабатном процессе ? 3 T 1 РЕШЕНИЕ: 1 – 2 : При адиабатном расширении Т ( т.к. «переходим» с изотермы, лежащей выше на изотерму, лежащую ниже) 2 T 2 Δ U внутренняя энергия уменьшается V При адиабатном сжатии Т 2 -1 : т.к. «переходим» с изотермы, лежащей ниже на изотерму, лежащую выше) р внутренняя энергия увеличивается 4 В ходе изотермического или адиабатного процесса давление изменяется сильнее? Ответ обосновать. РЕШЕНИЕ: изотерма Очевидно, что в ходе адиабатного и изотермического расширения на величину Δ V . адиабата давление сильнее уменьшилось на адиабате. При изотермическом процессе давление уменьшается лишь за счет увеличения объема, а при адиабатном еще и за счет уменьшения температуры. V Δ V " width="640"
0 1 р Изменяется ли внутренняя энергия при адиабатном процессе ? 3 T 1 РЕШЕНИЕ: 1 – 2 : При адиабатном расширении Т ( т.к. «переходим» с изотермы, лежащей выше на изотерму, лежащую ниже) 2 T 2 Δ U внутренняя энергия уменьшается V При адиабатном сжатии Т 2 -1 : т.к. «переходим» с изотермы, лежащей ниже на изотерму, лежащую выше) р внутренняя энергия увеличивается 4 В ходе изотермического или адиабатного процесса давление изменяется сильнее? Ответ обосновать. РЕШЕНИЕ: изотерма Очевидно, что в ходе адиабатного и изотермического расширения на величину Δ V . адиабата давление сильнее уменьшилось на адиабате. При изотермическом процессе давление уменьшается лишь за счет увеличения объема, а при адиабатном еще и за счет уменьшения температуры. V Δ V " width="640"
 S 2 значит , А 1 A 2 V 3. Согласно первому закону термодинамики, так как Δ U 1 = Δ U 2 и А 1 A 2 , то Q 1 Q 2 ВАЖНО: При совпадении начального и конечного состояний, газ совершает большую работу и получает большее количество теплоты в ходе того процесса, график которого лежит выше в координатах Р V " width="640"
S 2 значит , А 1 A 2 V 3. Согласно первому закону термодинамики, так как Δ U 1 = Δ U 2 и А 1 A 2 , то Q 1 Q 2 ВАЖНО: При совпадении начального и конечного состояний, газ совершает большую работу и получает большее количество теплоты в ходе того процесса, график которого лежит выше в координатах Р V " width="640"
 0 2 1 Q = Δ U + A 0 - газ получает тепло 3 2-4 : т.к. V = const , A = 0 Т 2 Т 4 , т.е. T 4 Δ U v Q = Δ U + A газ отдает тепло V 4 V 1 V 3 3-4 : V 4 Т 4 т.е . V и А V p Δ U = const Т.к. T Q = Δ U + A газ отдает тепло " width="640"
0 2 1 Q = Δ U + A 0 - газ получает тепло 3 2-4 : т.к. V = const , A = 0 Т 2 Т 4 , т.е. T 4 Δ U v Q = Δ U + A газ отдает тепло V 4 V 1 V 3 3-4 : V 4 Т 4 т.е . V и А V p Δ U = const Т.к. T Q = Δ U + A газ отдает тепло " width="640"
 0 , т.к. Т ,значит, Q = Δ U 0 2 газ получает тепло 1 V , значит, , A 2 Т , значит, Δ U газ отдает тепло 3 т 3 Δ U = 0, т.к. Т = const V , значит, A 0 , т.о. Q 0 газ получает тепло " width="640"
0 , т.к. Т ,значит, Q = Δ U 0 2 газ получает тепло 1 V , значит, , A 2 Т , значит, Δ U газ отдает тепло 3 т 3 Δ U = 0, т.к. Т = const V , значит, A 0 , т.о. Q 0 газ получает тепло " width="640"






















