Просмотр содержимого документа
«Презентация. Основания. Классификация и свойства»

Муниципальное казенное образовательное учреждение Скляевская средняя
общеобразовательная школа Рамонского района Воронежской области
Основания.
Состав, классификация,
свойства.
Учитель химии: Бурлака Д. В.

План изучения темы:
- Состав, названия и определение оснований.
- Классификация оснований.
- Физические свойства оснований.
- Химические свойства оснований.

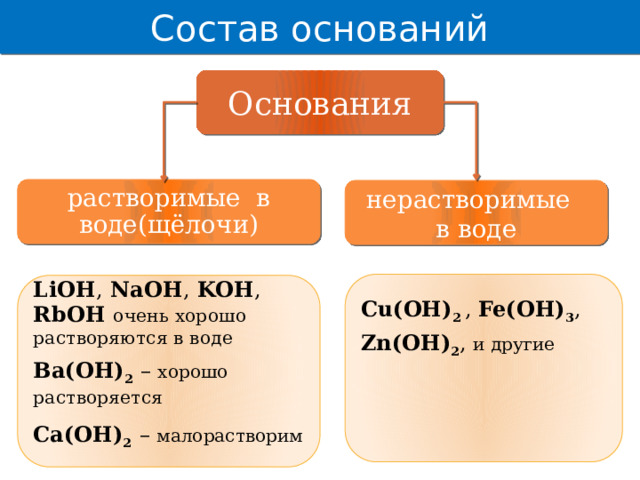
Состав оснований
Основаниями называют сложные вещества, в состав которых входят атомы металлов, соединенные с одной или несколькими группами атомов ОН.
Чтобы составить химические формулы оснований, необходимо руководствоваться свойством валентности:
К ОН — гидроксид калия , Ва( ОН ) 2 — гидроксид бария,
I
I
I
___
___
II
___
I
III
Аl( ОН ) 3 — гидроксид алюминия.
Если металл имеет переменную валентность, то последнюю указывают в названии основания римскими цифрами в скобках. Например:
Сu( ОH ) 2 — гидроксид меди(II), Сu ОН — гидроксид меди(I), Fе( ОН ) 3 — гидроксид железа(III), Fе( ОН ) 2 — гидроксид железа(II).
Состав оснований
Основания
растворимые в воде(щёлочи)
нерастворимые
в воде
Cu(OH) 2 , Fe(OH) 3 , Zn(OH) 2 , и другие
LiOH , NaOH , KOH , RbOH очень хорошо растворяются в воде
Ba(OH) 2 – хорошо растворяется
Сa(OH) 2 – малорастворим
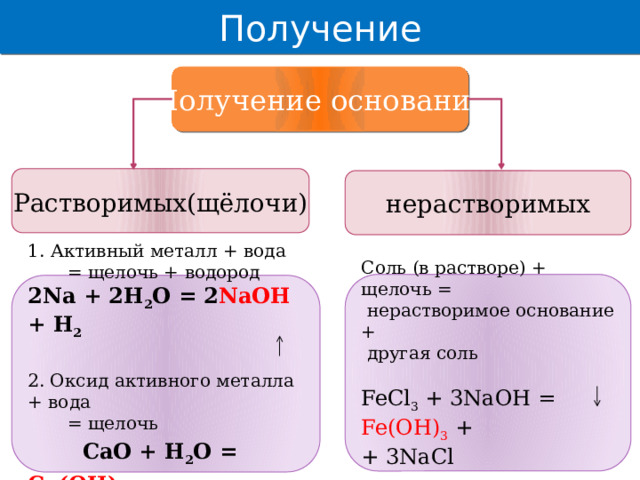
Получение
Получение оснований
нерастворимых
Растворимых(щёлочи)
Соль (в растворе) + щелочь =
нерастворимое основание +
другая соль
FeCl 3 + 3NaOH = Fe(OH) 3 +
+ 3NaCl
= щелочь + водород
2Na + 2H 2 O = 2 NaOH + H 2
2. Оксид активного металла + вода
= щелочь
CaO + H 2 O = Ca(OH) 2

Получение
Получение оснований
Cu Cl 2 + 2Na OH = Cu( OH ) 2 + 2Na Cl
хлорид
гидроксид
гидроксид
хлорид
меди (II)
меди (II)
натрия
натрия
Реакциями обмена называют реакции между двумя сложными веществами , в ходе которых они обмениваются составными частями.

Физические свойства
- Все основания металлов – твердые вещества. Как и соли, они могут быть бесцветными и окрашенными.
- Основания делятся на растворимые и нерастворимые в воде.
- Растворимые в воде основания образованы самыми активными металлами, которые реагируют с водой при обычных температурах. Эти металлы находятся в IA группе (щелочные металлы) и во IIA группе (щелочноземельные металлы).
Их гидроксиды называются щелочами .

Химические свойства
Вещества, которые под действием растворов щелочей и кислот по–разному изменяют свой цвет называют индикаторами (от лат. indicator — указатель).

Химические свойства
1. Разложение нерастворимых оснований при
нагревании:
Cu(OH) 2 = CuO + H 2 O
2. Взаимодействие щелочей с кислотными оксидами:
Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
t
гидроксид
оксид
меди (II)
меди (II)
голубого
черного
цвета
цвета

Химические свойства
3. Взаимодействие с кислотами:
NaOH + HCl = NaCl +H 2 O
Реакцию между кислотой и основанием, в результате которой образуются соль и вода, называют реакцией нейтрализации .

Химические свойства

Применение
- LiOH – в аккумуляторах.
- NaOH – для очистки нефти, производства мыла, в текстильной промышленности, для органического синтеза.
- KOH - в аккумуляторах.
- Ca(OH) 2 – в производстве сахара, соды, в строительстве, применяют для приготовления бордовской смеси – средства для борьбы с болезнями и вредителями растений.

Задание: из выбранного перечня формул оснований,
выберите щелочи и нерастворимые основания,
используя таблицу растворимости
KOH Cu(OH) 2
Al(OH) 3 CsOH
Mg(OH) 2 Ca(OH) 2
Zn(OH) 2 Fe(OH) 3
LiOH Cr(OH) 2


Домашнее задание
§ 31 упр.1 - 9






































