
Молекулярная физика. Тепловые явления
Тема:
Основы молекулярно-кинетической теории (МКТ)
10 класс

- Основные положения МКТ. Строение вещества. Молекула.
- Масса молекул. Количество вещества
- Броуновское движение.
- Строение газообразных, твердых и жидких тел.
- Идеальный газ в молекулярной теории. Давление газа. Основное уравнение МКТ.

- Основные положения МКТ. Строение вещества. Молекула.
Макроскопическое тело – тело, состоящее из большого числа частиц.
Всё это время мы рассматривали процессы, происходящие с макроскопическими телами (или объектами макромира). Теперь же мы будем изучать их строение и процессы, протекающие внутри них.
Микроскопическое тело – тело, состоящее из одной или нескольких частиц.

Основные цели курса МКТ:
- Изучение процессов, происходящих внутри макроскопического тела (движение и взаимодействие частиц)
- Свойства тел (плотность, масса, давление (для газов)…)
- Изучение тепловых явлений (нагревание-охлаждение, изменения агрегатных состояний тела)

Основные положения МКТ:
- Все вещества состоят из большого количества частиц – молекул и атомов.
- Все частицы хаотически движутся.
- Частицы взаимодействуют друг с другом.

Все вещества состоят из большого количества частиц – молекул и атомов.
- Молекула – структурная единица вещества, состоящая из атомов.
- Атом – мельчайшая частица химического элемента. (Размеры атомов (их диаметр) имеет порядок см.)
Вещество, молекулы которого состоят из одного атома, называются атомарными , из большего количества – молекулярными . свойства макроскопических тел будут зависеть не только от количественной характеристики их микроскопического состава, но и от качественной.


Все частицы хаотически движутся
- Молекулы и атомы твёрдых тел совершают лишь небольшие колебания относительно своего постоянного положения;
- жидких – также совершают колебания, но из-за больших размеров межмолекулярного пространства иногда меняются местами друг с другом;
- частички газа, практически не сталкиваясь, свободно перемещаются в пространстве.
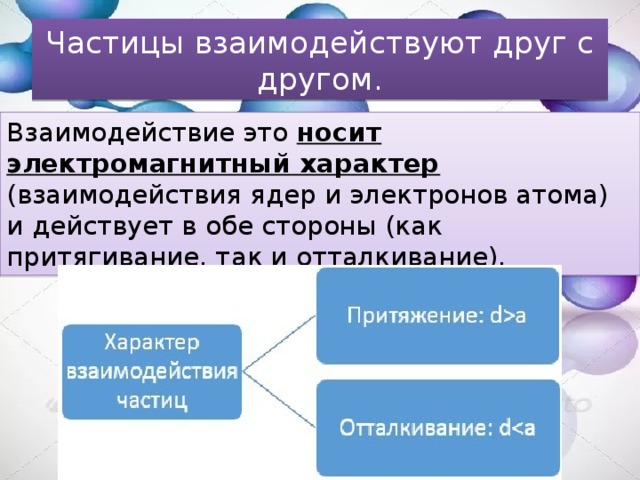
Частицы взаимодействуют друг с другом.
Взаимодействие это носит электромагнитный характер (взаимодействия ядер и электронов атома) и действует в обе стороны (как притягивание, так и отталкивание).
d – расстояние между частицами; a – размеры частиц (диаметр).
- Масса молекул. Количество вещества
Относительная атомная масса – отношения массы атома определённого химического элемента к одной двенадцатой массы атома углерода.
К примеру, в одном грамме воды содержится примерно молекул. Следовательно, по вышеуказанной формуле, масса молекулы воды составляет примерно кг. И опять-таки, если не принимать во внимание органические вещества, то массы молекул всех веществ соизмеримы по величине. Так как всегда неудобно работать со слишком большими или слишком маленькими величинами, в физике и химии введены такие величины, как относительная атомная масса (ОАМ) и относительная молекулярная масса (ОММ).
На данный момент все ОАМ известных элементов с довольно большой точностью рассчитаны и известны. Для нахождения относительной массы некой молекулы достаточно просто сложить относительные атомные массы тех элементов, которые входят в состав молекулы, причём столько раз, сколько штук атомов элемента входит в молекулу. На примере молекулы воды это выглядит:
Стоит добавить, что относительные атомные и молекулярные массы берутся из отношения к массе атома углерода, потому что углерод является одним из самых распространённых элементов в природе.

Количество вещества – физическая величина, характеризующая количество молекул, входящих в некую порцию вещества.
1 моль – такое количество вещества, которое содержит столько же молекул (атомов), сколько 12 г углерода.

Число Авогадро –количество атомов в 12 г углерода.
Амедео Авогадро

Молярная масса – масса одного моля вещества.
Найти значение молярной массы для любого химического элемента можно в таблице Менделеева. В ячейке для нужного вам элемента молярная масса – это десятичная дробь.


Диффузия – процесс взаимного проникновения молекул одного вещества в пространство между молекулами другого.
Так как же получить опытное подтверждение этих утверждений? На самом деле с одним из способов знаком каждый без исключения человек. Это диффузия, или смешивание, говоря простым языком.
Действительно, если предположить, что вещество – некая сплошная структура, становится совершенно непонятно, как объяснить все вышеупомянутые явления.
Однако основным аргументом в объяснении основных положений МКТ является броуновское движение.

Броуновское движение – непрерывное тепловое хаотическое движение молекул вещества
Этот термин вошёл в обиход после того, как в 1827 г. шотландский ботаник Роберт Броун, смешав пыльцу плавуна с водой и рассмотрев каплю смеси под микроскопом, наблюдал вышеупомянутое движение.
Однако, так как Броун мог рассмотреть в микроскоп лишь частицы пыльцы, он неправильно трактовал своё открытие (думал, что пыльца живая). Спустя почти век уже немецкий физик Альберт Эйнштейн понял, что крупную частицу пыльцы просто напросто толкают намного более мелкие молекулы воды, которые сами уже непосредственно движутся хаотически
Подобные наблюдения можно проводить множеством других способов: капните краской в воду и взгляните на смесь под микроскопом, понаблюдайте за отдельной пылинкой, движущейся у вас в квартире…
IV. Строение газообразных, твердых и жидких тел.
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые вращаются вокруг ядра. Атом, как и молекула, электрически нейтрален.
Рассмотрим силу взаимодействия между частицами на примере двух неподвижных молекул.
Между телами в природе существуют гравитационные и электромагнитные силы. Так как массы молекул крайне малы, то силы гравитационного взаимодействия между ними можно не рассматривать. На больших расстояниях электромагнитного взаимодействия между молекулами тоже нет.
При уменьшении расстояния между частицами (см. Рис. 1) они начинают ориентироваться так, что их обращённые друг к другу стороны будут иметь разные по знаку заряды (в целом молекулы остаются при этом нейтральными), и, в итоге, между молекулами возникают силы притяжения (максимальная сила притяжения на расстоянии 2–3 диаметров молекулы). При уменьшении расстояния между молекулами возникают силы отталкивания как результат взаимодействия отрицательно заряженных электронных оболочек атомов молекул. Следовательно, на молекулу действует сумма сил: притяжения и отталкивания (на больших расстояниях преобладает сила притяжения, на малых – сила отталкивания).

V. Идеальный газ. Давление газа. Основное уравнение МКТ
Идеальный газ – математическая модель газа, в которой предполагается, что:
а) потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией;
б) суммарный объём молекул газа пренебрежимо мал. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
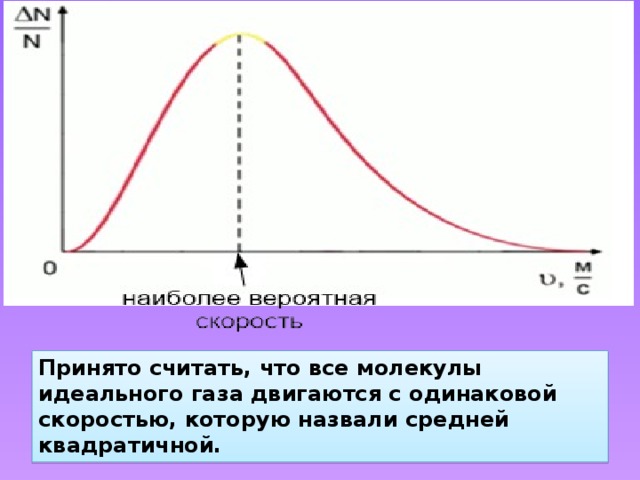
Принято считать, что все молекулы идеального газа двигаются с одинаковой скоростью, которую назвали средней квадратичной.

Средняя квадратичная скорость – это скорость, равная корню квадратному из средней арифметической величины квадратов скоростей отдельных молекул


Основное уравнение МКТ
Таким образом, основное уравнение МКТ вводит нам прямо пропорциональную зависимость макропараметра давления от микропараметров массы молекулы и средней скорости движения в квадрате. То есть чем тяжелее частицы и чем больше их скорости, тем сильнее они врезаются в стенки сосуда и тем большее оказывают давление.

Тема урока:
Температура. Энергия теплового движения молекул
- Температура и тепловое равновесие
- Абсолютная температура. Температура – мера средней кинетической энергии молекул

Тепловое равновесие – такое состояние тела, при котором его макроскопические параметры не меняются длительное время.
Температура – мера теплового равновесия тела или системы тел.

Связь абсолютной шкалы со шкалой Цельсия
Уильям Томсон,
лорд Кельвин
- британский физик и механик .
1824 - 1907
Андерс Цельсий — шведский астроном, геолог и метеоролог .
1701 - 1744

Запомни!
В формулах абсолютная температура обозначается буквой « Т »,
а температура по шкале Цельсия буквой « t ».
Т = t + 273

Молекулярно - кинетический смыл температуры.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е.
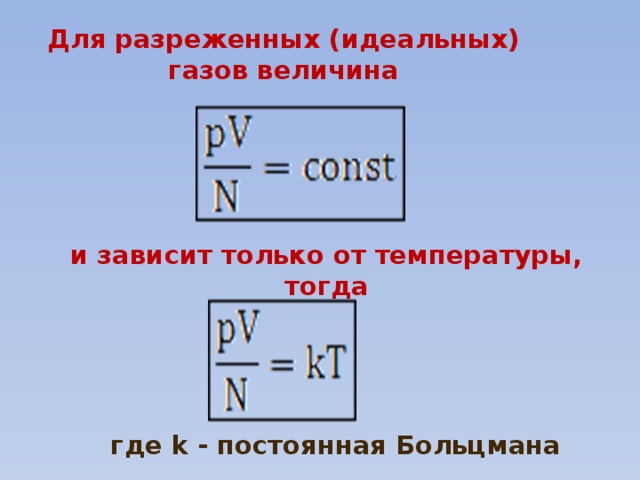
Для разреженных (идеальных) газов величина
и зависит только от температуры, тогда
где k - постоянная Больцмана

Следовательно ,
Средняя кинетическая энергия поступательного движения молекул

1
2
Т =
E
3
k
Температура - это физическая величина, являющаяся мерой средней кинетической энергии поступательного движения молекул.






















































