
Гидроксиды
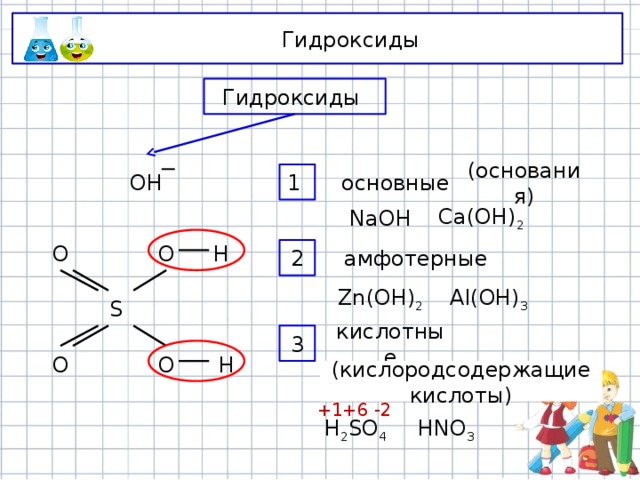
Гидроксиды
Гидроксиды
ОН
─
1
основные
(основания)
Ca(OH) 2
NaOH
H
O
O
амфотерные
2
Al(OH) 3
Zn(OH) 2
S
кислотные
3
O
O
H
(кислородсодержащие кислоты)
+6
-2
+1
H 2 SO 4
HNO 3

Основания
1
это электролиты, которые при диссоциации в водных растворах в качестве анионов отщепляют только гидоксид-ионы
Основания
сильные электролиты
слабые электролиты
(растворимые основания)
(нерастворимые и малорастворимые основания)
─
+
OH
+
Na
=
NaOH
+
─
Mg(OH) 2
MgOH
OH
+
2+
─
2OH
+
=
Ca(OH) 2
Ca
2+
─
─
Mg
MgOH
+
OH
─
2+
2OH
+
=
Ba(OH) 2
Ba

Химические свойства оснований
1
Изменяют окраску индикаторов
Щелочная среда
Нейтральная среда
Индикатор
фиолетовый
синий
лакмус
метиловый оранжевый
оранжевый
желтый
фенолфталеин
бесцветный
малиновый
Нерастворимые основания
на индикаторы не действуют (искл. Mg(OH) 2 )
Химические свойства оснований
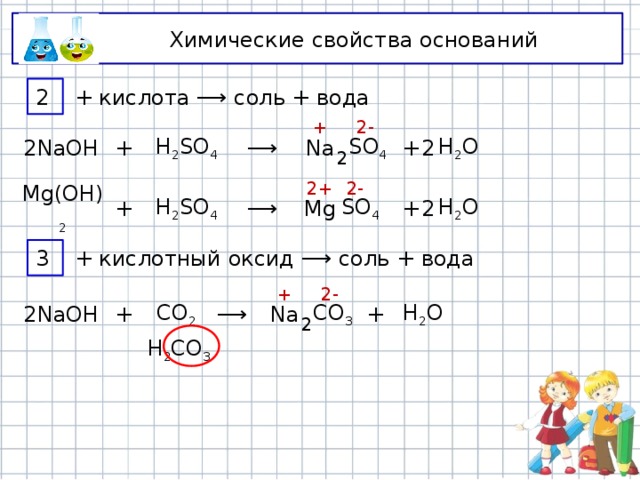
2
+ кислота ⟶ соль + вода
2-
+
H 2 SO 4
2
2
H 2 O
+
NaOH
SO 4
Na
⟶
+
2
2+
2-
2
H 2 O
+
Mg
SO 4
H 2 SO 4
+
Mg(OH) 2
⟶
3
+ кислотный оксид ⟶ соль + вода
+
2-
H 2 O
+
⟶
CO 3
Na
CO 2
+
NaOH
2
2
H 2 CO 3

Химические свойства оснований
4
+ амфотерный оксид ⟶ соль + вода
2-
2+
t
+
ZnO 2
Ba
H 2 O
+
Ba(OH) 2
ZnO
H 2 ZnO 2
Zn(OH) 2
ZnO 2 H 2
ZnO
2+
2-
t
2
ZnO 2
H 2 O
+
Ba
H 2 ZnO 2
Ba(OH) 2
+

Химические свойства оснований
5
щелочь + растворимая соль ⟶ др.основание + др.соль
( )
+
2+
─
─
2
2
Mg
OH
NaOH
Mg(NO 3 ) 2
+
Na
NO 3
+
2
+
2+
2-
─
K
2
OH
+
+
SO 4
Ba
Ba(OH) 2
K 2 SO 4
t
6
нерастворимые основания ⟶ оксид металла + вода
t
Mg(OH) 2
MgO
+
H 2 O
t
Fe(OH) 2
FeO
+
H 2 O
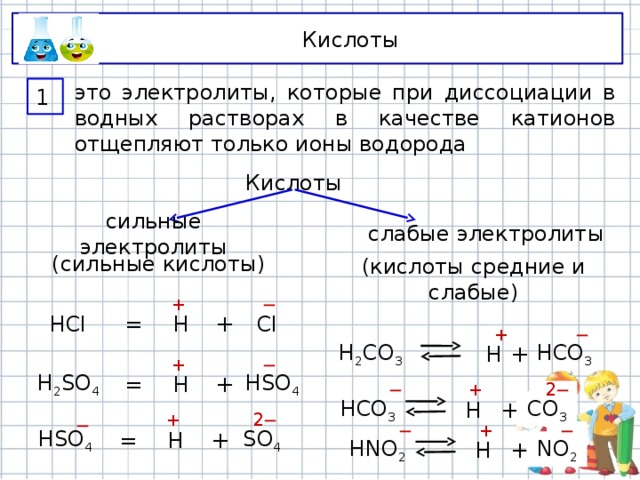
Кислоты
1
это электролиты, которые при диссоциации в водных растворах в качестве катионов отщепляют только ионы водорода
Кислоты
сильные электролиты
слабые электролиты
(сильные кислоты)
(кислоты средние и слабые)
+
─
H
+
Cl
=
HCl
+
─
HCO 3
+
H
H 2 CO 3
+
─
HSO 4
H 2 SO 4
=
H
+
+
─
2─
H
+
CO 3
HCO 3
+
2─
─
+
─
+
─
SO 4
H
=
HSO 4
H
+
NO 2
HNO 2
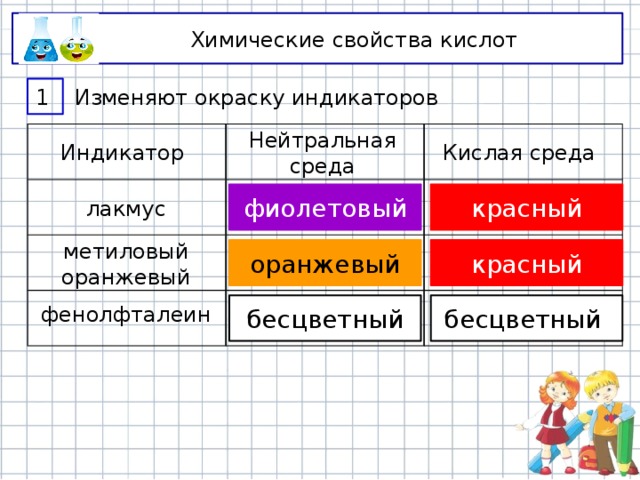
Химические свойства кислот
1
Изменяют окраску индикаторов
Индикатор
Нейтральная среда
Кислая среда
фиолетовый
красный
лакмус
красный
метиловый оранжевый
оранжевый
фенолфталеин
бесцветный
бесцветный
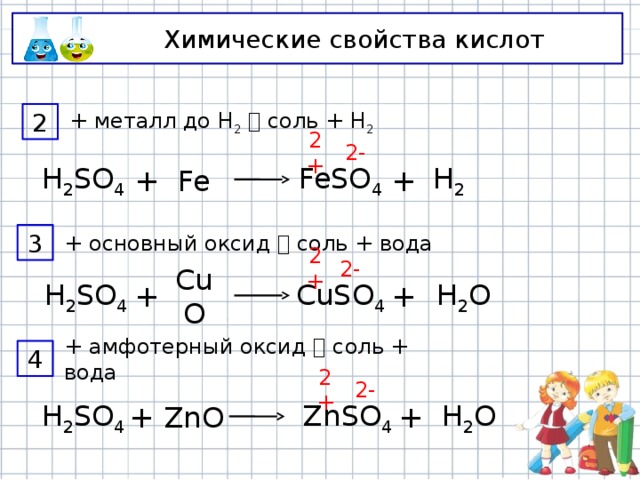
Химические свойства кислот
+ металл до Н 2 соль + Н 2
2
2-
2+
+
H 2
FeSO 4
Fe
+
H 2 SO 4
+ основный оксид соль + вода
3
2-
2+
+
H 2 O
H 2 SO 4
CuSO 4
CuO
+
+ амфотерный оксид соль + вода
4
2+
2-
H 2 SO 4
+
ZnO
ZnSO 4
+
H 2 O
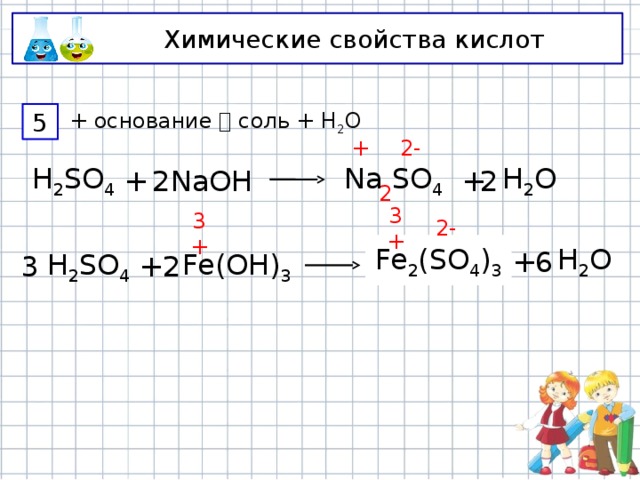
Химические свойства кислот
+ основание соль + Н 2 О
5
2-
+
H 2 O
2
2
+
NaOH
+
H 2 SO 4
Na SO 4
2
2-
3+
3+
H 2 O
+
6
Fe 2 (SO 4 ) 3
Fe SO 4
+
H 2 SO 4
2
3
Fe(OH) 3
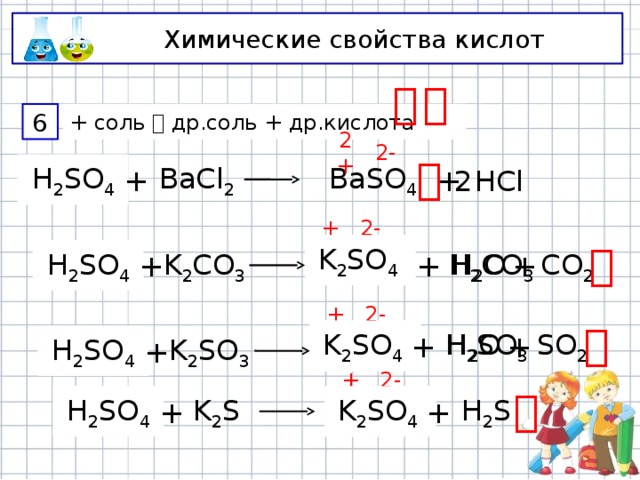
Химические свойства кислот
+ соль др.соль + др.кислота
6
2-
2+
BaSO 4
H 2 SO 4
+
2
+
BaCl 2
HCl
+
2-
K SO 4
K 2 SO 4
H 2 CO 3
CO 2
+
H 2 O
+
+
H 2 SO 4
K 2 CO 3
+
2-
+
SO 2
+
H 2 SO 3
H 2 O
K 2 SO 4
K SO 4
K 2 SO 3
+
H 2 SO 4
2-
+
K 2 S
K SO 4
H 2 SO 4
K 2 SO 4
+
H 2 S
+

Свойства концентрированной серной кислоты
(›70%)
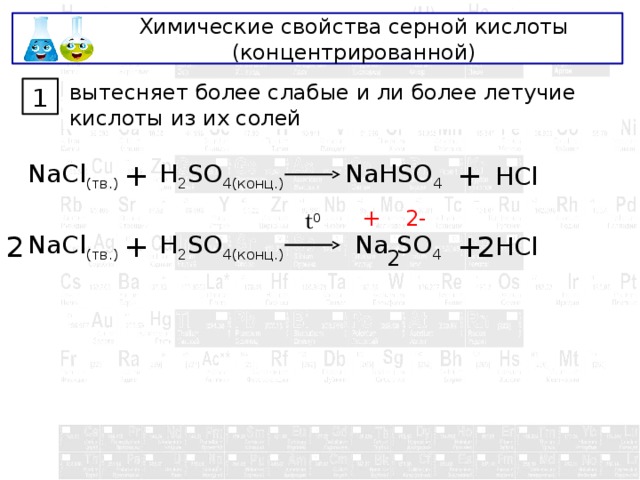
Химические свойства серной кислоты (концентрированной)
вытесняет более слабые и ли более летучие кислоты из их солей
1
HCl
NaCl (тв.)
+
H 2 SO 4(конц.)
NaHSO 4
+
+
t 0
2-
2
HCl
+
NaCl (тв.)
Na SO 4
H 2 SO 4(конц.)
+
2
2
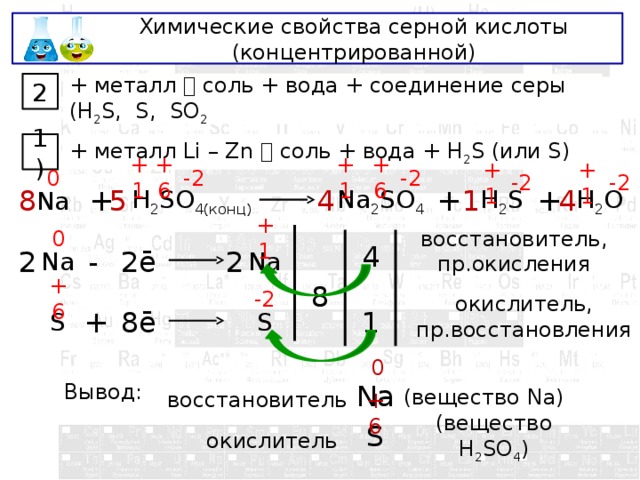
Химические свойства серной кислоты (концентрированной)
2
+ металл соль + вода + соединение серы (H 2 S, S, SO 2
+ металл Li – Zn соль + вода + H 2 S (или S)
1)
+1
+6
+6
-2
-2
0
+1
+1
-2
+1
-2
+
1
Na
+
H 2 SO 4(конц)
4
8
H 2 S
H 2 O
5
4
Na 2 SO 4
+
+1
0
восстановитель, пр.окисления
4
2
2
-
Na
Na
2ē
8
-2
+6
окислитель, пр.восстановления
+
8ē
S
1
S
0
Na
Вывод:
восстановитель
(вещество Na)
+6
S
окислитель
(вещество H 2 SO 4 )

Химические свойства серной кислоты (концентрированной)
+ металл Li – Zn соль + вода + H 2 S (или S)
2)
Al
+
H 2 SO 4(конц)
пассивирует
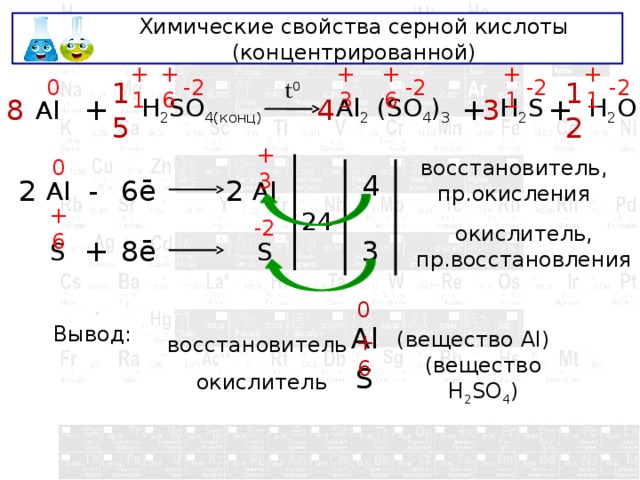
Химические свойства серной кислоты (концентрированной)
+6
-2
+1
-2
+6
+3
+1
-2
+1
t 0
-2
0
+
+
H 2 S
+
Al 2 (SO 4 ) 3
12
15
H 2 O
8
Al
3
4
H 2 SO 4(конц)
+3
0
восстановитель, пр.окисления
4
-
2
2
Al
Al
6ē
24
-2
+6
окислитель, пр.восстановления
+
8ē
S
3
S
0
Al
Вывод:
(вещество Al)
восстановитель
+6
S
окислитель
(вещество H 2 SO 4 )
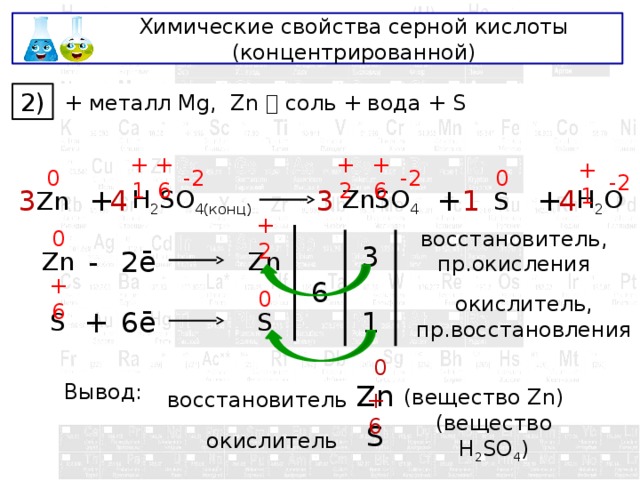
Химические свойства серной кислоты (концентрированной)
+ металл Mg, Zn соль + вода + S
2)
0
+1
-2
+6
+2
-2
+6
0
+1
-2
1
H 2 SO 4(конц)
+
3
+
3
4
4
Zn
H 2 O
ZnSO 4
+
S
+2
0
восстановитель, пр.окисления
3
Zn
Zn
2ē
-
6
0
+6
окислитель, пр.восстановления
S
S
1
6ē
+
0
Zn
Вывод:
восстановитель
(вещество Zn)
+6
S
окислитель
(вещество H 2 SO 4 )

Химические свойства серной кислоты (концентрированной)
+ металл от Fe до Ag соль + вода + SO 2
2)
Fe
+
H 2 SO 4(конц)
пассивирует
+
H 2 SO 4(конц)
Cr
пассивирует
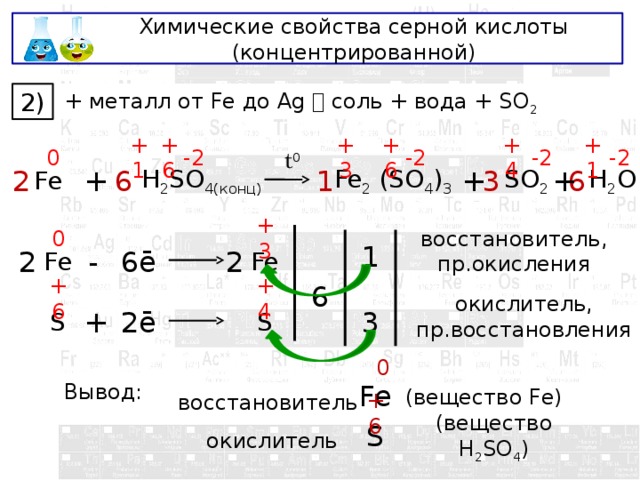
Химические свойства серной кислоты (концентрированной)
2)
+ металл от Fe до Ag соль + вода + SO 2
+6
-2
+1
+4
+6
+3
-2
-2
t 0
+1
-2
0
SO 2
+
Fe
+
H 2 SO 4(конц)
1
3
2
6
+
H 2 O
Fe 2 (SO 4 ) 3
6
+3
0
восстановитель, пр.окисления
1
-
2
6ē
Fe
Fe
2
6
+4
+6
окислитель, пр.восстановления
2ē
S
S
3
+
0
Fe
Вывод:
(вещество Fe)
восстановитель
+6
S
окислитель
(вещество H 2 SO 4 )
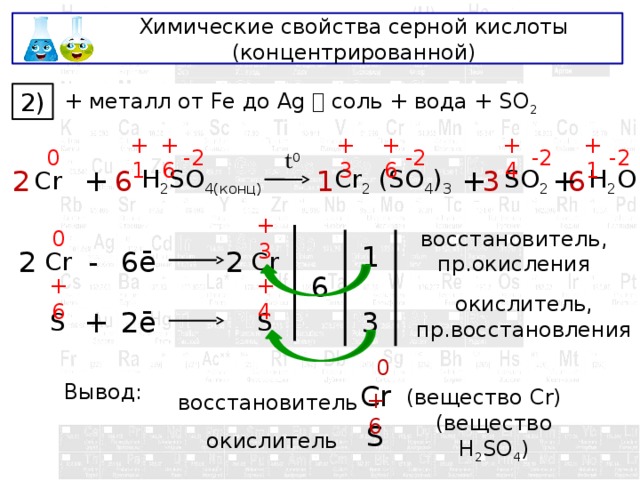
Химические свойства серной кислоты (концентрированной)
2)
+ металл от Fe до Ag соль + вода + SO 2
+6
-2
+1
+4
+6
+3
-2
-2
t 0
+1
-2
0
SO 2
+
Cr
+
H 2 SO 4(конц)
1
3
2
6
+
H 2 O
Cr 2 (SO 4 ) 3
6
+3
0
восстановитель, пр.окисления
1
-
2
6ē
Cr
Cr
2
6
+4
+6
окислитель, пр.восстановления
2ē
S
S
3
+
0
Cr
Вывод:
(вещество Cr)
восстановитель
+6
S
окислитель
(вещество H 2 SO 4 )
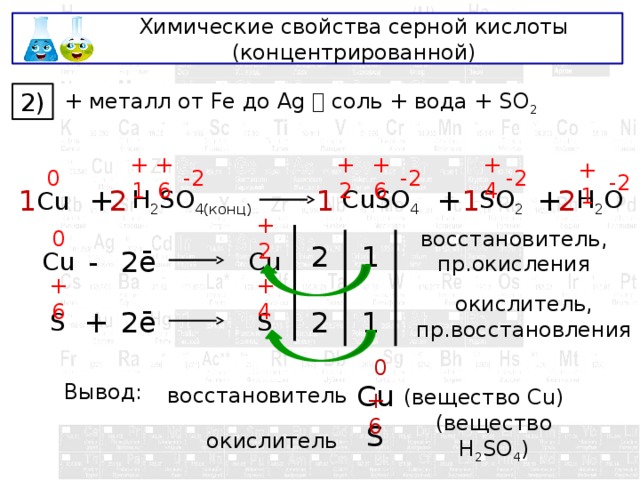
Химические свойства серной кислоты (концентрированной)
+ металл от Fe до Ag соль + вода + SO 2
2)
0
+1
-2
+6
+2
-2
+6
-2
+4
+1
-2
1
H 2 SO 4(конц)
+
1
+
1
2
2
Cu
H 2 O
CuSO 4
+
SO 2
0
+2
восстановитель, пр.окисления
2
1
-
Cu
Cu
2ē
+4
+6
окислитель, пр.восстановления
S
S
1
2
2ē
+
0
Cu
Вывод:
восстановитель
(вещество Cu)
+6
S
окислитель
(вещество H 2 SO 4 )
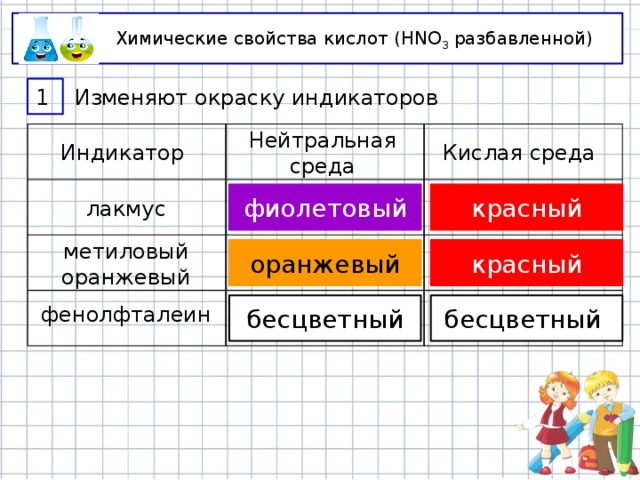
Химические свойства кислот (HNO 3 разбавленной)
1
Изменяют окраску индикаторов
Индикатор
Нейтральная среда
Кислая среда
фиолетовый
красный
лакмус
красный
метиловый оранжевый
оранжевый
фенолфталеин
бесцветный
бесцветный

Химические свойства кислот (HNO 3 разбавленной)
+ металл
2
Реагирует со всеми металлами кроме Au и Pt
1)
Водород (Н 2 ) никогда не выделяется
2)
Химические свойства кислот (HNO 3 разбавленной)
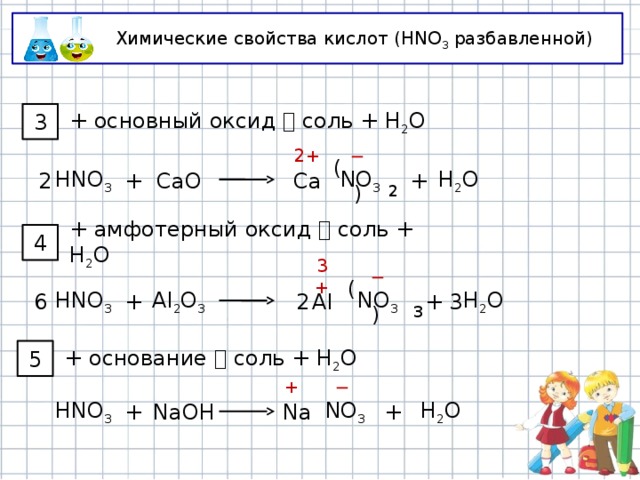
+ основный оксид соль + Н 2 O
3
2 +
─
2
H 2 O
+
( )
NO 3
Ca
CaO
+
HNO 3
2
+ амфотерный оксид соль + Н 2 O
4
─
3+
3
6
2
H 2 O
+
Al 2 O 3
( )
NO 3
Al
+
HNO 3
3
+ основание соль + Н 2 O
5
─
+
NO 3
+
H 2 O
Na
NaOH
+
HNO 3
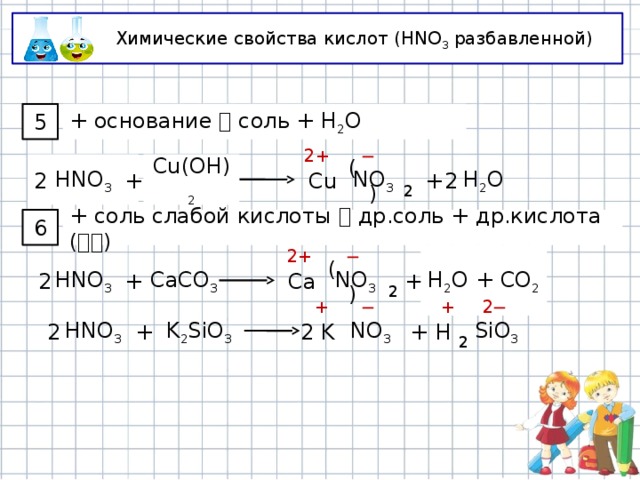
Химические свойства кислот (HNO 3 разбавленной)
+ основание соль + Н 2 O
5
─
2+
+
Cu(OH) 2
2
2
H 2 O
+
( )
HNO 3
NO 3
Cu
2
+ соль слабой кислоты др.соль + др.кислота ( )
6
2 ─
+
─
2 +
H 2 O + CO 2
Ca
2
СaCO 3
+
( )
+
H
CO 3
HNO 3
NO 3
2
2
─
2 ─
+
+
2
SiO 3
H
HNO 3
+
NO 3
K
K 2 SiO 3
+
2
2

4. Химические свойства HNO 3 (концентр.)
+ металл
1
Реагирует со всеми металлами кроме Au и Pt
1)
Водород (Н 2 ) никогда не выделяется
2)
HNO 3 (конц) + металл до Al соль + вода + N 2 O (NO)
1
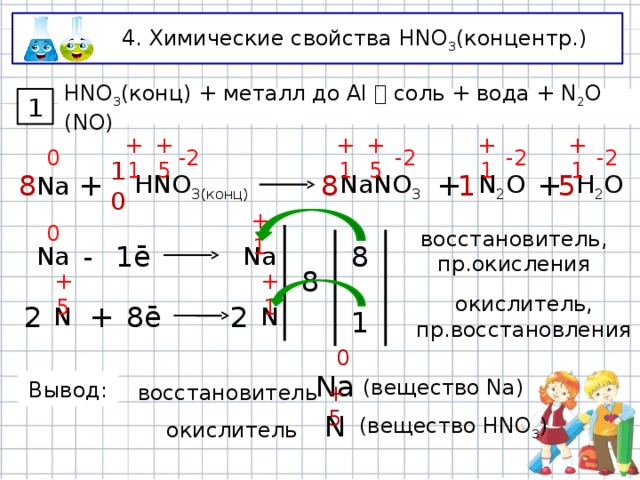
4. Химические свойства HNO 3 (концентр.)
HNO 3 (конц) + металл до Al соль + вода + N 2 O (NO)
1
+1
-2
+1
-2
+5
-2
+1
+5
-2
+1
0
8
Na
+
HNO 3(конц)
8
1
10
5
NaNO 3
+
H 2 O
+
N 2 O
+1
0
восстановитель, пр.окисления
8
-
1ē
Na
Na
8
+1
+5
N
окислитель, пр.восстановления
8ē
+
2
2
N
1
0
Na
Вывод:
(вещество Na)
восстановитель
+5
N
окислитель
(вещество HNO 3 )
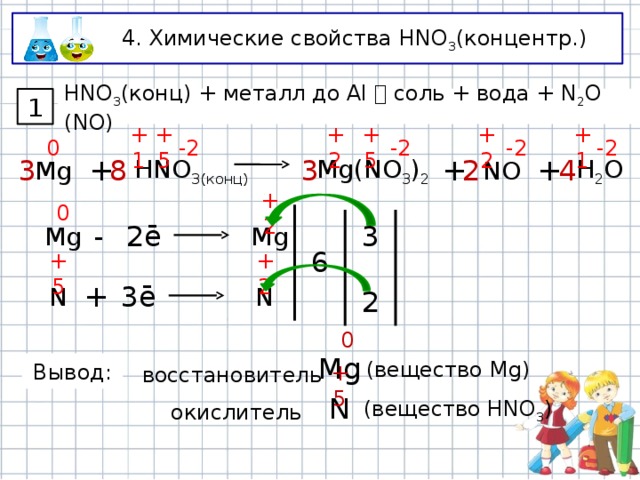
4. Химические свойства HNO 3 (концентр.)
1
HNO 3 (конц) + металл до Al соль + вода + N 2 O (NO)
+5
-2
+1
+2
-2
-2
+5
-2
+1
+2
0
H 2 O
Mg
NO
+
Mg(NO 3 ) 2
4
8
3
+
2
HNO 3(конц)
3
+
+2
0
3
-
2ē
Mg
Mg
6
+2
+5
3ē
N
N
+
2
0
Mg
Вывод:
(вещество Mg)
восстановитель
+5
N
окислитель
(вещество HNO 3 )

4. Химические свойства HNO 3 (концентр.)
HNO 3 (конц) + металл от Al соль + вода + NO 2
2
Al
+
HNO 3(конц)
пассивирует
пассивирует
Cr
+
HNO 3(конц)
Fe
+
HNO 3(конц)
пассивирует
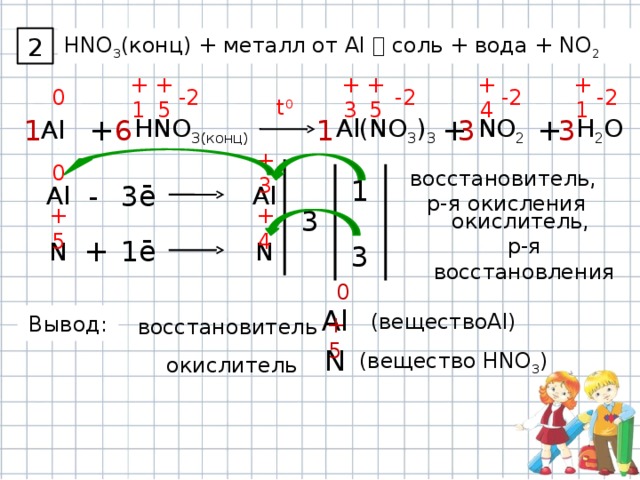
2
HNO 3 (конц) + металл от Al соль + вода + NO 2
-2
+5
+1
+4
-2
-2
+3
+5
-2
+1
0
t 0
NO 2
Al
1
3
6
3
+
1
+
HNO 3(конц)
H 2 O
+
Al(NO 3 ) 3
+3
0
1
восстановитель,
р-я окисления
3ē
-
Al
Al
3
+4
+5
окислитель,
р-я восстановления
N
1ē
+
N
3
0
Al
Вывод:
(веществоAl)
восстановитель
+5
N
окислитель
(вещество HNO 3 )
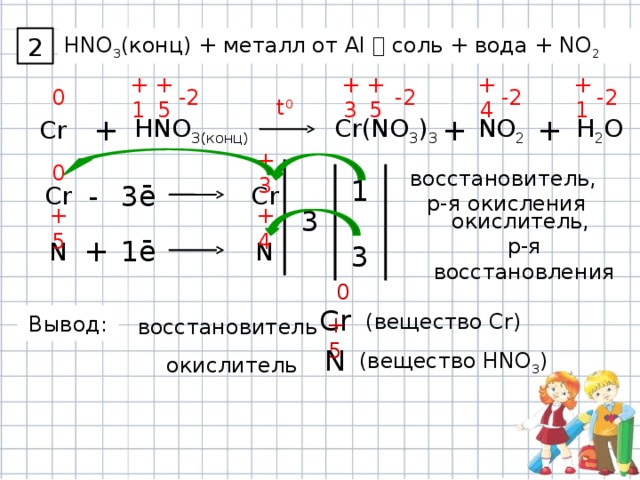
HNO 3 (конц) + металл от Al соль + вода + NO 2
2
-2
+3
-2
+1
+4
+5
-2
+5
-2
+1
0
t 0
Cr(NO 3 ) 3
+
NO 2
+
+
H 2 O
HNO 3(конц)
Cr
0
+3
восстановитель,
1
р-я окисления
3ē
Cr
Cr
-
3
+4
+5
окислитель,
р-я восстановления
1ē
+
N
N
3
0
Cr
Вывод:
(вещество Cr)
восстановитель
+5
N
окислитель
(вещество HNO 3 )
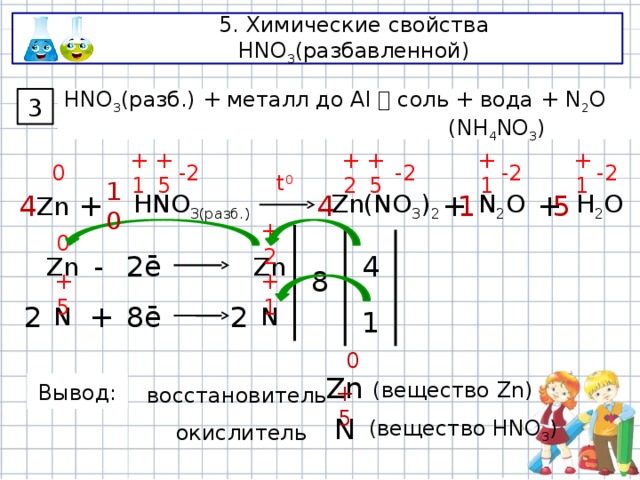
5. Химические свойства HNO 3 (разбавленной)
3
HNO 3 (разб.) + металл до Al соль + вода + N 2 O (NH 4 NO 3 )
+2
-2
+1
+1
+5
-2
+5
-2
-2
0
+1
t 0
H 2 O
+
N 2 O
+
5
10
Zn
4
1
+
Zn(NO 3 ) 2
4
HNO 3(разб.)
+2
0
4
2ē
Zn
Zn
-
8
+1
+5
N
+
8ē
N
2
2
1
0
Zn
Вывод:
(вещество Zn)
восстановитель
+5
N
окислитель
(вещество HNO 3 )
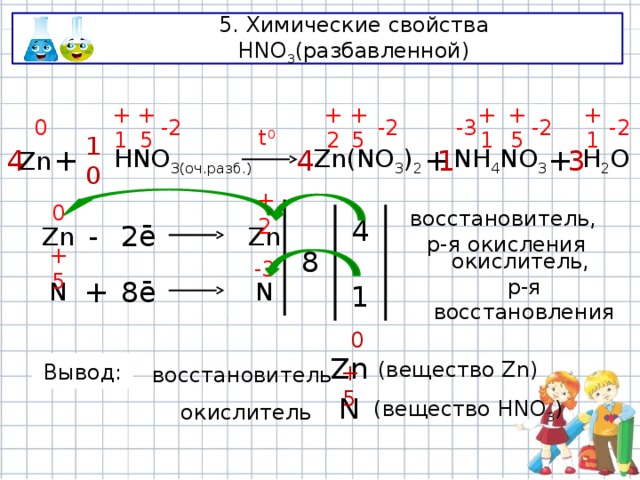
5. Химические свойства HNO 3 (разбавленной)
-2
-2
+1
+5
-3
+1
+5
-2
+2
-2
+1
0
+5
t 0
1
Zn
HNO 3(оч.разб.)
Zn(NO 3 ) 2
+
4
NH 4 NO 3
4
10
3
+
H 2 O
+
+2
0
восстановитель,
4
р-я окисления
2ē
Zn
-
Zn
8
-3
+5
окислитель,
р-я восстановления
+
8ē
N
N
1
0
Zn
Вывод:
(вещество Zn)
восстановитель
+5
N
окислитель
(вещество HNO 3 )
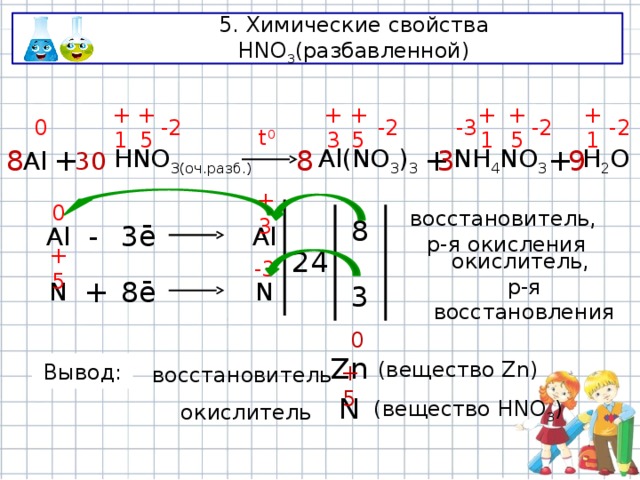
5. Химические свойства HNO 3 (разбавленной)
-2
-2
+1
+5
-3
+1
+5
-2
+3
-2
+1
0
+5
t 0
3
Al
HNO 3(оч.разб.)
Al(NO 3 ) 3
+
8
NH 4 NO 3
8
30
9
+
H 2 O
+
+3
0
восстановитель,
8
р-я окисления
3ē
Al
-
Al
24
-3
+5
окислитель,
р-я восстановления
+
8ē
N
N
3
0
Zn
Вывод:
(вещество Zn)
восстановитель
+5
N
окислитель
(вещество HNO 3 )

7. Некоторые кислоты при нагревании разлагаются
t 0
H 2 SiO 3
SiO 2
+
H 2 O
t 0
H 2
+
S
H 2 S
t 0
NO 2
+
O 2
+
H 2 O
4
2
HNO 3(конц)
4

Химические свойства кислот
вытесняет более слабые или более летучие кислоты из их солей
8
+
HCl
NaHSO 4
H 2 SO 4(конц.)
+
NaCl (тв.)
2-
t 0
+
2
2
HCl
+
NaCl (тв.)
Na SO 4
H 2 SO 4(конц.)
+
2
Подобные реакции в водной среде не протекают
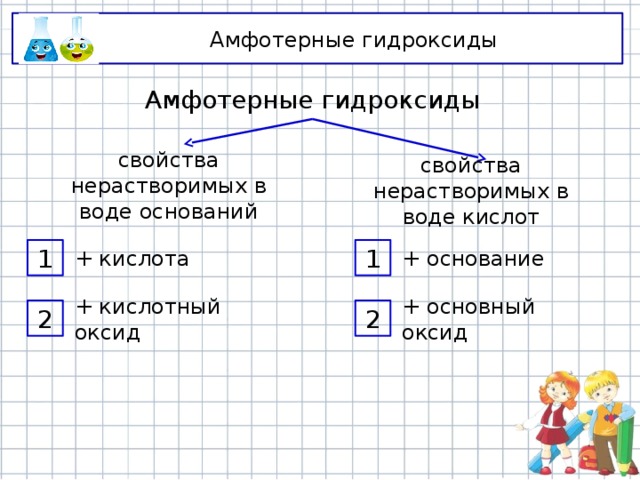
Амфотерные гидроксиды
Амфотерные гидроксиды
свойства нерастворимых в воде оснований
свойства нерастворимых в воде кислот
+ кислота
1
+ основание
1
+ кислотный оксид
2
+ основный оксид
2
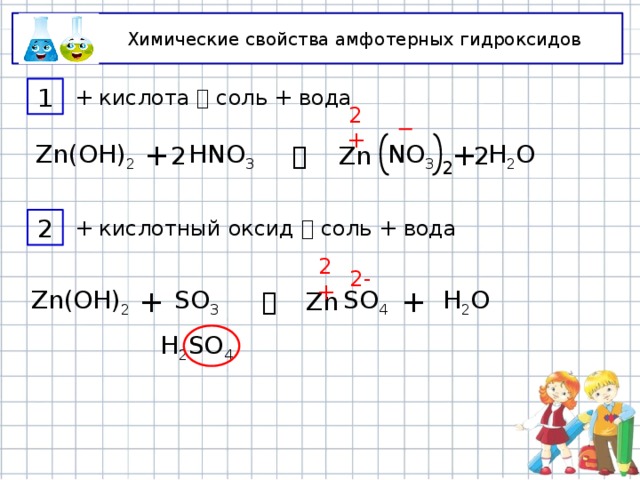
Химические свойства амфотерных гидроксидов
+ кислота соль + вода
1
─
2+
2
2
H 2 O
+
NO 3
HNO 3
+
Zn(OH) 2
Zn
2
+ кислотный оксид соль + вода
2
2-
2+
Zn
+
SO 4
+
SO 3
Zn(OH) 2
H 2 O
H 2 SO 4

Химические свойства амфотерных гидроксидов
+ щелочь соль + вода (сплавление)
3
+
2-
t 0
ZnO 2
+
H 2 O
2
2
Na
NaOH
+
Zn(OH) 2
2
H 2 ZnO 2
ZnO 2 H 2
Zn(OH) 2
t 0
+
2-
2
2
H 2 O
+
Na
NaOH
+
H 2 ZnO 2
ZnO 2
2

Химические свойства амфотерных гидроксидов
+ основный оксид соль + вода (сплавление)
4
+
2-
t 0
ZnO 2
+
H 2 O
Na
Na 2 O
+
Zn(OH) 2
2
H 2 ZnO 2
Zn(OH) 2
ZnO 2 H 2
t 0
+
2-
H 2 O
+
ZnO 2
Na
Na 2 O
+
H 2 ZnO 2
2
![Химические свойства амфотерных гидроксидов + щелочь комплексная соль (в растворе) 5 Na 2 [Zn(OH) 4 ] 2 NaOH + Zn(OH) 2 тетра гидроксо цинкат тетра гидроксо цинкат натрия](https://fsd.multiurok.ru/html/2019/07/09/s_5d2432cd605bd/img41.jpg)
Химические свойства амфотерных гидроксидов
+ щелочь комплексная соль (в растворе)
5
Na 2 [Zn(OH) 4 ]
2
NaOH
+
Zn(OH) 2
тетра
гидроксо
цинкат
тетра
гидроксо
цинкат
натрия

Химические свойства амфотерных гидроксидов
2
2
+
Zn(OH) 2
HCl (нед)
+
Na 2 ZnO 2
NaCl
OH
ZnCl 2
4
2
H 2 O
+
HCl (изб)
+
NaCl
+
Na 2 ZnO 2
2
![Химические свойства амфотерных гидроксидов Zn(OH) 2 2 2 H 2 O + 2 + HCl (нед) + Na 2 [Zn(OH) 4 ] NaCl ZnCl 2 4 2 H 2 O + + NaCl HCl (изб) + Na 2 [Zn(OH) 4 ] 4](https://fsd.multiurok.ru/html/2019/07/09/s_5d2432cd605bd/img43.jpg)
Химические свойства амфотерных гидроксидов
Zn(OH) 2
2
2
H 2 O
+
2
+
HCl (нед)
+
Na 2 [Zn(OH) 4 ]
NaCl
ZnCl 2
4
2
H 2 O
+
+
NaCl
HCl (изб)
+
Na 2 [Zn(OH) 4 ]
4

Химические свойства амфотерных гидроксидов
6
амфотерные гидроксиды ⟶ оксид металла + вода
t
3
2
H 2 O
+
Fe 2 O 3
Fe(OH) 3
t
Zn(OH) 2
ZnO
+
H 2 O

Домашнее задание
§ 22
















































![Химические свойства амфотерных гидроксидов + щелочь комплексная соль (в растворе) 5 Na 2 [Zn(OH) 4 ] 2 NaOH + Zn(OH) 2 тетра гидроксо цинкат тетра гидроксо цинкат натрия](https://fsd.multiurok.ru/html/2019/07/09/s_5d2432cd605bd/img41.jpg)

![Химические свойства амфотерных гидроксидов Zn(OH) 2 2 2 H 2 O + 2 + HCl (нед) + Na 2 [Zn(OH) 4 ] NaCl ZnCl 2 4 2 H 2 O + + NaCl HCl (изб) + Na 2 [Zn(OH) 4 ] 4](https://fsd.multiurok.ru/html/2019/07/09/s_5d2432cd605bd/img43.jpg)




















