
Основные классы неорганических соединений.
Преподаватель ГБПОУ ВО ВАТ имени В.П.Чкалова
Кузнецова Е.В.

ЦЕЛИ И ЗАДАЧИ ЗАНЯТИЯ:
Обучающая: Повторить, обобщить и углубить знания и умения студентов о классификации неорганических веществ, о химических свойствах, получении, номенклатуре оксидов, кислот, оснований и солей.
Развивающая:
- развивать умения анализировать и делать выводы;
- способствовать пробуждению интереса к изучаемой дисциплине;
- находить главную мысль в тексте;
- аргументировать свои ответы .
Воспитывающая :
- формирование научно-материалистического мировоззрения;
- воспитание трудолюбия, усидчивости, умения вести диалог.
20.10.22
Кузнецова Екатерина Владимировна

План
- Классификация сложных неорганических веществ.
- Оксиды: состав, названия, классификация, свойства.
- Кислоты: состав, названия, классификация, свойства.
- Основания: состав, названия, классификация, свойства.
- Соли: состав, названия, классификация, свойства.
- Генетическая связь между классами неорганических веществ.
20.10.22
Кузнецова Екатерина Владимировна
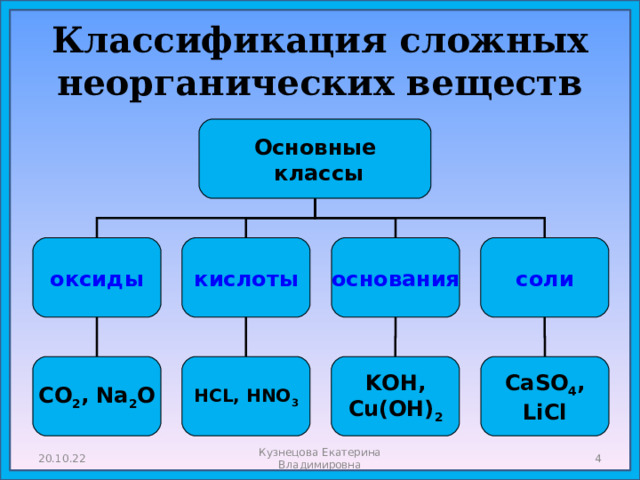
Классификация сложных неорганических веществ
Основные
классы
оксиды
кислоты
соли
основания
HCL, HNO 3
СО 2 , Na 2 O
KOH,
Cu(OH) 2
CaSO 4 ,
LiCl
20.10.22
Кузнецова Екатерина Владимировна

Оксиды: состав, названия, классификация, свойства.
- Оксиды - сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2 .
20.10.22
Кузнецова Екатерина Владимировна

Номенклатура
Формула
Название
CO
оксид углерода ( II )
NO
Формула
N 2 O 5
оксид азота ( II )
Fe 2 O 3
Название
оксид железа (III )
оксид азота (V )
CrO 3
оксид хрома (VI )
Mn 2 O 7
оксид марганца (VII )
20.10.22
Кузнецова Екатерина Владимировна
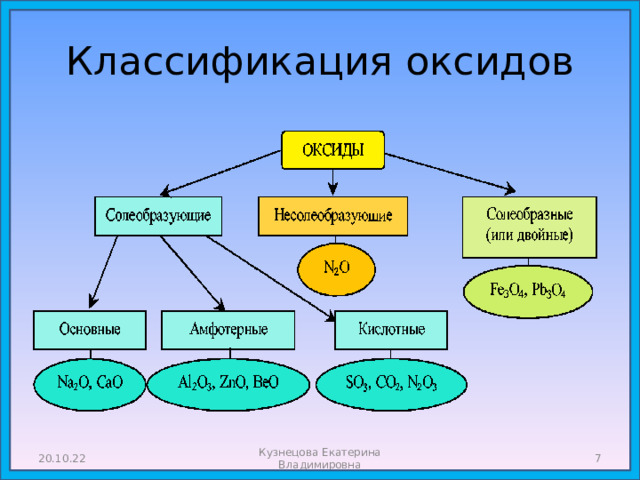
Классификация оксидов
20.10.22
Кузнецова Екатерина Владимировна
![Химические свойства оксидов О сновные - реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1 .Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H 2 O=Ca(OH) 2 2 .Все - с кислотами МgO+2HCl=MgCl 2 +H 2 O 3.С кислотными оксидами CaO+CO 2 =CaCO 3 4.С амфотерными оксидами Li 2 O+Al 2 O 3 =2LiAlO 2 Амфотерные (ZnO, Al 2 O 3 ,Cr 2 O 3 , MnO 2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl 2 +H 2 O ZnO+2NaOH+H 2 O=Na 2 [Zn(OH) 4 ] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO 2 ZnO+SiO 2 =ZnSiO 3 Кислотные -реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO 3 +H 2 O=H 2 SO 4 2.Со щелочами NaOH+SiO 2 =Na 2 SiO 3 +H 2 O 3.С основными оксидами SiO 2 +CaO=CaSiO 3 4.С амфотерными оксидами Al 2 O 3 +3SO3=Al 2 (SO 4 ) 3 20.10.22 Кузнецова Екатерина Владимировна](https://fsd.multiurok.ru/html/2022/10/20/s_6350fcfb767d8/img7.jpg)
Химические свойства оксидов
О сновные - реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1 .Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H 2 O=Ca(OH) 2 2 .Все - с кислотами МgO+2HCl=MgCl 2 +H 2 O 3.С кислотными оксидами CaO+CO 2 =CaCO 3 4.С амфотерными оксидами Li 2 O+Al 2 O 3 =2LiAlO 2
Амфотерные (ZnO, Al 2 O 3 ,Cr 2 O 3 , MnO 2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl 2 +H 2 O
ZnO+2NaOH+H 2 O=Na 2 [Zn(OH) 4 ] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO 2 ZnO+SiO 2 =ZnSiO 3
Кислотные -реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO 3 +H 2 O=H 2 SO 4 2.Со щелочами NaOH+SiO 2 =Na 2 SiO 3 +H 2 O 3.С основными оксидами SiO 2 +CaO=CaSiO 3 4.С амфотерными оксидами Al 2 O 3 +3SO3=Al 2 (SO 4 ) 3
20.10.22
Кузнецова Екатерина Владимировна

ПОЛУЧЕНИЕ ОКСИДОВ.
Окисление кислородом
простых веществ
Разложение
2Mg +O 2 =2MgO
сложных веществ
2H 2 S+3O 2 =2H 2 O+2SO 2
нагреванием солей
СaCO 3 =CaO+CO 2
нагреванием оснований
Cu (OH) 2 =CuO+H 2 0
нагреванием кислородсодержащих кислот
нагреванием высших оксидов
Окисление низших оксидов
H 2 SO 3 =H 2 O+SO 2
4CrO 3 =Cr 2 O 3 +3O 2
4FeO+O 2 =2Fe 2 O 3
Вытеснение летучего оксида менее летучим
Na 2 CO 3 +SiO 2 =Na 2 SiO 3 +CO 2
20.10.22
Кузнецова Екатерина Владимировна

Кислоты
- Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных заместиться на атом металла, и кислотного остатка.
- Число атомов водорода определяет основность кислот.
20.10.22
Кузнецова Екатерина Владимировна

Классификация по наличию кислорода в кислотном остатке
Бескислородные
Кислородсодержащие
HCl, HBr, HI, H 2 S
анион «-ид» HCl-хлороводородная
(соляная кислота),
Cl - - хлорид H 2 S-сероводородная,
S 2- - сульфид
H 2 SO 4 , HNO 3 , H 2 CO 3 , H 3 PO 4 и другие .
20.10.22
Кузнецова Екатерина Владимировна

КЛАССИФИКАЦИЯ КИСЛОТ ПО КОЛИЧЕСТВУ АТОМОВ ВОДОРОДА В МОЛЕКУЛЕ
КИСЛОТЫ
ОДНООСНОВНЫЕ ТРЕХОСНОВНЫЕ
ДВУХОСНОВНЫЕ H 3 PO 4
HCl, HNO 3
H 2 SO 4 , H 2 CO 3
20.10.22
Кузнецова Екатерина Владимировна
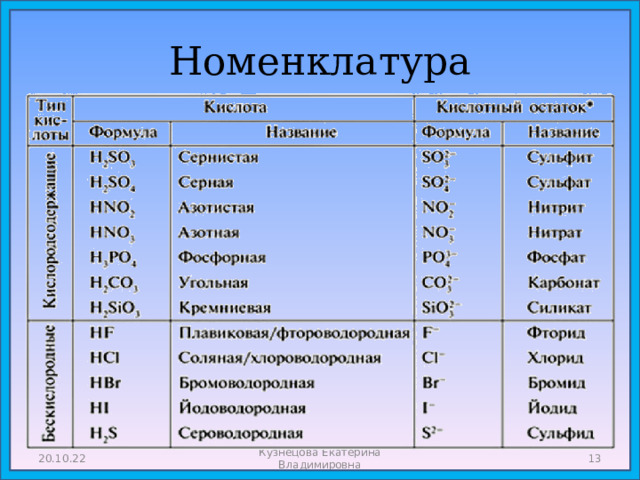
Номенклатура
20.10.22
Кузнецова Екатерина Владимировна

ПОЛУЧЕНИЕ
Кислородсодержащие
1.Кислотный оксид+вода
2.Металл+сильный окислитель
SO 3 +H 2 O=H 2 SO 4 P 2 O 5 +3H 2 O=2H 3 PO 4
3.Cоль+менее летучая кислота
P+5HNO 3 +2H 2 O=3H 3 PO 4 +5NO
Бескислородные
NaNO 3 +H 2 SO 4 =HNO 3 +NaHSO 4
1.Водород+неметалл
2.Cоль+менее летучая кислота
H 2 +Cl 2 =2HCl
NaCl+H 2 SO 4 =2HCl +NaHSO 4
20.10.22
Кузнецова Екатерина Владимировна

Физические свойства кислот
Кислоты
Жидкости H 2 SO 4 HClO 4 и др.
Твердые H 3 PO 4 H 2 SiO 3 и др.
Газообразные HCl H 2 S и др.
20.10.22
Кузнецова Екатерина Владимировна

Химические свойства
1.Изменяют окраску индикаторов
2.Взаимодействие с металлами, стоящими до водорода
H 2 SO 4 +Ca=CaSO 4 +H 2
2HCl+Ca=CaCl 2 +H 2
3.Взаимодействие с основными оксидами
H 2 SO 4 +CaO=CaSO 4 +H 2 O
2HCl+CaO=CaCl 2 +H 2 O
4.Взаимодействие с основаниями
H 2 SO 4 +Ca(OH) 2 =CaSO 4 +2H 2 O
2HCl+Ca(OH) 2 =CaCl 2 +2H 2 O
Кузнецова Екатерина Владимировна
20.10.22

Химические свойства
5.Взаимодействие с амфотерными оксидами
H 2 SO 4 +ZnO=ZnSO 4 +H 2 O
2HCl+ZnO=ZnCl 2 +H 2 O
6.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество
H 2 SO 4 +BaCl 2 =BaSO 4 +2HCl
2HCl+Na 2 CO 3 =2NaCl+H 2 O+CO 2
7.При нагревании
Слабые кислоты легко разлагаются H 2 SiO 3 =H 2 O+SiO 2
H 2 S=H 2 +S
20.10.22
Кузнецова Екатерина Владимировна

Основания
- Основания - сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами - ОН.
- Общая формула: Ме(ОН) х
20.10.22
Кузнецова Екатерина Владимировна

Физические свойства
- Физические свойства: твердые кристаллические вещества.
- В воде растворимые называются - щелочи: LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH) 2 , Sr(OH) 2 ,Ba(OH) 2 ,
- Другие - малорастворимы.
20.10.22
Кузнецова Екатерина владимировна

ПОЛУЧЕНИЕ
Щелочи
1.Металл+вода
2.Оксид+вода
2Na+H 2 O=2NaOH+H 2 Ba+2H 2 O=Ba(OH) 2 +H 2
3.Электролиз растворов
солей щелочных металлов
Li 2 O+H 2 O=2LiOH CaO+H 2 O=Ca(OH) 2
Нерастворимые основания
2NaCl+2H 2 O=2NaOH+Cl 2 +H 2
Соль+щелочь
CuSO 4 +2NaOH=Cu(OH) 2 +Na 2 SO 4
20.10.22
Кузнецова Екатерина владимировна

Действие индикаторов
20.10.22
Кузнецова Екатерина Владимировна

Химические свойства
1.Взаимодействие с кислотами
KOH+HCl=KCl+H 2 O
Cu(OH) 2 +2HCl=CuCl 2 +2H 2 O
2.Взаимодействие с кислотными оксидами
2KOH+CO 2 =K 2 CO 3 +H 2 O
не характерны
3.Взаимодействие с амфотерными оксидами
2KOH+ZnO=K 2 ZnO 2 +H 2 O
не реагируют
4.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание
20.10.22
Кузнецова Екатерина владимировна

Соли
- Соли - сложные вещества, состоящие из атома металла и кислотного остатка (иногда содержат водород).
- Общяя формула : МехАсу
20.10.22
Кузнецова Екатерина владимировна
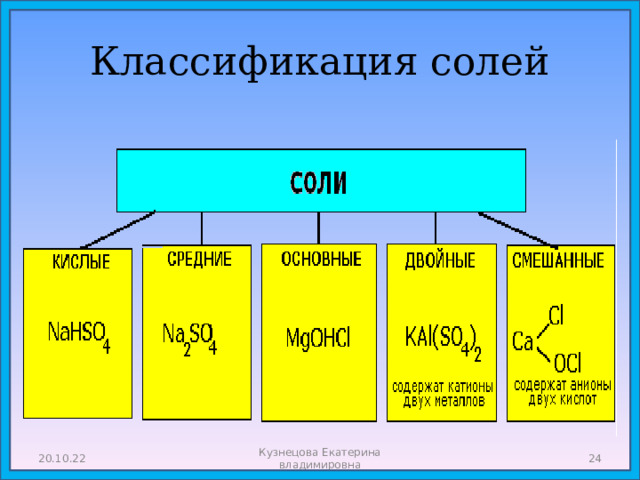
Классификация солей
20.10.22
Кузнецова Екатерина владимировна
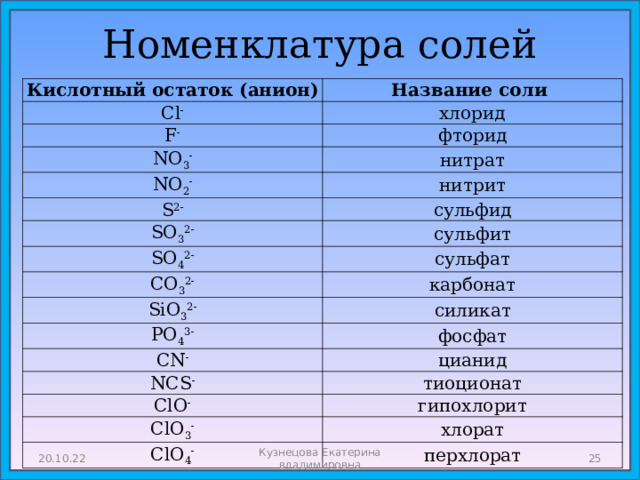
Номенклатура солей
Кислотный остаток (анион)
Cl -
Название соли
F -
хлорид
фторид
NO 3 -
нитрат
NO 2 -
S 2-
нитрит
сульфид
SO 3 2-
сульфит
SO 4 2-
сульфат
CO 3 2-
SiO 3 2-
карбонат
PO 4 3-
силикат
CN -
фосфат
цианид
NCS -
тиоционат
ClO -
ClO 3 -
гипохлорит
хлорат
ClO 4 -
перхлорат
20.10.22
Кузнецова Екатерина владимировна

ПОЛУЧЕНИЕ
1.С использованием металлов
металл+неметалл
2Mg+Cl 2 =MgCl 2
металл+кислота
Zn+2HCl=ZnCI 2 +H 2
металл+соль
2.С использованием оксидов
основной оксид+кислота
Fe+CuSO 4 =FeSO 4 +Cu
кислотный оксид+основание
CaO+2HCl=CaCl 2 +H 2 O
кислотный+основной оксиды
CO 2 +Ca(OH) 2 =CaCO 3 +H2O
CaO+CO 2 =CaCO 3
основной+амфотерный оксиды
Al 2 O 3 +CaO=Ca(AlO 2 ) 2
20.10.22
Кузнецова Екатерина владимировна

ПОЛУЧЕНИЕ
3.Реакция нейтрализации
кислота+основание
4.Из солей
H 2 SO 4 +2NaOH=Na 2 SO 4 +2H 2 O
соль+соль
соль+щелочь
AgNO 3 +NaCl=AgCl +NaNO 3
Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты)
соль+кислота
CuSO 4 +2NaOH=Cu(OH) 2 +Na 2 SO 4
NaOH+H 2 SO 4 =NaHSO 4 +H 2 O
Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2
Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи)
ZnCl 2 +NaOH=ZnOHCl +NaCl
20.10.22
Кузнецова Екатерина владимировна

ФИЗИЧЕСКИЕ СВОЙСТВА
- Соли - твердые кристаллические вещества. Многие вещества имеют высокие температуры плавления и кипения. По растворимости делятся на растворимые и нерастворимые.
20.10.22
Кузнецова Екатерина владимировна

ХИМИЧЕСКИЕ СВОЙСТВА
Разложение при прокаливании
CaCO 3 =CaO+CO 2
Cоль+металл
Fe+CuSO 4 =FeSO 4 +Cu
Соль+соль
AgNO 3 +NaCl=AgCl +NaNO 3
Соль+щелочь
CuSO 4 +2NaOH=Cu(OH) 2 +Na 2 SO 4
Соль+кислота
Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2
20.10.22
Кузнецова Екатерина владимировна

Генетическая связь между классами неорганических веществ
Между оксидами, кислотами, основаниями и солями имеется глубокая связь. Зная свойства веществ, можно легко перейти от одного класса соединений к другому.
- Генетическим называется ряд веществ – представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ или их генезис.
- Например :
- Ca → CaO → Ca(OH) 2 → CaSO 4 .
20.10.22
Кузнецова Екатерина владимировна

Обобщение и систематизация знаний
Выберите из указанных формул соединений:
Ba (OH) 2 ; H 2 S; Fe (NO 3 ) 3 ; H 2 O; S; H 2 SiO 3 ; H 3 PO 4 ; Na 2 SO 4 ; AI(OH) 3 ; Cl 2 ; CuCl 2 ; AgNO 3 ; SO 3 ; KOH; P 2 O 5 ; HCl; CO 2 ; K 2 S; Fe (OH) 3 , NaOH, HNO 3 .
Назовите вещества.
1 вариант
формулы оснований
2 вариант
3 вариант
формулы солей
формулы кислот
20.10.22
Кузнецова Екатерина владимировна

Обобщение и систематизация знаний
1 вариант
2 вариант
формулы оснований
3 вариант
формулы солей
Ba (OH) 2 – гидроксид бария , AI(OH) 3 – гидроксид алюминия ,
KOH – гидроксид калия ;
Fe (OH) 3 – гидроксид железа (III), NaOH – гидроксид натрия
Fe (NO 3 ) 3 – нитрат железа (III);
Na 2 SO 4 – сульфат натрия;
CuCl 2 – хлорид меди (II);
AgNO 3 – нитрат серебра ;
K 2 S – сульфид калия
формулы кислот
H 2 S – сероводородная кислота;
H 2 SiO 3 – кремниевая кислота;
H 3 PO 4 – ортофосфорная кислота;
HCl – соляная кислота; HNO 3 – азотная кислота.
20.10.22
Кузнецова Екатерина владимировна

Обобщение и систематизация знаний
- Напишите уравнения реакций нейтрализации, в результате которых образуются соли:
- а) AlCl 3 ;
- б) BaSO 4 .
- Al(OH )3 + 3HCl = AlCl 3 +3H 2 O
Ba(OH) 2 + H 2 SO 4 = BaSO 4 +2H 2 O
20.10.22
Кузнецова Екатерина владимировна

Обобщение и систематизация знаний
Допишите уравнения тех реакций, которые идут до конца:
- а ) NaOH + HCl→
- б ) CuCl 2 + 2KOH→
- в) NaOH + CaO→
- г) Сu + HCl →
NaCl + H 2 O
Cu(OH) 2 + 2KCl
20.10.22
Кузнецова Екатерина владимировна

Домашнее задание
Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений. – П. 12, В. 1-4,9-12,14, У. 3,6-8,13
20.10.22
Кузнецова Екатерина владимировна

Источники.
- http://selfhacker.net/wp-content/uploads/2015/01/khimiya.jpg
- http://vneshkoly.com.ua/images/download/Shpargalki-zno/Khimiya/consp-8-2.PNG
- http://mplast.by/wp-content/uploads/2015/06/klassifikatsiya-oksidov.png
- http://www.mitht.rssi.ru/2008/equipment/mediana_ch_2/images/2-31.jpg
- http://www.xn--80ajjl0ack.xn--j1amh/sites/default/files/images/product/_1%20%281%29_6.jpg?1423144253
- http://weirdasia.ru/wpcontent/uploads/2015/12/%
- http://www.ybereg.com/images/RUSSIA/kamchatka/mutnovsky.jpg
- http://gost.jofo.ru/data/userfiles/4988/images/511293-9226691e7f69f97ba64fecbbe1420c60.jpg
- http://img.opt-union.ru/alias/images/photocat/446x/1000873055.jpg
- http://uslide.ru/images/3/9885/389/img3.jpg
- http://bonanzleimages.s3.amazonaws.com/afu/images/2827/1467/il_fullxfull.464403258_p4uj_thumb155_crop.jpg
- http://gallery.magic-chat.ru/m-gallery/minerals/unsort/c096c1e2-d8e7-43e6-9e5a-b3dbc148fdb0.jpeghttp://cs629108.vk.me/v629108754/9b20/sDtFfu_SjN4.jpg
20.10.22
Кузнецова Екатерина Владимировна














![Химические свойства оксидов О сновные - реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1 .Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H 2 O=Ca(OH) 2 2 .Все - с кислотами МgO+2HCl=MgCl 2 +H 2 O 3.С кислотными оксидами CaO+CO 2 =CaCO 3 4.С амфотерными оксидами Li 2 O+Al 2 O 3 =2LiAlO 2 Амфотерные (ZnO, Al 2 O 3 ,Cr 2 O 3 , MnO 2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl 2 +H 2 O ZnO+2NaOH+H 2 O=Na 2 [Zn(OH) 4 ] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO 2 ZnO+SiO 2 =ZnSiO 3 Кислотные -реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO 3 +H 2 O=H 2 SO 4 2.Со щелочами NaOH+SiO 2 =Na 2 SiO 3 +H 2 O 3.С основными оксидами SiO 2 +CaO=CaSiO 3 4.С амфотерными оксидами Al 2 O 3 +3SO3=Al 2 (SO 4 ) 3 20.10.22 Кузнецова Екатерина Владимировна](https://fsd.multiurok.ru/html/2022/10/20/s_6350fcfb767d8/img7.jpg)













































