
Физика и химия о атоме
Авторы презентации: учителя МБОУ «СОШ №56» г.Чебоксары химии Маркова Л.Н.,
физики Пирогова Т.Г.

Цель урока: Сформировать целостное представление об атоме и показать единство законов физики и химии
Задачи:
- Познакомить с историческими фактами открытия атома и его сложного строения.
- Показать, что заряд ядра является главной характеристикой химического элемента.

Гипотеза о том, что вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад.
«Ничего не существует, кроме атомов и пустоты…»
Атом –
(от греческого atomos – неделимый»)
мельчайшая частица химического элемента
Позиция Демокрита:
Позиция Аристотеля:
«Существует предел деления – атом».
« Делимость вещества бесконечна».

Экспериментальные данные, свидетельствующие о делимости атома
1897 г. Дж. Дж. Томсон открыл электрон при исследовании «катодных лучей».
1896 г. Анри Беккерель открыл явление радиоактивности.
Радиоактивность – способность атомов к самопроизвольному ( спонтанному) излучению.
1899 г. Эрнест Резерфорд обнаружил, что это излучение неоднородно;
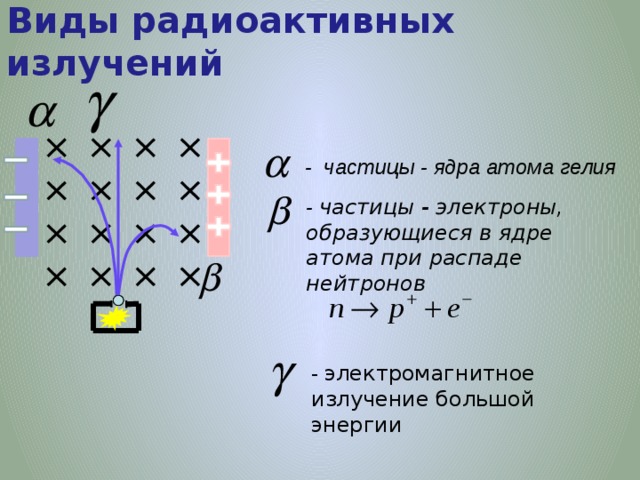
Виды радиоактивных излучений
- частицы - ядра атома гелия
- частицы - электроны, образующиеся в ядре атома при распаде нейтронов
- электромагнитное излучение большой энергии

Модель строения атома Томсона
1903 г.
«Кекс с изюмом»
1. Атом – шар, по всему объёму которого равномерно распределён положительный заряд.
- Внутри шара находятся электроны.
3. Каждый электрон может совершать колебательные движения около своего положения равновесия.
4. Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю.
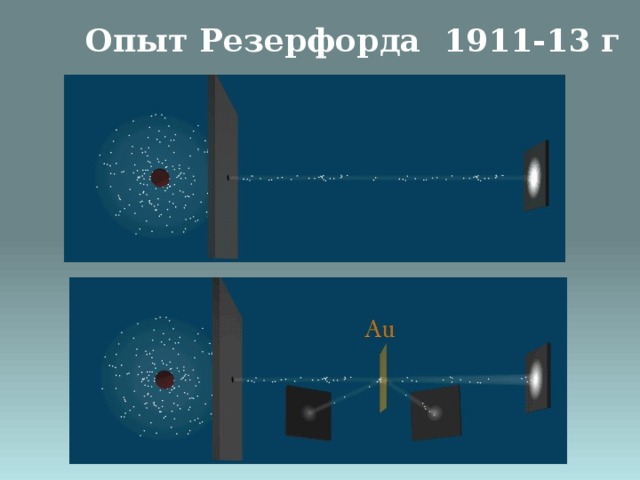
Опыт Резерфорда 1911-13 г
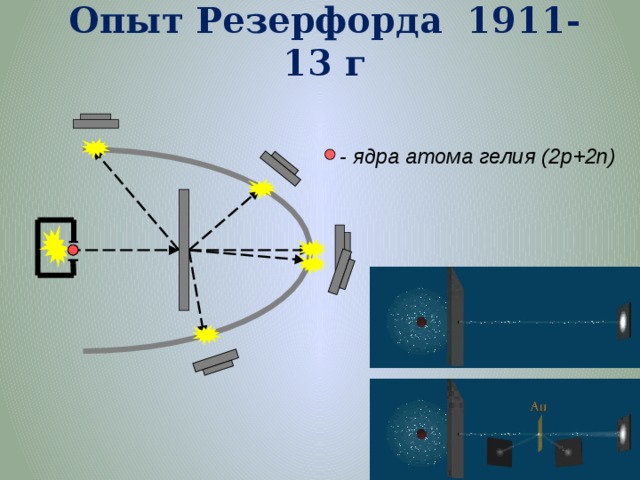
Опыт Резерфорда 1911-13 г
- ядра атома гелия (2p+2n)
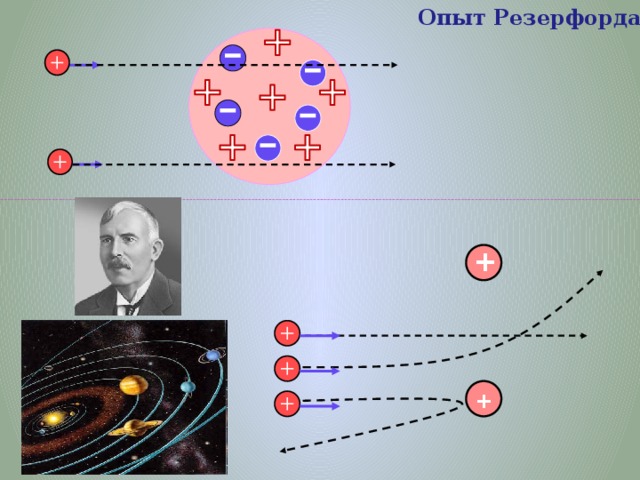
Опыт Резерфорда
+
+
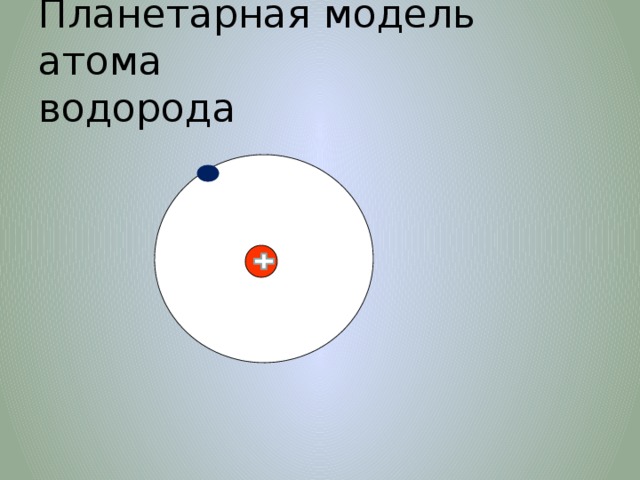
Планетарная модель атома водорода

Экспериментальные данные, свидетельствующие о делимости атома
1919 г. Эрнест Резерфорд открыл протон.
1932 г. Джеймс Чедвик открыл нейтрон
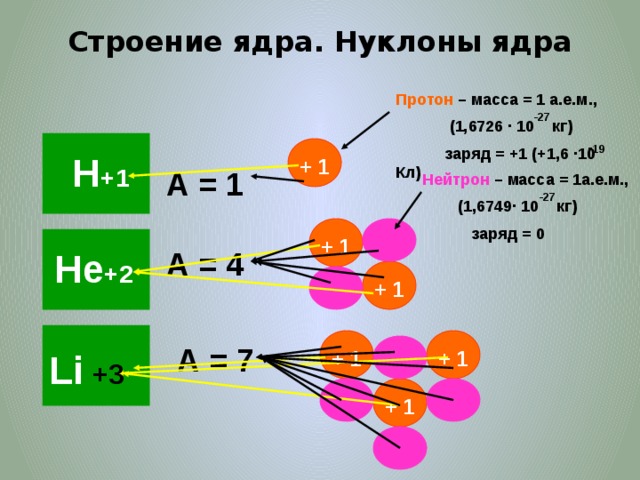
Строение ядра. Нуклоны ядра
Протон – масса = 1 а.е.м.,
(1,6726 · 10 кг)
заряд = +1 (+1,6 ·10 Кл)
-27
- 19
Н +1
+ 1
А = 1
Нейтрон – масса = 1а.е.м.,
(1,6749· 10 кг)
заряд = 0
-27
+ 1
Не +2
А = 4
+ 1
А = 7
+ 1
Li
+ 1
+3
+ 1

1.
2.
3.
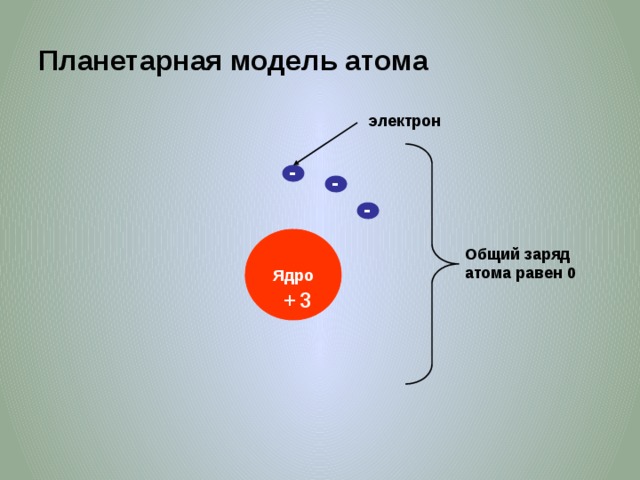
Планетарная модель атома
электрон
-
-
-
Общий заряд атома равен 0
Ядро
+
3
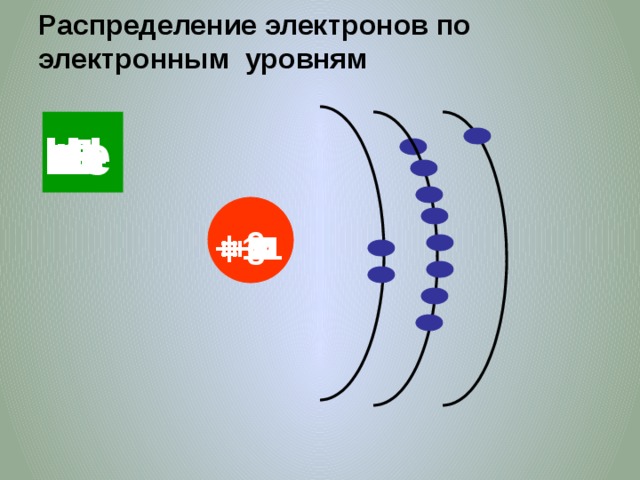
Распределение электронов по электронным уровням
Н
Не
F
O
Be
Na
Ne
N
C
B
Li
+ 9
+ 3
+ 6
+ 11
+ 1
+ 10
+ 2
+ 4
+ 7
+ 5
+ 8
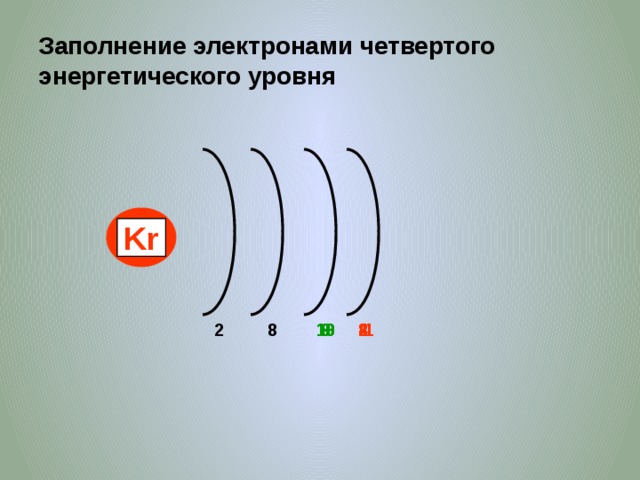
Заполнение электронами четвертого энергетического уровня
Kr
Ge
Ga
Zn
Ti
Sc
Ca
K
2
9
10
1
18
8
3
8
4
2
8
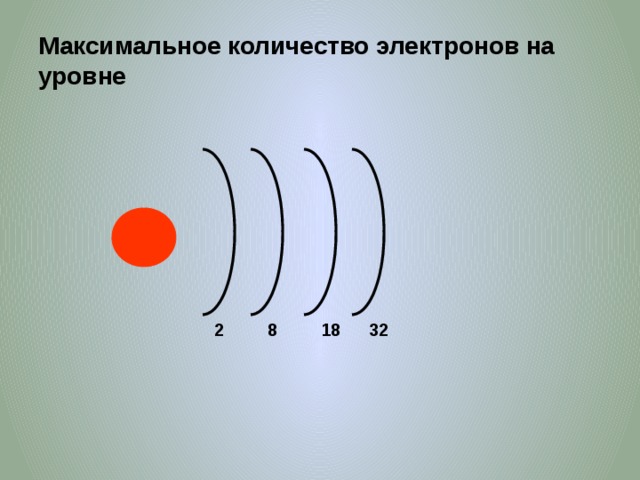
Максимальное количество электронов на уровне
2
8
18
32
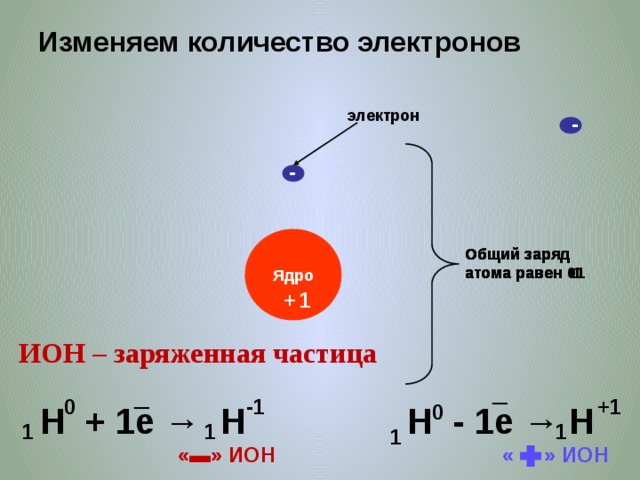
Изменяем количество электронов
электрон
-
-
Общий заряд атома равен 0
Общий заряд атома равен -1
Общий заряд атома равен +1
Ядро
+
1
ИОН – заряженная частица
0
─
-1
+1
1
1
1
─
H - 1e → H
0
H + 1e → H
1
«▬» ИОН
« » ИОН
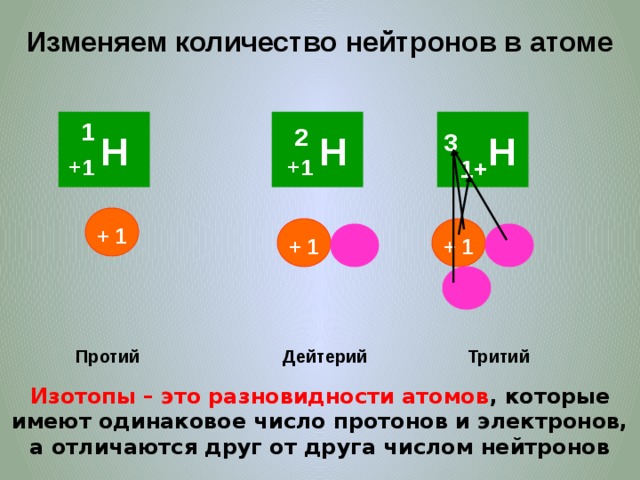
Изменяем количество нейтронов в атоме
1
2
Н
+1 Н
+1 Н
3
1+
+ 1
+ 1
+ 1
Тритий
Дейтерий
Протий
Изотопы – это разновидности атомов , которые имеют одинаковое число протонов и электронов, а отличаются друг от друга числом нейтронов
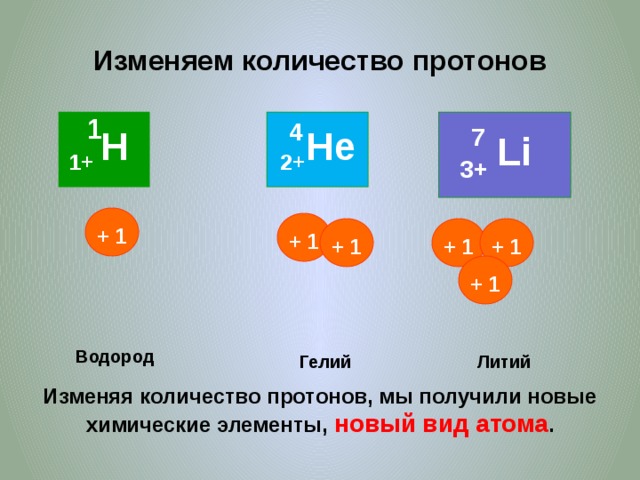
Изменяем количество протонов
1
4
1+ Н
7
2+ Не
Li
3+
+ 1
+ 1
+ 1
+ 1
+ 1
+ 1
Водород
Гелий
Литий
Изменяя количество протонов, мы получили новые химические элементы, новый вид атома .

Рефлексия
Я все очень хорошо понял,
мне было интересно
Мне все понятно, но материал не всегда интересен
Я не все понял, но мне было интересно
Я ничего не понял и на уроке скучал















































