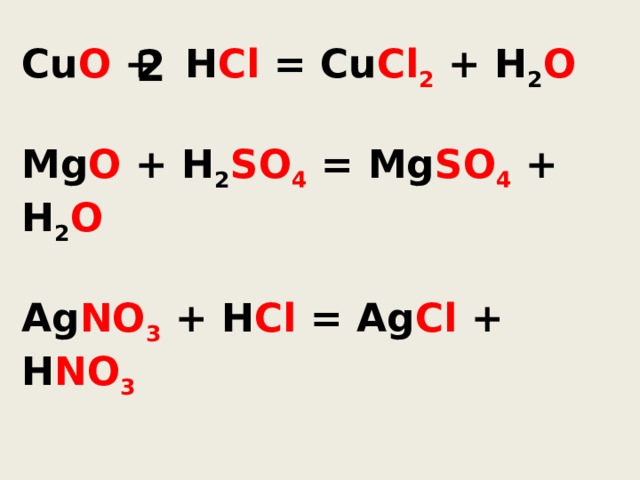Просмотр содержимого документа
«Презентация для урока химии "Типы химических реакций", 8 класс»

Типы химических реакций

Классификация химических реакций по числу и составу исходных и образующихся в результате реакций веществ

Классификация химических реакций по числу и составу исходных и образующихся в результате реакций веществ
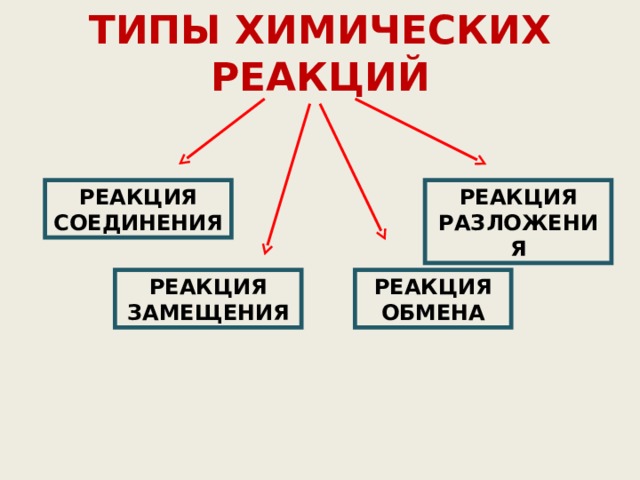
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
РЕАКЦИЯ СОЕДИНЕНИЯ
РЕАКЦИЯ РАЗЛОЖЕНИЯ
РЕАКЦИЯ ЗАМЕЩЕНИЯ
РЕАКЦИЯ ОБМЕНА

Реакция разложения малахита:
(CuOH) 2 CO 3 = 2 CuO + H 2 O + CO 2
оксид углерода
(IV)
оксид меди
(II)
малахит
вода
6
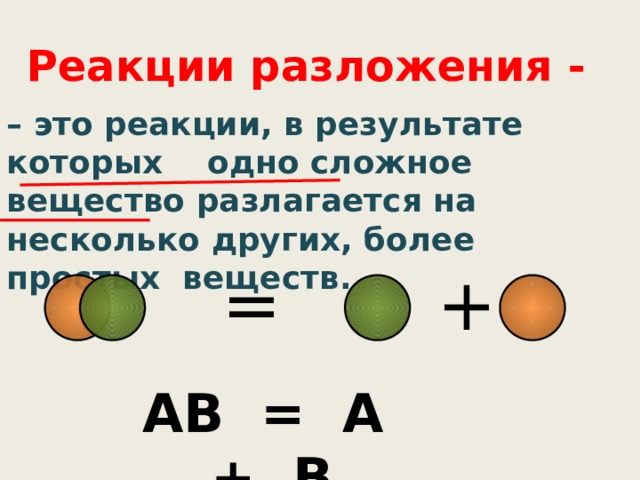
Реакции разложения -
– это реакции, в результате которых одно сложное вещество разлагается на несколько других, более простых веществ.
+
=
АВ = А + В
7

Выберите уравнения реакций разложения:
1) CaO + CO 2 = CaCO 3
2) CO 2 + 2NaOH = Na 2 CO 3 + H 2 O
3) Fe + S = FeS
4) 2H 2 O = 2H 2 + O 2 ↑
5) CuO + H 2 = Cu + H 2 O
6) Zn + 2HCl = ZnCl 2 + H 2 ↑
7) ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
8) Cu(OH) 2 = CuO + H 2 O

Горение магния
2Mg + O 2 = 2MgO

Реакции соединения -
– это реакции, в которых из нескольких простых или сложных веществ образуется одно более сложное вещество .
+
=
А + В = АВ
10

Выберите уравнения реакций соединения:
1) 2HgO = 2Hg + O 2
2) CaCO 3 = CaO + CO 2
3) CuSO 4 + Fe = Cu + FeSO 4
4) CuO + H 2 = Cu + H 2 O
5) 2H 2 + O 2 = 2H 2 O
6) H 2 SO 4 + 2KOH = K 2 SO 4 + 2H 2 O
7) BaO + SO 2 = BaSO 3

Реакция замещения меди железом
Fe + CuSO 4 = Cu + FeSO 4
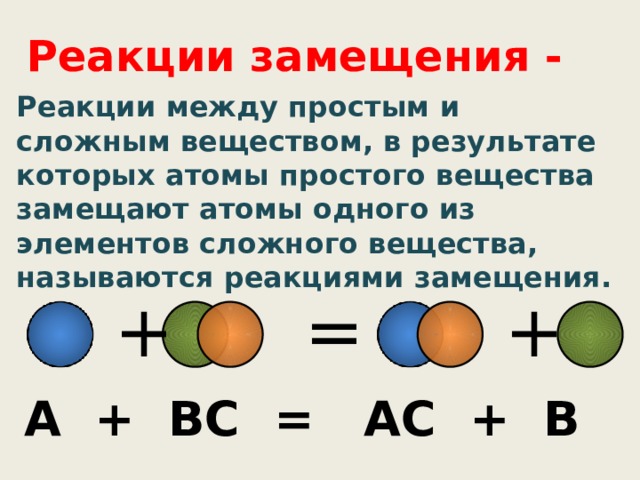
Реакции замещения -
Реакции между простым и сложным веществом, в результате которых атомы простого вещества замещают атомы одного из элементов сложного вещества, называются реакциями замещения.
+
+
=
А + ВС = АС + В
13

Выберите уравнения реакций замещения:
1) CaO + CO 2 = CaCO 3
2) CO 2 + 2NaOH = Na 2 CO 3 + H 2 O
3) Fe + S = FeS
4) 2H 2 O = 2H 2 + O 2 ↑
5) CuO + H 2 = Cu + H 2 O
6) Mg + 2HCl = MgCl 2 + H 2 ↑
7) ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
8) Cu(OH) 2 = CuO + H 2 O
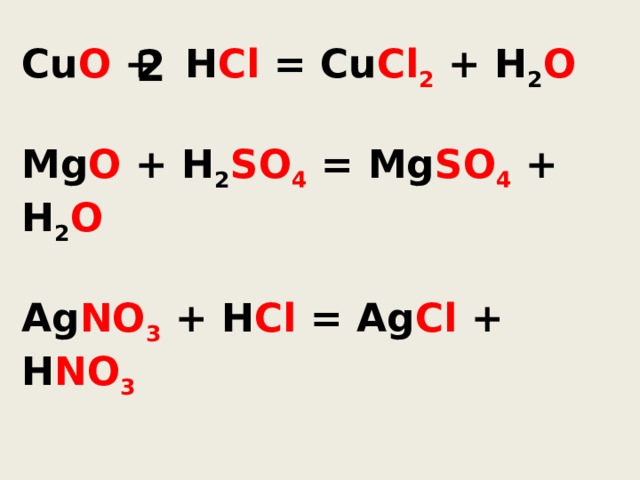
Cu O + H Cl = Cu Cl 2 + H 2 O
2
Mg O + H 2 SO 4 = Mg SO 4 + H 2 O
Ag NO 3 + H Cl = Ag Cl + H NO 3
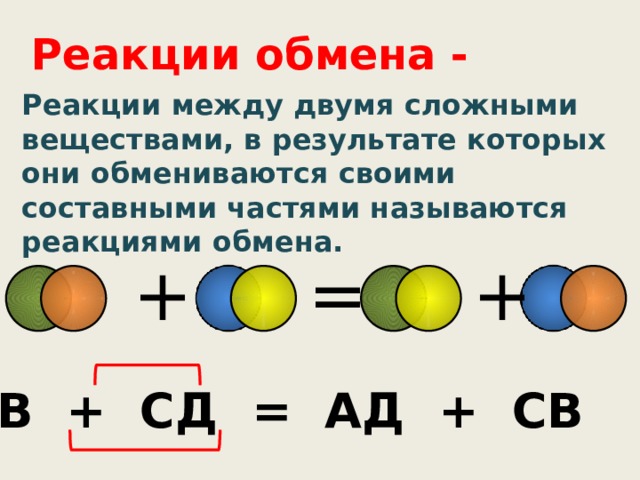
Реакции обмена -
Реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями называются реакциями обмена.
+
=
+
АВ + СД = АД + СВ
16

Выберите уравнения реакций обмена:
1) CaO + CO 2 = CaCO 3
2) CO 2 + 2NaOH = Na 2 CO 3 + H 2 O
3) Fe + S = FeS
4) 2H 2 O = 2H 2 + O 2 ↑
5) CuO + H 2 = Cu + H 2 O
6) Zn + 2HCl = ZnCl 2 + H 2 ↑
7) ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
8) Cu(OH) 2 = CuO + H 2 O
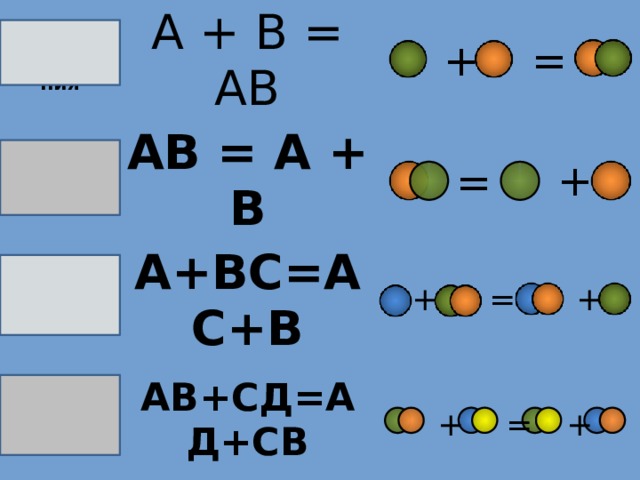
Реакция
А + В = АВ
соединения
Реакция разложения
АВ = А + В
Реакция замещения
А+ВС=АС+В
Реакция обмена
АВ+СД=АД+СВ
+
=
+
=
+
=
+
+
+
=
18

Задание . Определите тип реакции по химическому уравнению:

Домашнее задание
- §21, выучить определения, упр.3
- Повторить §§ 6, 15,16,17, 20