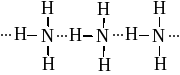ПЛАН-КОНСПЕКТ УРОКА ПО ХИМИИ
Тема урока: «Аммиак»
9 класс
Цель урока: научить школьников получать аммиак в лаборатории, объяснять его свойства на основе знаний о строении атома азота и молекулы аммиака, дать представление о роли аммиака и его производных в жизни человека.
Задачи урока:
образовательные: изучить состав и строение молекулы аммиака, его физические и химические свойства, способы получения в лаборатории и промышленности, применение; познакомить с водородной связью и донорно-акцепторным механизмом образования ковалентной связи.
развивающие: развитие логического и аналитического мышления, развитие критического мышления, самостоятельности и способности к рефлексии, обеспечение системности учения, умения ставить и разрешать проблемы, анализировать, сравнивать, обобщать и систематизировать, бережного отношения к здоровью человека
воспитательные: воспитание положительной мотивации учения, правильной самооценки, уверенности и требовательности к себе, продолжить воспитание толерантности при работе в группе.
Тип урока: Изучение нового материала с элементами повторения и закрепления ранее изученного.
Методы и методические приемы: частично – поисковый, самостоятельная работа, тестовые задания, взаимопроверка, составление опорного конспекта.
Используемые технологии: технология проблемного обучения, использование ИКТ.
План урока:
Организационный момент (2 мин)
Опрос-повторение (5 мин.)
Мотивационно-ориентировочный этап (5 мин.)
Операционно-исполнительский этап. (20 мин.)
Проверка усвоения знаний (10 мин.).
Подведение итогов урока. Рефлексия. Домашнее задание. (3 мин.)
Оборудование:
Таблица растворимости веществ
Периодическая система Д.И. Менделеева
Набор реактивов
Лабораторная посуда
Девиз урока:
«Чтобы интересный мир узнать, необходимо химию познать»
Этапы урока:
I. Организационный этап (2 мин.)
Учитель проверяет готовность учащихся к уроку, организует начало урока. Отмечает отсутствующих.
II. Актуализация знаний (5 мин.)
На прошлом уроке мы изучили характеристику азота. Выполняем вводный контроль: тест по вариантам и проводим взаимопроверку (правильные ответы для контроля – на экране) (Приложение)
III. Мотивационно - ориентировочный этап (5 мин.)
Создание проблемной ситуации.
Вступительное слово учителя: Сегодня на уроке мы познакомимся с удивительным веществом с уникальными свойствами. Его использование может принести пользу или навредить.
Итак, эта история произошла во время I мировой войны. Английский крейсер вел преследование повреждённого в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма, появился удушливый запах, раздражающий горло, стало трудно дышать. Крейсер был вынужден дать задний ход и выйти из дымового облака. Позже обнаружили, что пострадали не только люди, но и металлические части корабля. Что же это было за едкое облако и какой газ почувствовали люди?
Запах этого газа знаком каждому - даже тем, кто совсем далёк от химии. Кое – что о его свойствах тоже всем известно. Это вещество имеет древнюю историю. Арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали – и всякий раз получался едкий газ. Сначала это вещество называли аммониак, а потом сократили название до «аммиака». В средние века этот газ называли «щелочной воздух», а его раствор и сейчас называют «нашатырный спирт».
Итак, вещество, о котором пойдёт речь на нашем уроке – аммиак.
Вопросы: Что вам известно об этом веществе?
«Достаточно ли ваших знаний, чтобы правильно обращаться с этим веществом»
(высказывания учащихся)
Цель нашего урока: исследовать строение и свойства аммиака, изучить основные способы получения.
Давайте проведем небольшое исследование и решим, откуда у этого газа столь необычные свойства и названия.
IV. Операционно-исполнительский этап (20 мин.)
1. Строение молекулы
Формула аммиака – NH3, т.е. это водородное соединение азота.
Работа в группах:
Практическое задание: Моделирование молекулы аммиака (шаро - стержневые наборы)

Работа с учебником: § 17, стр. 47. Ответьте на вопрос:
1. Изобразите электронную и структурную формулу аммиака.
2. Определите химическую связь в этой молекуле.
3. Какую пространственную форму имеет молекула аммиака? (Молекула аммиака имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, а в вершине пирамиды – атом азота. Угол между связями Н-N-Н равен 107.)
4. Кристаллическая решётка (Молекулярная)
Объяснение:
Атом азота образует с атомами водорода 3 ковалентные полярные связи (т.к. электроотрицательность азота больше, чем у водорода) за счет своих трех неспареных электронов; неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи по донорно-акцепторному механизму с атомами, имеющими вакантную орбиталь;
Механизм донорно-акцепторной связи: H3N: + H+ = [NH4]+ образуется ион аммония
2. Физические свойства
Индивидуальная работа с материалом учебника.
- Имеет ли газ специфический запах? (Характерный резкий запах, токсичен)
Объяснение учителем: Физиологическое влияние на организм человека.
Относится к группе веществ удушающего действия, способных вызывать токсический отёк лёгких и тяжёлые поражения нервной системы. Пары сильно раздражают слизистые оболочки глаз и органы дыхания, а также кожные покровы. Вызывают обильное слёзотечение, боль в глазах, хим. ожог роговицы, потерю зрения, приступы кашля.
Выполнение правил ТБ при работе с аммиаком.
- Какого цвета исследуемый газ? (Аммиак бесцветный газ)
- Легче воздуха в 1,7 раз.
- Плотность 0,77 г/л
- Температура кипения аммиака - -33,40С, он сжижается, а при-77,80С превращается в твёрдое белое вещество.
- Хорошо растворяется в воде: в 1 V:700 V
- Сжиженный аммиак при испарении поглощает тепло, при соприкосновении с кожей возникает обморожение различной степени.
3. Химические свойства
Объяснение учителя.
Взаимодействие с водой (Н2О) Оформление в опорном конспекте и оформление на доске.
NH3 + H2O  NH3×H2O (основание)
NH3×H2O (основание)  NH4+ + ОН. Нашатырный спирт
NH4+ + ОН. Нашатырный спирт
Демонстрационный опыт «Аммиачный фонтан»
Проблема: Почему индикаторы меняют свой цвет в растворе аммиака?
NH3 + H2O  NH3×H2O (основание)
NH3×H2O (основание)  NH4+ + ОН.
NH4+ + ОН.
При растворении в воде образуется гидроксид аммония – основание, поэтому фенолфталеин окрашивает раствор в малиновый цвет.
Аммиак хорошо растворим в воде: при 20 С в 1 объёме воды растворяется до 700 объёмов аммиака.
Постановка проблемы. Почему аммиак очень хорошо растворяется в воде?
Строение молекулы позволяет прогнозировать хорошую растворимость в воде. Это связано с возникновением между его молекулами особой химической связи - водородной. У атома азота есть свободная электронная пара в молекуле аммиака, наличие частичного (+) заряда на атоме водорода и наличие частичного (-) заряда на атоме азота.
Для молекул аммиака характерно связывание их между собой в ассоциации за счет водородных связей.
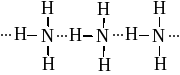
Водородной называется связь между атомами водорода одной молекулы и атомами электроотрицательных элементов другой молекулы (F, O, N)
Учащиеся записывают определение водородной связи.
Взаимодействие с кислотами.
Давайте попробуем частично воспроизвести картину давних лет.
Демонстрационный эксперимент «Дым без огня». Что вы наблюдаете? (Дым.)
Ребята, вас заинтересовало то, что вы сейчас увидели? Густой дым заполнил колбу и начал «выливаться» на стол. А представьте, как были взволнованы алхимики, когда работали с этим веществом.
Теперь бы вы смогли объяснить англичанам, почему между кораблем и судном противника появился едкий «дым», образовался хлорид аммония.
(записываем в опорный конспект и оформляем на доске химическое уравнение между соляной кислотой и аммиаком)
NH3 +HCl=NH4Cl (хлорид аммония) (опыт:дым без огня)
Взаимодействие с серной кислотой (оформление опорного конспекта и оформление на доске)
N Н3 + Н2 SО4= (N Н4)2 SО4 (сульфат аммония)
Аммиак горит в кислороде (запись на доске)
4 NН3 + 3О2 =2N2 + 6Н2О
4NH3 +3O2кат.→4NO+6H2O
4. Получение аммиака в лаборатории.
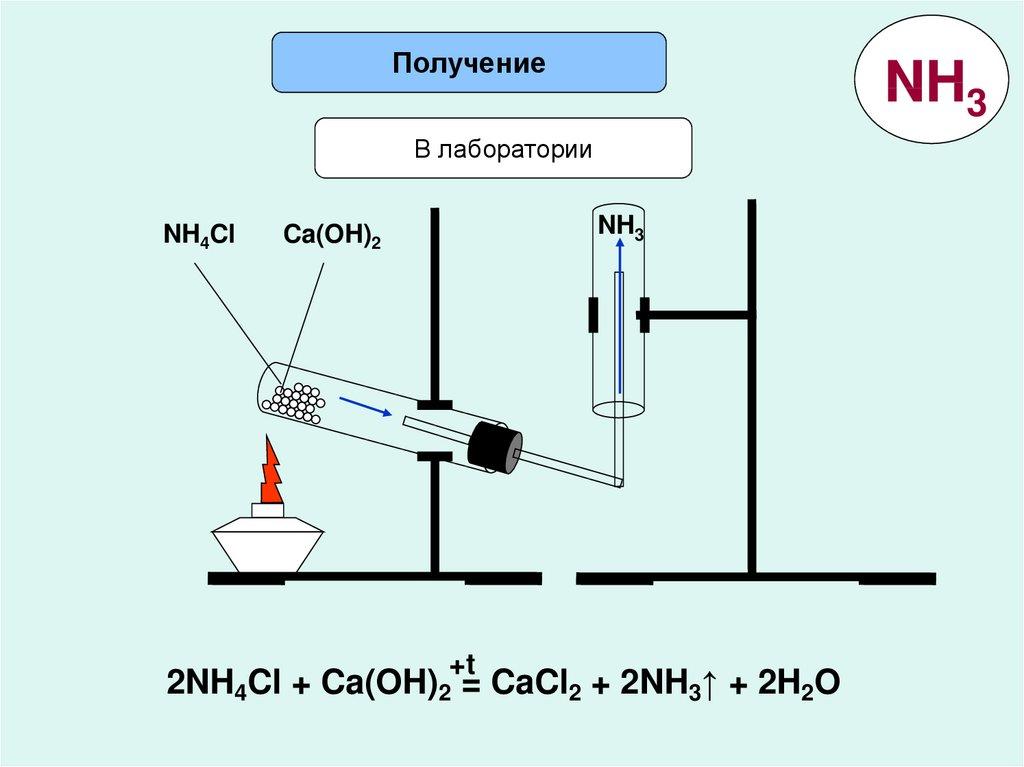
Нагревание смеси хлорида аммония с гидроксидом кальция.
2NH4Cl + Ca (OH) 2 = CaCl2 + 2NH3 +2H2O
Полученный аммиак растворяют в воде, в которую добавляем фенолфталеина. Раствор аммиака окрашивается в малиновый цвет.
Почему раствор аммиака окрасился в малиновый цвет?
Учащиеся: в растворе присутствует ион гидроксида, среда щелочная.
Учитель. В аммиачной воде большая часть аммиака содержится в виде молекул NH3, равновесие смещено влево, (т.к. NH3 - слабый электролит) и такая вода содержит много молекул NH3, поэтому она пахнет аммиаком.
Собирание газа - в перевернутую кверху дном пробирку.
Распознавание: а) по запаху; б) по посинению влажной лакмусовой бумажки
в) по появлению белого дыма от поднесенной стеклянной палочки, смоченной HCl конц.
Получение аммиака в промышленности
Проблемный вопрос: из какого сырья можно получить аммиак в промышленности?
Учащиеся предполагают, что из азота воздуха.
Задача эта была выдвинута перед отечественной наукой Д.И. Менделеевым, который писал: "Одну из задач прикладной химии составляет отыскание технически выгодного способа получения из азота воздуха его соединений, заключающих ассимилируемый азот. Будущность сельского хозяйства много зависит от открытия подобного способа".
Экономически наиболее выгодный способ промышленного связывания атмосферного азота - синтез аммиака из азота и водорода
N2+3H2⇔2NH3+Q
Учитель: Дайте характеристику данной реакции. (ответ учащихся)
экзотермическая
обратимая
каталитическая
гомогенная
Учитель: какие условия смещения равновесия необходимо для увеличения выхода аммиака? Учащиеся: уменьшение температуры, увеличение давления
5. Применение
Производство азотной кислоты.
Для получения аммиачной воды.
Производство азотных удобрений.
В медицине, в быту.
В холодильных установках.
Для паяния.
Взрывчатых веществ.
Проверка усвоения знаний (7 мин.) (контроль/самоконтроль знаний по теме). Найти правильные утверждения.
1. Валентность азота в молекуле аммиака 3+
2. Аммиак тяжелее воздуха -
3. Нашатырный спирт – это хлорид аммония -
4. Нашатырный спирт – это спиртовой раствор аммиака -
5. Водный раствор аммиака окрашивает лакмус в синий цвет +
6. Соли аммония – это соли, содержащие ион аммония +
7. Аммиак горит в атмосфере –
8. Растворение аммиака в воде – физический процесс -
Подведение итогов урока. Рефлексия. Домашнее задание. (3 мин.)
Учитель организует фронтальную беседу по рефлексии итогов урока.
Объясняет домашнее задание:
§17, упр1-4 (устно),5-9 (письменно).