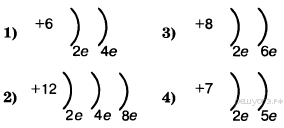Вариант 1
1. Во 2-м периоде VIA группе Периодической системы находится химический элемент, схема строения атома которого
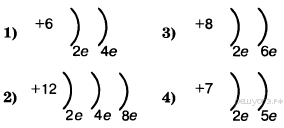
2. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
3. В соединении натрия с кислородом химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
4. В каком соединении степень окисления фосфора равна +3?
1) 
2) 
3) 
4) 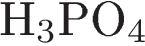
5. Сложным является каждое из двух веществ:
1) кислород и озон
2) белый фосфор и азотная кислота
3) серная кислота и вода
4) вода и барий
6. К какому типу реакций относится уравнение реакции между гидроксидом алюминия и серной кислотой
1) соединение
2) замещение
3) обмен
4) разложение
7. Наибольшее количество положительных ионов образуется при диссоциации 1 моль
1) фосфата натрия
2) серной кислоты
3) нитрата железа(III)
4) сульфида калия
8. При взаимодействии хлорида железа(III) и гидроксида калия образуется
1) вода
2) газ
3) осадок
4) реакция не идет
9. Оксид меди(II) взаимодействует с водным раствором
1) хлорида калия
2) хлороводорода
3) карбоната натрия
4) сульфата магния
10. Определите формулу неизвестного вещества в схеме реакции:
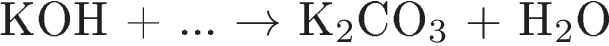
1) 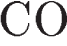
2) 
3) 
4) 
11. Практически осуществимой является реакция между
1)  и
и 
2) 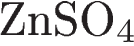 и
и 
3) 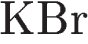 и
и 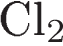
4)  и
и 
12. К окислительно-восстановительным относят реакцию, уравнение которой
1) 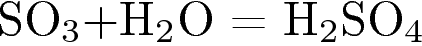
2) 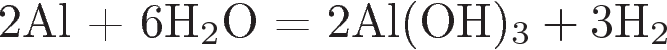
3) 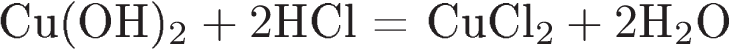
4) 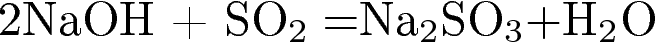
13. На какой диаграмме распределение массовых долей элементов соответствует  ?
?
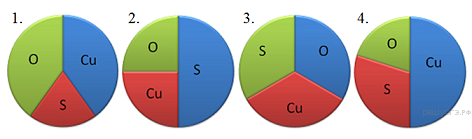
14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Среди химических элементов 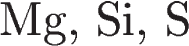
1) наибольший радиус имеют атомы серы
2) наибольшую электроотрицательность имеет магний
3) степень окисления −4 и +4 характерны только для кремния
4) только сера образует высший оксид с кислотными свойствами
5) простое вещество-металл образует только магний
15. Используя метод электронного баланса, составьте уравнение реакции.
Mg + HCl =
Определите окислитель и восстановитель.
16. К 106 г раствора карбоната натрия c массовой долей 10% добавляли соляную кислоту до прекращения выделения газа. Найти массу необходимой кислоты.
Вариант 2
1. Элемент имеет два электрона на 3-м энергетическом уровне. Порядковый номер элемента
1) 2
2) 3
3) 12
4) 16
2. Кислотные свойства высших оксидов ослабевают в ряду:
1) 
2) 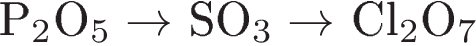
3) 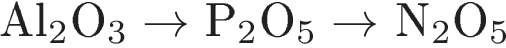
4) 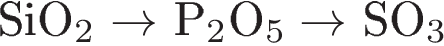
3. Какой вид химической связи характерен для меди?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
4. Степень окисления -2 атом серы проявляет в каждом из соединений:
1)  и
и 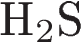
2)  и
и 
3)  и
и 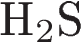
4)  и
и 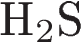
5. Простым является каждое из двух веществ:
1) кислород и метан
2) аммиак и ртуть
3) алмаз и хлор
4) медь и вода
6. Какое уравнение соответствует реакции обмена?
1) 
2) 
3) 
4) 
7. К сильным электролитам относится каждое из двух веществ:
1)  и
и 
2)  и
и 
3)  и
и 
4)  и
и 
8. Вода образуется при действии азотной кислоты на
1) 
2) 
3) 
4) 
9. Оксид калия реагирует
1) только с оснóвными оксидами
2) только с кислотными оксидами
3) как с кислотными, так и с оснóвными оксидами
4) как с кислотными, так и с амфотерными оксидами
10. Соляная кислота вступает в окислительно-восстановительную реакцию с
1) 
2) 
3) 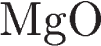
4) 
11. Раствор хлорида цинка реагирует с каждым из двух веществ:
1)  и
и 
2)  и
и 
3)  и
и 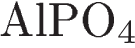
4)  и
и 
12. Элемент азот является окислителем в реакции
1) 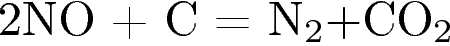
2) 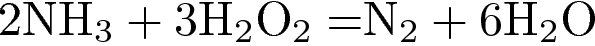
3) 
4) 
13. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата кальция?
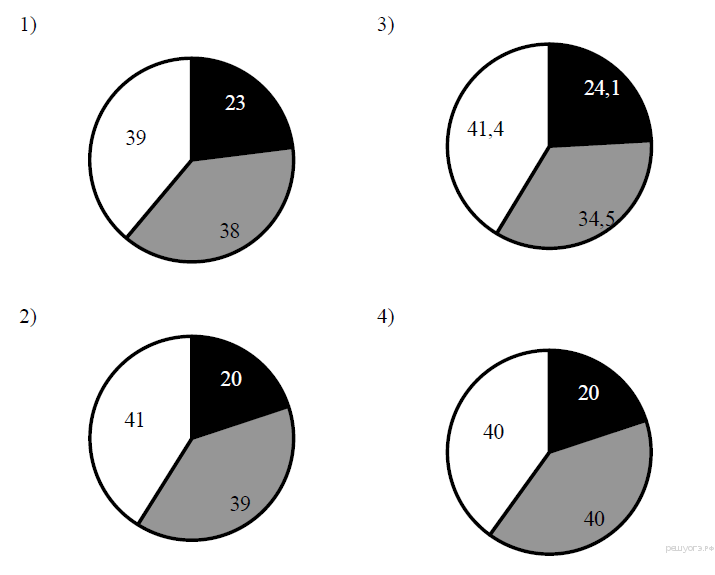
14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
Значения высших степеней окисления элементов увеличиваются в рядах:
1) 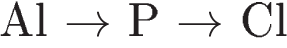
2) 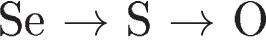
3) 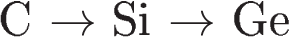
4) 
5) 
15 . Используя метод электронного баланса, составьте уравнение реакции.
Al + O2=
Определите окислитель и восстановитель.
16. Через 80 г раствора гидроксида натрия с массовой долей растворённого вещества 10% пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.), затраченного на реакцию газа.
Вариант 3
1. В атоме химического элемента содержится 15 электронов. Сколько из них находятся на внешнем энергетическом уровне?
1) 1
2) 3
3) 5
4) 7
2. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
3. Ковалентная полярная связь имеется в молекуле
1) серной кислоты
2) пластической серы
3) хлора
4) сульфида рубидия
4. В каком из соединений степень окисления азота равна −3?
1) N2O3
2) KNO2
3) NH4Cl
4) HNO3
5. Формулам  и
и  соответствуют названия
соответствуют названия
1) оксид азота(I) и гидроксид меди(I)
2) оксид азота(II) и гидроксид меди(I)
3) оксид азота(II) и гидроксид меди(II)
4) оксид aзотa(IV) и гидроксид меди(II)
6. Какое уравнение соответствует реакции замещения?
1) 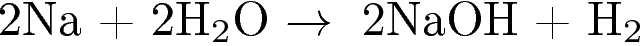
2) 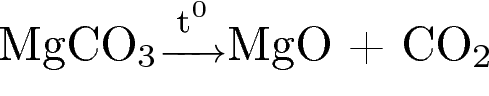
3) 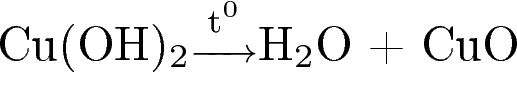
4) 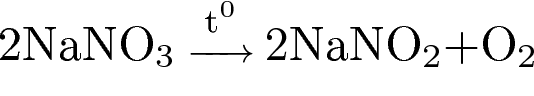
7. Хорошо растворимым в воде сильным электролитом является каждое из двух веществ:
1)  и
и 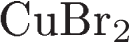
2)  и
и 
3) 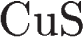 и
и 
4) 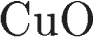 и
и 
8. В реакцию и с гидроксидом кальция, и с нитратом серебра вступает
1) карбонат магния
2) хлорид аммония
3) нитрат натрия
4) сульфат бария
9. Оксид серы(IV) может реагировать с каждым веществом пары
1) 
2) 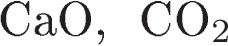
3) 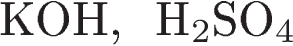
4) 
10. Гидроксид кальция реагирует с
1) углекислым газом
2) кислородом
3) водородом
4) поваренной солью
11. С раствором сульфата меди (II) реагирует
1) 
2) 
3) 
4) 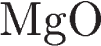
12. Установите соответствие между схемой химической реакции и элементом-восстановителем в этой реакции.
| СХЕМА РЕАКЦИИ | ВОССТАНОВИТЕЛЬ |
| A)  | 1)  |
| Б)  | 2)  |
| B)  | 3)  |
|
| 4)  |
|
| 5)  |
|
|
|
13. На какой диаграмме распределение массовых долей элементов соответствует  ?
?

14. Сходство бора, углерода и азота проявляется в том, что
1) в ядрах их атомов одинаковое число протонов
2) в их атомах одинаковое число электронных слоёв
3) простые вещества проявляют неметаллические свойства
4) в соединениях проявляют только положительные степени окисления
5) образуемые ими высшие оксиды относятся к основным оксидам
15. Используя метод электронного баланса, составьте уравнение реакции по схеме:
Са + HCl =
Определите окислитель и восстановитель
16. К раствору карбоната калия массой 110,4 г и массовой долей 5% прилили избыток раствора нитрата кальция. Вычислите массу образовавшегося осадка.
Вариант 4
1. Число электронов во внешнем электронном слое атома, ядро которого содержит 10 протонов, равно
1) 8
2) 2
3) 6
4) 4
2. Валентность элемента в водородном соединении уменьшается в ряду
1) 
2) 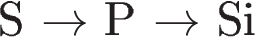
3) 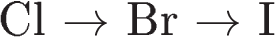
4) 
3. Такой же вид химической связи, как и в молекуле H2S, характерен для
1) K2O
2) S8
3) Na2S
4) СО2
4. В каком соединении хлор проявляет высшую возможную степень окисления?
1) 
2) 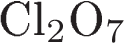
3) 
4) 
5. Кислоте  соответствует оксид
соответствует оксид
1) 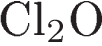
2) 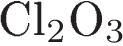
3) 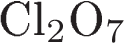
4) 
6. Какое уравнение соответствует реакции обмена?
1) 
2) 
3) 
4) 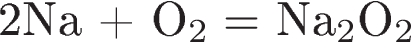
7. Сульфат-анион при диссоциации в водном растворе образует каждое из двух веществ:
1)  и
и 
2)  и
и 
3)  и
и 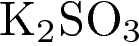
4) 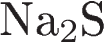 и
и 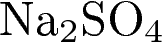
8. При взаимодействии карбоната кальция и соляной кислоты происходит образование
1) воды
2) газа
3) осадка
4) реакция не идет
9. Оксид натрия реагирует с каждым из двух веществ:
1)  и
и 
2) 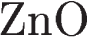 и
и 
3)  и
и 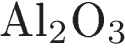
4)  и
и 
10. Соль и вода образуются в результате взаимодействия гидроксида меди(II) c
1) серой
2) водородом
3) соляной кислотой
4) сульфидом натрия
11. Среди веществ:  ,
, 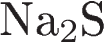 ,
,  в реакцию с раствором
в реакцию с раствором  вступает(-ют)
вступает(-ют)
1) только 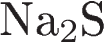
2)  и
и 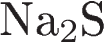
3) 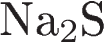 и
и 
4)  и
и 
12. Установите соответствие между схемой химической реакции и элементом-окислителем в этой реакции.
| СХЕМА РЕАКЦИИ | ОКИСЛИТЕЛЬ |
| A)  | 1)  |
| Б)  | 2)  |
| B)  | 3)  |
|
| 4)  |
|
| 5)  |
13. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата бария?
14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов  уменьшается
уменьшается
1) заряд ядра атома
2) радиус атома
3) электроотрицательность элемента
4) валентность в летучем водородном соединении
5) число заполненных электронами энергетических уровней
15. Используя метод электронного баланса, составьте уравнение реакции по схеме:
Li + O2 =
Определите окислитель и восстановитель.
16. К 106 г раствора карбоната натрия c массовой долей 10% добавляли раствор хлорида кальция до прекращения выделения осадка. Вычислите массу осадка.
Ответы к экзаменационному материалу по химии в 8 классе.
Вариант 1
1) 3
2) 1
3) 1
4) 2
5) 3
6) 3
7) 1
8) 3
9) 2
10) 2
11) 3
12) 2
13) 1
14) 35
15)
Mg0 + 2H+Cl- = Mg+2Cl-2 + Н20
Mg0 – 2е = Mg+2 восстановитель
2H+ +2е = Н20 окислитель
16)
1. Рассчитаем массу вещества карбоната натрия
m(Na2CO3)=106*0,1=10,6 г
2. Составим уравнение реакции:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
3. Найдем молярные массы веществ и составим пропорцию
10,6/106=х/2*71
х= 14,2 г
Ответ: m(HCl)= 14,2 г
Вариант 2
1) 3
2) 1
3) 2
4) 4
5) 3
6) 1
7) 2
8) 1
9) 4
10) 4
11) 2
12) 1
13) 2
14) 14
15) 4Al0 + 3O20 = 2Al2+3O3-2
Al0 -3e = Al+3 восстановитель
O20 +4e = 2O-2 окислитель
16) 1. Рассчитаем массу вещества гидроксида натрия
m(NaOH)=80*0,1=8 г
2. Составим уравнение реакции:
2NaOH + CO2 = Na2CO3 + H2O
3. Найдем молярные массы веществ и составим пропорцию
8/2*40=х/22,4
х= 2,24 л
Ответ: m(CO2)= 2,24 л
Вариант 3
1) 3
2) 1
3) 1
4) 3
5) 4
6) 1
7) 2
8) 2
9) 1
10)1
11) 2
12) 235
13) 1
14) 23
15. Са0 + 2H+Cl- = Са+2Cl-2 + Н20
Са0 – 2е = Са+2 восстановитель
2H+ +2е = Н20 окислитель
16) 1. Рассчитаем массу вещества карбоната калия
m(K2CO3)=110,4*0,05=5,52 г
2. Составим уравнение реакции:
K2CO3 + Ca(NO3)2 = 2KNO3 + CaCO3
3. Найдем молярные массы веществ и составим пропорцию
5,52/138=х/100
х= 4
Ответ: m(CaCO3)= 4 г
Вариант 4
1) 1
2) 4
3) 4
4) 2
5) 3
6) 3
7) 2
8) 2
9) 3
10) 3
11) 1
12) 143
13) 4
14) 24
15) 2Li0 + O20 = 2Li2+ O-2
Li0 -1e = Li+ восстановитель
O20+ 4е = 2O-2 окислитель
16) 1. Рассчитаем массу вещества карбоната натрия
m(Na2CO3)=106*0,1=10,6 г
2. Составим уравнение реакции:

3. Найдем молярные массы веществ и составим пропорцию
10,6/106=х/100
х= 1
Ответ: m(CaCO3)= 1 г
Вариант 5
1. Число электронов во внешнем электронном слое атома, ядро которого содержит 10 протонов, равно
1) 8
2) 2
3) 6
4) 4
2. Среди перечисленных элементов наименьшей электроотрицательностью обладает
1) сера
2) кислород
3) углерод
4) кремний
3. Вещество, образованное посредством ионных связей:
1) оксид серы(IV)
2) оксид бария
3) сероводород
4) аммиак
4. Степень окисления азота уменьшается в ряду:
1) 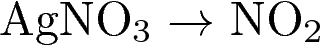
2) 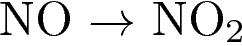
3) 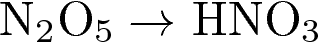
4) 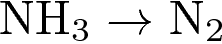
5. Кислоте  соответствует оксид
соответствует оксид
1) 
2) 
3) 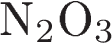
4) 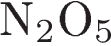
6. Горение сероводорода
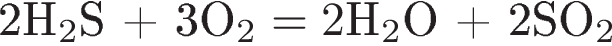
является реакцией
1) соединения
2) окислительно-восстановительной
3) замещения
4) обмена
7. При диссоциации 1 моль соли в растворе образовалось 4 моль положительных и отрицательных ионов. Формула соли —
1) 
2) 
3) 
4) 
8. Практически полностью в водном растворе взаимодействуют вещества:
1) нитрат серебра и хлороводород
2) нитрат кальция и хлорид калия
3) хлороводород и нитрат натрия
4) хлороводород и нитрат калия
9. Оксид серы(IV) может реагировать с каждым веществом пары
1) 
2) 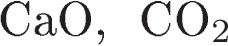
3) 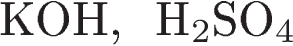
4) 
10. Гидроксид магния реагирует с
1) оксидом углерода (II)
2) сульфатом натрия
3) алюминием
4) азотной кислотой
11. Среди веществ:  — в реакцию с соляной кислотой вступает(-ют)
— в реакцию с соляной кислотой вступает(-ют)
1)  и
и 
2)  и
и 
3) только 
4)  и
и 
12. Фосфор является окислителем в реакции
1) 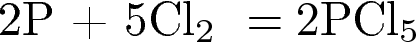
2) 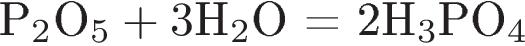
3) 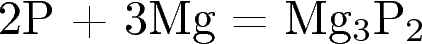
4) 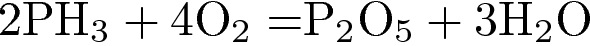
13. На какой диаграмме распределение массовых долей элементов соответствует количественному составу фосфата кальция?

14. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов 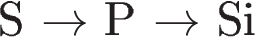 происходит уменьшение (ослабление)
происходит уменьшение (ослабление)
1) числа протонов в ядрах атомов
2) числа электронных слоев в атомах
3) радиуса атомов
4) металлических свойств
5) кислотного характера свойств высших оксидов
15. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
Zn + HNO3 =
Определите окислитель и восстановитель.
16. К 89 г раствора хлорида алюминия с массовой долей 15% добавили избыток раствора нитрата свинца. Определите массу выпавшего осадка.