
Окислительно-восстановительные реакции

Методическая разработка
учителя химии МОУ «СОШ №10»
Пермяковой В.А.
Урок 1 О кислительно- в осстановительные р еакции . Составление уравнений ОВР методом электронного баланса

Окислительно-восстановительными являются химические реакции, протекающие с изменением степеней окисления атомов.
Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов.

Алгоритм определения степеней окисления атомов по формулам соединений
Последовательность действий
Форма записи
- Определяем степень окисления правого атома по формуле: с.о. пр. а. = № группы - 8
S - VI гр. с.о. ( S) = 6 – 8 = -2
Al2S3
2. Определяем общее число «-» и «+» зарядов:
степень окисления правого атома • индекс. Записываем полученное число над формулой в кружок без знака «-»
(-2 • 3) =-6
3. Определяем «+» степень окисления левого атома. Для этого общее число зарядов делим на индекс левого атома: 6 : 2 =3
4. Сумма степеней окисления всех атомов в соединении =0.
Проверяем: ( +3 ) • 2 + (-2)•3 = + 6 – 6 = 0
Степени окисления атомов определены правильно

Алгоритм определения степеней окисления по формулам соединений, состоящих из трех видов атомов
Определить степени окисления атомов в серной кислоте
Последовательность действий
Форма записи
- Определяем степень окисления правого атома по формуле: с.о. пр. а. = № группы - 8
О - VI гр. с.о. (О ) = 6 – 8 = -2
H 2 SO 4
2. Определяем степень окисления левого атома :
- с.о. Ме I-A , II-A , III-A = + № группы
- Н - +1
- с.о. Ме с переменной степенью окисления определяется по формуле вещества
3. Определяем ст. окисления центрального атома :
из общего числа отрицательных зарядов вычитаем число
положительных зарядов.
8 – 2 = 6

Химический эксперимент
Задание: провести реакции, определить их тип, определить степени окисления атомов
1) Взаимодействие сульфата меди ( II) c гидроксидом натрия
CuSO 4 +2NaOH Na 2 SO 4 + Cu(OH) 2
Cu +2 S +6 O 4 ‾ 2 +2 Na +1 O ‾ 2 H +1 Na 2 +1 S +6 O 4 ‾ 2 + Cu +2 ( O ‾ 2 H +1 ) 2 ↓ – реакция ионного обмена , c тепени окисления атомов не изменились.
2 ) Взаимодействие оксида меди( II) с водородом
CuO + Н 2 Н 2 O+ Cu ↓
Cu +2 O -2 + Н 2 0 → Н 2 +1 O -2 + Cu 0 ↓ – реакция замещения , степени окисления атомов изменились .
3 ) Гашение негашеной извести
Са +2 О -2 + Н 2 +1 О -2 → Са +2 (О -2 Н +1 ) 2 – реакция c оединения , степени окисления атомов не изменились.
4 ) Горение фосфора в хлоре
2 Р 0 + 5CL 2 0 2P +5 Cl 5 -1 - реакция c оединения , степени окисления атомов изменились.
5 ) Разложение пероксида водорода
2 Н +1 2 О -1 2 2 Н +1 2 О -2 + О 2 0 - реакция разложения , степени окисления атомов изменились.
6) Разложение гидроксида меди ( II)
Cu +2 (O ‾ 2 H +1 ) 2 Cu +2 O -2 + H +1 2 O ‾ 2 - реакция c оединения , степени окисления атомов не изменились.


Вывод:
- реакции ионного обмена никогда не являются ОВР.
ОВР являются :
- все реакции замещения
- реакции соединения простых веществ
- реакции разложения, если образуется хотя бы одно простое вещество.
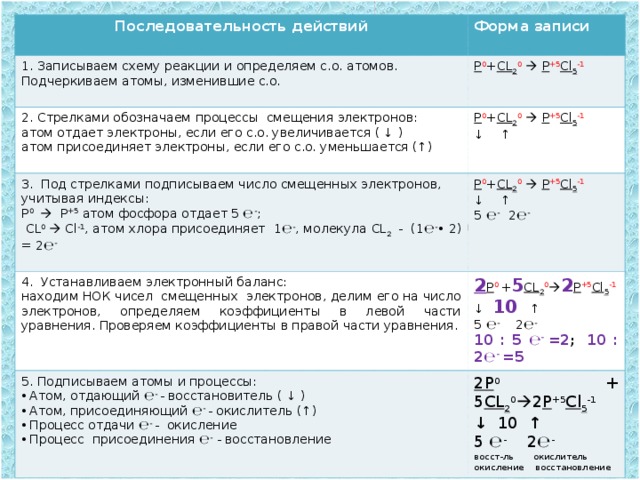
Алгоритм составления уравнений ОВР методом электронного баланса
Последовательность действий
Форма записи
1. Записываем схему реакции и определяем с.о. атомов. Подчеркиваем атомы, изменившие с.о.
Р 0 + CL 2 0 P +5 Cl 5 -1
2. Стрелками обозначаем процессы смещения электронов:
атом отдает электроны, если его с.о. увеличивается ( ↓ )
атом присоединяет электроны, если его с.о. уменьшается (↑)
Р 0 + CL 2 0 P +5 Cl 5 -1
↓ ↑
3. Под стрелками подписываем число смещенных электронов,
учитывая индексы:
Р 0 P +5 атом фосфора отдает 5 ℮ - ;
CL 0 Cl -1 , атом хлора присоединяет 1℮ - , молекула CL 2 - (1℮ - • 2) = 2℮ -
4. Устанавливаем электронный баланс:
находим НОК чисел смещенных электронов, делим его на число электронов, определяем коэффициенты в левой части уравнения. Проверяем коэффициенты в правой части уравнения.
Р 0 + CL 2 0 P +5 Cl 5 -1
↓ ↑
5 ℮ - 2℮ -
2 Р 0 + 5 CL 2 0 2 P +5 Cl 5 - 1
5. Подписываем атомы и процессы:
↓ 10 ↑
5 ℮ - 2℮ -
- Атом, отдающий ℮ - - восстановитель ( ↓ )
- Атом, присоединяющий ℮ - - окислитель (↑)
- Процесс отдачи ℮ - - окисление
- Процесс присоединения ℮ - - восстановление
2Р 0 + 5 CL 2 0 2 P +5 Cl 5 - 1
↓ 10 ↑
5 ℮ - 2℮ -
восст-ль окислитель
окисление восстановление
10 : 5 ℮ - =2 ; 10 : 2℮ - =5

Важнейшие восстановители и окислители
восстановители
окислители
- Металлы, водород, уголь
- Оксид углерода ( II)
- Сероводород, оксид серы ( IV) , сернистая кислота H 2 SO 3 и её соли
- Иодоводородная кислота HI, бромоводородная кислота HBr, хлороводородная кислота HCl
- Хлорид олова( II) SnCl 2 , сульфат железа( II) FeSO 4 , сульфат марганца( II) MnSO 4 , сульфат хрома (III) Cr 2 (SO 4 ) 3
- Азотистая кислота HNO 2 , аммиак H 3 N, оксид азота NO ( II)
- Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза.
- Галогены
- Перманганат калия KMnO 4 , манганат калия K 2 MnO 4 , оксид марганца ( IV) MnO 2
- Дихромат калия K 2 Cr 2 O 7 , хромат калия K 2 CrO 4
- Азотная кислота HNO 3
- Кислород О 2 , озон О 3 , пероксид водорода Н 2 О 2
- Серная кислота Н 2 SO 4 (конц.) , селеновая кислота Н 2 S е O 4
- Оксид меди ( II) С uO , оксид серебра ( I) Ag 2 O, оксид свинца ( IV) PbO 2 ,
- Ионы благородных металлов Ag + , Au 3+
- Хлорид железа ( III) FeCl 3

Домашнее задание
- §19 (стр. 155 – 158)
- Повторить алгоритмы
- Составить уравнения ОВР методом электронного баланса:
1. CO + O 2 CO 2
2.KBr + Cl 2 KCl + Br 2
3. Н 2 S + O 2 Н 2 O + S ↓
4.HI + H 2 SO 4 I 2 + H 2 S + H 2 O
5.KNO 2 + KMnO 4 + H 2 O KNO 3 + MnO 2 + KOH
6. уравнения реакций, представленных в видеофрагменте


Урок 2
Классификация окислительно-восстановительных реакций
Проверка домашнего задания

1. 2 C +2 O + О 2 0 2 С + 4 O 2
↓ ↑
2℮ - 4 4℮ -
восст- ль окис-ль
окис-ние восст-ние
3. 2 Н 2 S -2 + O 2 0 2 Н 2 O -2 + 2 S 0 ↓
↓ 4 ↑
2℮ - 4℮ -
восст-ль окис-ль
окисление восст-ние
2. 2 K Br -1 + Cl 2 0 2 K Cl -1 + Br 2 0
↓ 2 ↑
1℮ - 2℮ -
восст-ль окис-ль
окисление восст-ние
4. 8 H I -1 + H 2 S +6 O 4 4 I 2 0 + H 2 S -2 + 4 H 2 O
↓ 8 ↑
1℮ - 8℮ -
восст-ль окис-ль
окисление восст-ние
5. 3 K N +3 O 2 + 2 K Mn +7 O 4 + H 2 O 3 K N +5 O 3 + 2 Mn +4 O 2 + 2 KOH
↓ 6 ↑
2℮ - 3℮ -
восст-ль окис-ль
окисление восст-ние

Классификация ОВР
Рассмотрим реакцию получения хлора в лаборатории
KMnO 4 + HCl → CL 2 + MnCL 2 + KCl + H 2 O
K Mn +7 O 4 + H Cl -1 → CL 2 0 + Mn +2 CL 2 + KCl + H 2 O
восстановитель 2Cl -1 - 2 ℮ - → Cl 2 0 5 окисление
окислитель Mn +7 + 5℮ - → Mn +2 2 восстановление
2 K Mn +7 O 4 + 5 H Cl -1 → 5 CL 2 0 + 2 Mn +2 CL 2 + 2 KCl + H 2 O
2 K Mn O 4 + 16 H Cl → 5 CL 2 + 2 Mn CL 2 + 2 KCl + 8 H 2 O
Вывод: межмолекулярными называются ОВР, в которых атомы окислителя и восстановителя находятся в разных веществах


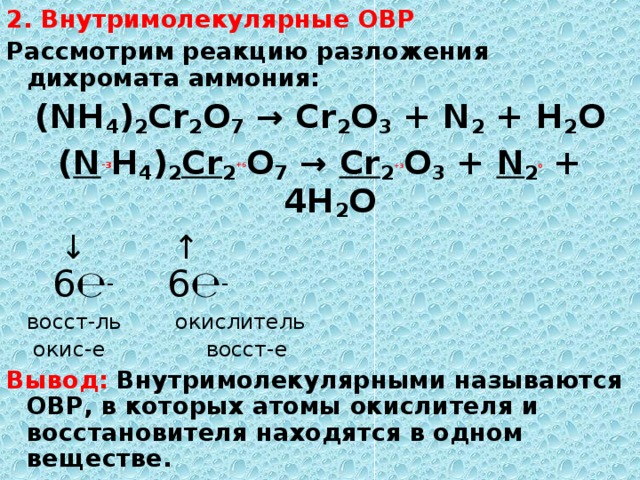
2. Внутримолекулярные ОВР
Рассмотрим реакцию разложения дихромата аммония:
(NH 4 ) 2 Cr 2 O 7 → Cr 2 O 3 + N 2 + H 2 O
( N -3 H 4 ) 2 Cr 2 +6 O 7 → Cr 2 +3 O 3 + N 2 0 + 4 H 2 O
↓ ↑
6 ℮ - 6 ℮ -
восст-ль окислитель
окис - е восст-е
Вывод: Внутримолекулярными называются ОВР, в которых атомы окислителя и восстановителя находятся в одном веществе.

3. Реакции диспропорционирования
Растворение хлора в воде
CL 2 + H 2 O → HClO + HCl
Cl 2 0 + H 2 O → H Cl +1 O + H Cl -1
восстановитель Cl 0 - 1 ℮ - → Cl +1 окисление
окислитель Cl 0 + 1 ℮ - → Cl -1 восстановление
Вывод:
протекание реакций диспропорционирования сопровождается одновременным увеличением и уменьшением степени окисления атомов одного и того же химического элемента.

Домашнее задание
- Выучить определения типов ОВР
- Составить по схемам уравнения ОВР методом электронного баланса, указать их тип:
- NH 4 NO 3 → N 2 O + H 2 O
- Н 2 S + H 2 SO 3 → S + H 2 O
- Н 2 S + KMnO 4 + H 2 SO 4 → S + MnSO 4 + K 2 SO 4 + H 2 O
- По тетради 9 класса повторить окислительно-восстановительные свойства:
- галогенов и их соединений
- серы и ее соединений
- азота и его соединений
- фосфора и его соединений
Урок 3
ОВР в органической химии

Проверка домашнего задания

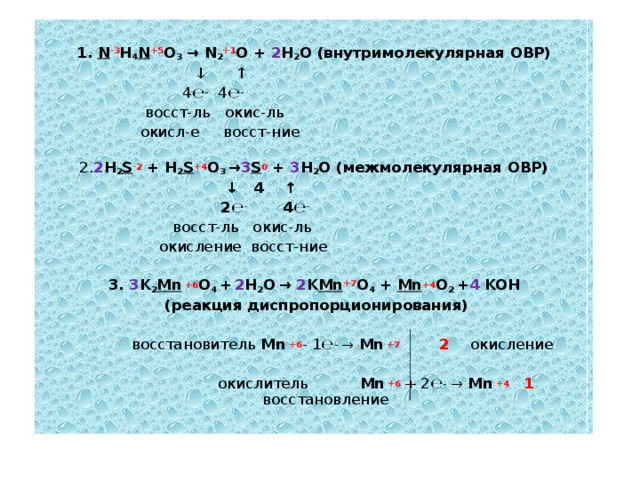
1. N - 3 H 4 N + 5 O 3 → N 2 + 1 O + 2 H 2 O (внутримолекулярная ОВР)
↓ ↑
4 ℮ - 4℮ -
восст-ль окис-ль
окисл - е восст-ние
2. 2 Н 2 S -2 + H 2 S +4 O 3 → 3 S 0 + 3 H 2 O (межмолекулярная ОВР)
↓ 4 ↑
2℮ - 4℮ -
восст-ль окис-ль
окисление восст-ние
3. 3 K 2 Mn + 6 O 4 + 2 H 2 O → 2 K Mn +7 O 4 + Mn +4 O 2 + 4 KOH
(реакция диспропорционирования)
восстановитель Mn + 6 - 1 ℮ - → Mn + 7 2 окисление
o кислитель Mn + 6 + 2 ℮ - → Mn + 4 1 восстановление

Алгоритм определения степеней окисления атомов в молекулах органических веществ
Последовательность действий
Форма записи
Задание: Определить степень окисления атома углерода в молекуле метанола ( СН 3 –ОН)
1. Записываем структурную формулу вещества
H
I
H – С – H
I
О – H
2. Стрелками обозначаем направление смещения ℮ _ (от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью)
H
↓
H → С ←H
↓
О ← H
3. Определяем разницу между количеством ℮ _ , смещенных к атому ( - ) и количеством ℮ _ , смещенных от атома ( + ):
3 (-) – 1 (+) = 2 (-) , следовательно степень окисления атома углерода в молекуле метанола = -2
4. Записываем степень окисления атома углерода над формулой вещества С -2 Н 3 –ОН

Задание:
1. Определить, является ли ОВР реакция обесцвечивания этиленом раствора перманганата калия
исходное вещество продукт реакции
Н Н Н Н
↓ ↓ ↓ ↓
С = С с.о. каждого атома углерода = -2 Н →С – С ←Н с.о. каждого атома углерода = -1
↑ ↑ ↓ ↓
Н Н ОН ОН
Степень окисления атомов углерода изменилась, это ОВР
3 С 2 -2 Н 4 + 2 К Mn +7 O 4 + 4 H 2 O→ 3 C 2 -1 H 6 O 2 -1 + 2 Mn +4 O 2 + 4 KOH
↓ 6 ↑
2℮ _ 3 ℮ _
восстановитель окислитель
окисление восстановление


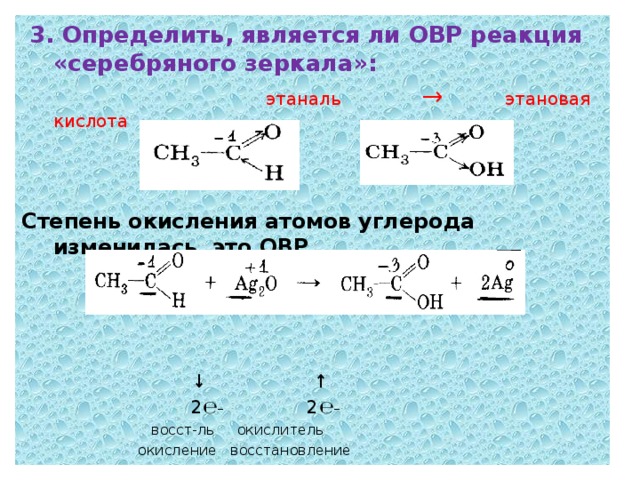
3. Определить, является ли ОВР реакция «серебряного зеркала»:
этаналь → этановая кислота
Степень окисления атомов углерода изменилась, это ОВР
↓ ↑
2 ℮ _ 2 ℮ _
восст-ль окислитель
окисление восстановление


Домашнее задание
- Конспект учить
- Составить уравнение ОВР для реакции горения этилена.
- §19 стр.155 – 158 (повт.)
- № 2,3 стр.162 (письм.)

Урок 4
Урок-упражнение: «Окислительно-восстановительные реакции»

Проверка домашнего задания

1. Повторить определения:
- степень окисления
- окислительно-восстановительные реакции
- восстановитель
4. окислитель
5. окисление
6. восстановление
7. межмолекулярные ОВР
8. внутримолекулярные ОВР
9. реакции диспропорционирования
10.формулы важнейших окислителей и восстановителей.

2. Проверка письменного домашнего задания
Горение этилена С 2 -2 Н 4 + 3 O 2 0 → 2 C +4 O 2 + 2 H 2 O -1
↓ ↑
12 ℮ _ 12 4 ℮ _
восст - ль окислитель
окисление восстановление
№ 2 С -4 Н 4 + 4 С L 2 0 → C +4 Cl 4 + 4 H Cl -1
↓ ↑
8 ℮ _ 8 2 ℮ _
восст-ль окислитель
окисление восстановление
№ 3 Кислород является восстановителем только при взаимодействии с фтором
О 2 0 + 2 F 2 0 → O +2 F 2 -1
↓ 4 ↑
4 ℮ _ 2 ℮ _
восст-ль окислитель
окисление восстановление

Значение окислительно-восстановительных реакций
«Жизнь – цепь непрерывно протекающих окислительно-восстановительных реакций»…
Окислительно-восстановительными являются:
- процессы ассимиляции и диссимиляции в живых организмах;
- процессы получения энергии за счет сжигания различных видов топлива;
- реакции получения металлов из руд;
- процессы производства аммиака, азотной, серной, уксусной кислот и других важнейших химических веществ;
- реакции осуществления круговоротов химических элементов в природе.






























































