

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Была в сети 14.02.2024 18:42

Земцова Антонина Ивановна
учитель химии, ОБЖ и экономики
33 года
Местоположение
Россия, Тюменская область
Специализация
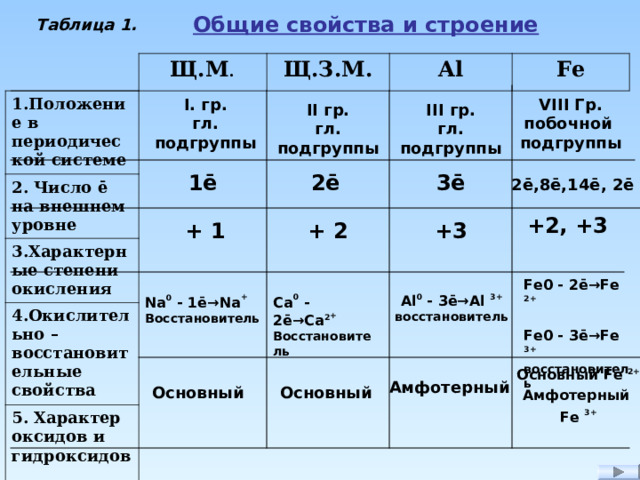
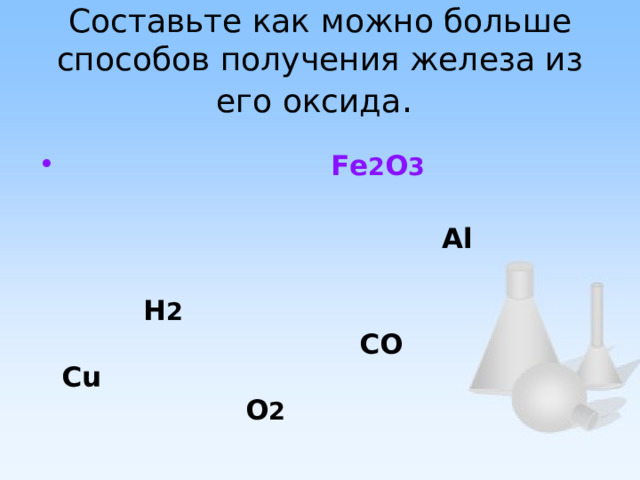
Обобщение и систематизация знаний по теме «Металлы»
Категория:
Химия
20.10.2023 10:35
© 2023, Земцова Антонина Ивановна 65 0






 Fe + HCl Zn + H3PO4 Cu + H2O Al + HCl Pb + H2SO4(разб.) Ag + HCl " width="640"
Fe + HCl Zn + H3PO4 Cu + H2O Al + HCl Pb + H2SO4(разб.) Ag + HCl " width="640"





















