Просмотр содержимого документа
«Методическая разработка "Фосфор"»

Фосфор
Косаченко Н.А., учитель химии
б
б
б
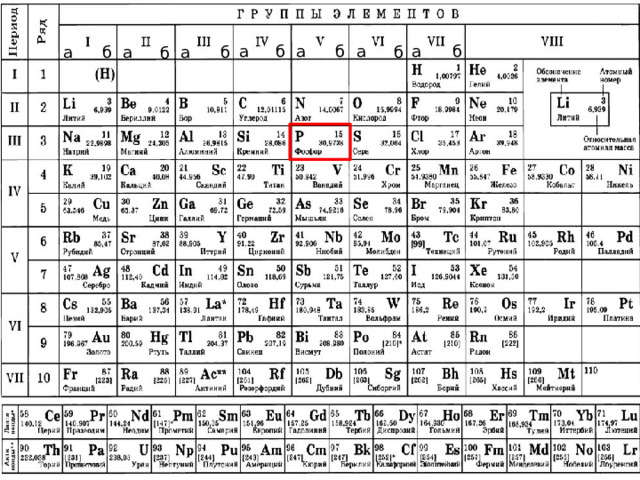
а
а
а
а
а
б
а
б
а
б
б

Строение
ФОСФОР : Р– элемент, неметалл.
Р +15 ) 2 ) 8 ) 5
1S 2 2S 2 2P 6 3S 2 3P 3

Открытие фосфора
Лаборатория алхимика XVI–XVII веков
Открытие фосфора изображено на картине английского художника Дж. Райта

Белый, красный, жёлтый, черный фосфор
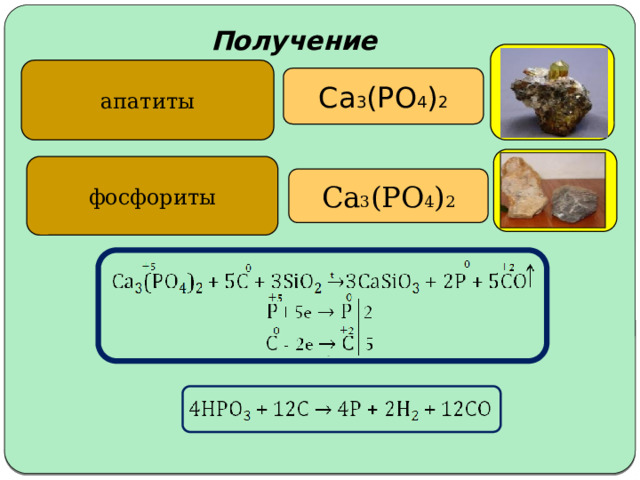
Получение
апатиты
Ca 3 (PO 4 ) 2
фосфориты
Ca 3 (PO 4 ) 2

Нахождение в природе
фосфорит
хлорапатит
фторапатит
Аллотропия и физические свойства
АЛЛОТРОПНЫЕ
МОДИФИКАЦИИ
ЧЕРНЫЙ
ФОСФОР
КРАСНЫЙ
БЕЛЫЙ
ФОСФОР
ФОСФОР
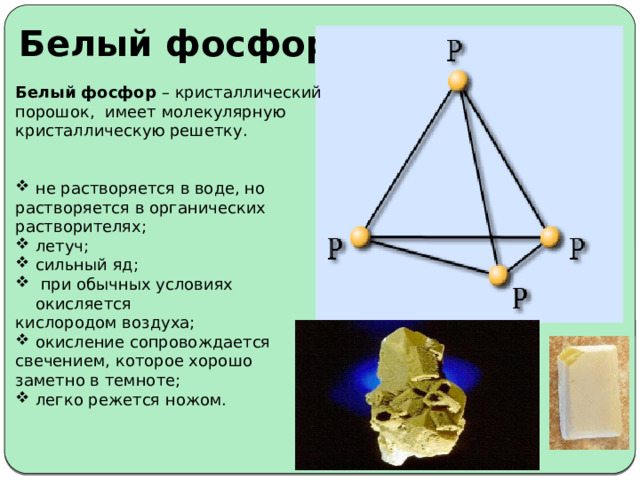
Белый фосфор (Р 4 )
Белый фосфор – кристаллический порошок, имеет молекулярную кристаллическую решетку.
- не растворяется в воде, но
растворяется в органических растворителях;
- летуч;
- сильный яд;
- при обычных условиях окисляется
кислородом воздуха;
свечением, которое хорошо заметно в темноте;

Красный фосфор
Красный фосфор - порошок темно – красного цвета, имеет атомную кристаллическую решетку. Образующийся при нагревании белого до 320 °С без доступа воздуха.
- он не ядовит;
- не летуч;
- без запаха;
- не светится;
- взаимодействует с кислоро –
дом только при поджигании;
переходит в черный фосфор.

Черный фосфор
Черный фосфор- полимерное вещество с металлическим блеском, похож на графит . Имеет атомную кристаллическую решетку.
- образуется из белого при высоком давлении;
- обладает полупроводниковыми свойствами;
- без запаха;
- жирный на ощупь;
- нерастворим в воде и в органических растворителях; не ядовит; не светится
- нерастворим в воде и в органических растворителях; не ядовит; не светится
- нерастворим в воде и в органических растворителях; не ядовит; не светится
- нерастворим в воде и в органических растворителях;
- не ядовит;
- не светится
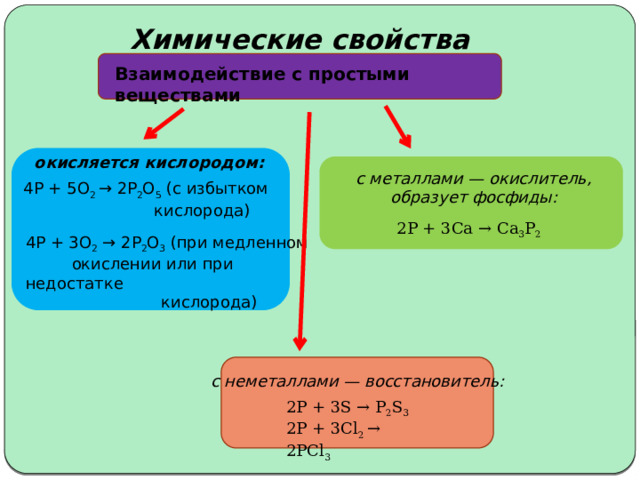
Химические свойства
Взаимодействие с простыми веществами
окисляется кислородом:
с металлами — окислитель, образует фосфиды:
4P + 5O 2 → 2P 2 O 5 (с избытком
кислорода)
2P + 3Ca → Ca 3 P 2
4P + 3O 2 → 2P 2 O 3 (при медленном
окислении или при недостатке
кислорода)
с неметаллами — восстановитель:
2P + 3S → P 2 S 3
2P + 3Cl 2 → 2PCl 3
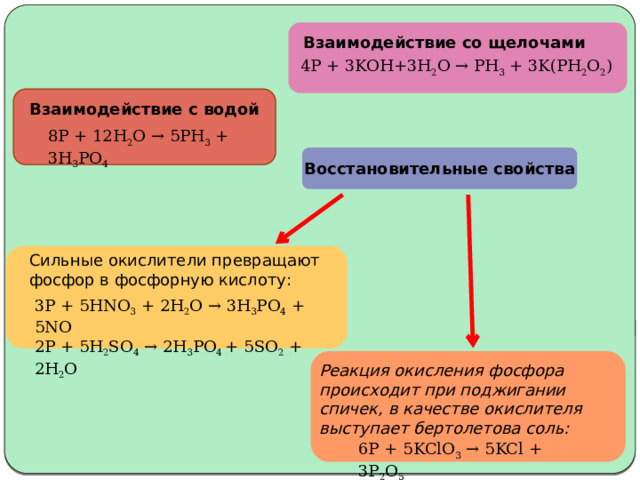
Взаимодействие со щелочами
4P + 3KOH+3H 2 O → PH 3 + 3K(PH 2 O 2 )
Взаимодействие с водой
8P + 12H 2 O → 5PH 3 + 3H 3 PO 4
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
3P + 5HNO 3 + 2H 2 O → 3H 3 PO 4 + 5NO
2P + 5H 2 SO 4 → 2H 3 PO 4 + 5SO 2 + 2H 2 O
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
6P + 5KClO 3 → 5KCl + 3P 2 O 5
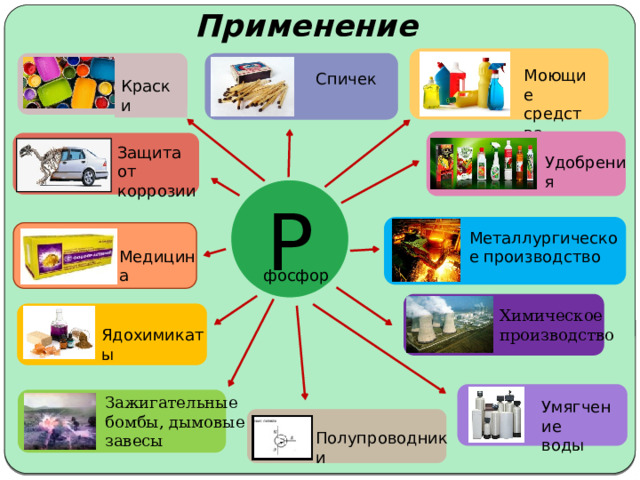
Применение
Моющие средства
Спичек
Краски
Защита от
коррозии
Удобрения
P
Металлургическое производство
Медицина
фосфор
Химическое
производство
Ядохимикаты
Зажигательные
бомбы, дымовые
завесы
Умягчение
воды
Полупроводники





































