МКОУ «Кужникская СОШ» с.Кужник
Решение задач на расчеты по уравнениям реакций
(мастер-класс)
Составил: учитель химии и биологии
Махмудов А. М.
2020 год
Данная разработка предназначена для использования на уроках химии 8-11 классов, на факультативных и кружковых занятиях по химии, а также при подготовке к ОГЭ и ЕГЭ.
Решение задач на расчеты по уравнениям реакций позволяет контролировать усвоение теоретического материала по химии. Решение задач развивает:
- навыки по составлению химических формул, уравнений реакций;
- навыки по преобразованию формул и физических величин;
- способность логически мыслить;
- знание химической терминологии и понимание сущности описанных в задаче процессов.
При решении расчетных задач учащиеся научатся:
- решению различных типов задач;
- решению усложненных задач;
- разным методам решения;
- составлению плана решения;
- оценке правильности полученных результатов;
- самостоятельному составлению химических задач и объяснению их решения.
Основные типы расчетных задач.
Нахождение массы (количества) вещества по известной массе (количеству) другого.
Нахождение объема (массы, количества) одного вещества по известному объему (массе, количеству) другого.
Расчеты на объемные отношения газов в химических реакциях.
Расчеты по термохимическим уравнениям.
Расчеты по уравнениям с использованием понятия доля.
Задачи с использованием понятия «Выход продукта реакции».
Расчеты по уравнениям, если одно из веществ дано в избытке.
Расчеты по уравнениям последовательно протекающих реакций.
Задачи на смеси веществ.
Задачи с образованием кислой соли.
Задачи на смеси веществ, в случае параллельно протекающих реакций.
Нахождение массы (количества) вещества по известной массе (количеству) другого.
Какое количество вещества и масса оксида фосфора (V) получится при сгорании фосфора массой 6,2 г.
Можно решать методом пропорций и через количество вещества.
| Дано: m (P) = 6.2 г ν (P2О5 ) - ? m (P2О5 ) - ? | Решение. 1.Запишем уравнение реакции; подчеркнем что знаем, и что необходимо найти: 4P + 5O2 = 2P2О5 2.Найдем количество известного вещества: ν (P) = 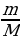 = =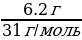 = 0,2 моль = 0,2 моль 3.Запишем количества под формулами, делаем вывод о том, что количество вещества P2О5 в 2 раза меньше, чем количество вещества P и находим его количество: 4P + 5O2 = 2P2О5 0,2 моль 0,1 моль 4.Рассчитываем массу P2О5: m (P2О5 ) = ν•М = 0,1 моль • 142 г/моль = 14,2 г 5.Запишем ответ: ν (P2О5) = 0,1 моль m (P2О5) = 14,2 г
|
Железные опилки массой 5,6 г поместили в раствор, содержащий соответствующее количество вещества сульфата меди (II). Вычислите количество вещества и массу выделившейся по окончании реакции меди.
Ответ: ν(Сu) = 0.1 моль
m (Сu) = 6.4 г
Нахождение объема (массы, количества) одного вещества по известному объему (массе, количеству) другого.
Какое количество вещества и объем водорода (н. у.) выделится при взаимодействии 1,08 г алюминия с достаточным объемом соляной кислоты?
| Дано: m (Al) = 10,8 г ν (H2 ) - ? V (H2 ) - ? | Решение. 1.Запишем уравнение реакции; подчеркиваем что знаем, и что необходимо найти: 2Al + 6HCl = 2AlCl3 + 3H2 2.Найдем количество известного вещества: ν (Al) = 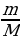 = =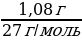 =0,04 моль =0,04 моль 3.Запишем количества под формулами, делаем вывод о том, что количество вещества H2 в 1.5 раза больше, чем количество вещества Al, и находим его количество: 2Al + 6HCl = 2AlCl3 + 3H2 0,04 моль 0,06 моль 4.Рассчитаем объем H2: V (H2 ) = ν•Vm = 0,06 моль • 22,4 л/моль = 1,344 л 5.Ответ: ν (H2 ) = 0,06 моль V (H2 ) = 1,344 л |
Гранулы цинка массой 13 г поместили в раствор серной кислоты. Какой объем водорода (н. у.) выделится после полного растворения данной массы цинка?
Ответ: V (H2 ) = 4,48 л
Расчеты на объемные отношения газов в химических реакциях.
200 л водорода сожгли в атмосфере хлора. Какой объем хлороводорода при этом получится? Все объемы приведены к н. у.
Такие задачи легче решать методом пропорций.
| Дано: V (H2 ) = 200 л V (HCl ) - ? | Решение. 1.Запишем уравнение реакции; отметим что знаем, и что необходимо найти: 200 л х л H2 + Cl2 = 2HCl 2.Запишем объемы газов согласно стехиометрическим коэффициентам: 200 л х л H2 + Cl2 = 2HCl 1 л 2 л 3.Составим пропорцию и решим: 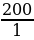 = = 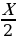 ; Х = ; Х = 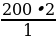 = 400 л = 400 л
4.Запишем ответ: V (HCl) = 400 л |
Найдите объем кислорода и объем воздуха, расходующегося на полное сгорание 100 м3 метана.
Ответ: V (О2 ) = 200 м3
V (воздуха) = 952,4 м3
Расчеты по уравнениям с использованием понятия доля.
Какое количество вещества и массу гидроксида натрия нужно для полной нейтрализации 120 г 6%-ного раствора серной кислоты?
| Дано: mр-ра (H2SO4) = 120 г w (H2SO4) = 6%, или 0,06 ν (NaOH) - ? m (NaOH ) - ?
w = 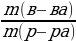 ; ; m (в-ва)= m (р-ра) • w | Решение. 1.Запишем уравнение реакции; подчеркнем что знаем, и что необходимо найти: 2NaOH + H2SO4 = Na2SO4 + 2H2O 2.Находим количество известного вещества: ν (H2SO4) = 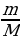 = =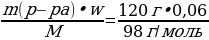 =0,0735 моль =0,0735 моль 3.Запишем количества под формулами, делаем вывод о том, что количество вещества NaOH в 2 раза больше, чем количество вещества H2SO4, и находим его количество: 2NaOH + H2SO4 = Na2SO4 + 2H2O 0,147 моль 0,0735 моль 4.Рассчитаем массу NaOH: m (NaOH ) = ν • М = 0,147 моль • 40 г/моль = 5,88 г 5.Ответ: ν (NaOH) = 0,147 моль m (NaOH ) = 5,88 г |
Какую массу гидроксида калия необходимо взять для нейтрализации 80 мл 30% - ной азотной кислоты плотностью 1,18 г/мл?
Ответ: m(KOH) = 17,98 г
Задачи с использованием понятия «Выход продукта реакции».
На получение 450 л хлороводорода (н. у.) было из расходовано 250 л хлора. Вычислите выход хлороводорода по сравнению с теоретическим.
| Дано: V (Cl2) = 250 л Vпрак (HCl) = 450 л φвых (HCl ) - ?
φвых = 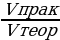 | Решение. 1.Находим по уравнению реакции Vтеор: 250 л х H2 + Cl2 = 2HCl 1 л 2 л 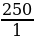 = = 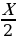 ; Х = ; Х = 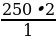 = 500 л = 500 л
2.Рассчитаем объемную долю выхода HCl φвых = 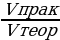 = = 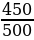 = 0,9, или 90% = 0,9, или 90% 3.Ответ: φвых (HCl ) = 90% |
Окислением 140 м3 (н. у.) этилена кислородом (процесс Вакера), было получено 200 кг ацетальдегида. Рассчитайте выход ацетальдегида по сравнению с теоретически возможным.
Ответ: ηвых = 72,7%
Расчеты по уравнениям, если одно из веществ дано в избытке.
Гидроксид натрия массой 8 г добавили к 50 г 5% - й соляной кислоты.
1)Найдите количество вещества и массу образовавшейся соли.
2)Рассчитайте массовую долю соли в образовавшемся растворе.
| Дано: m (NaОН) = 8 г mр-ра (HCl) = 50 г w (HCl) = 5%, или 0,05 ν (NaCl) - ? m (NaCl) - ? w (NaCl) - ?
w = 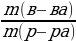 ; ; m (в-ва)= m (р-ра) • w | Решение. 1.Запишем уравнение реакции; NaOH + HCl = NaCl + H2O 2.Найдемм количества веществ, массы которых даны: ν (NaОН) = 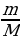 = = 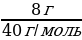 = 0,2 моль = 0,2 моль ν (HCl) = 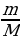 = =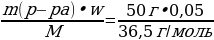 = 0,0685 моль = 0,0685 моль 3.По уравнению реакции делаем вывод о том, что количество вещества NaOH дано в избытке, и записываем количество вещества HCl под формулой в уравнении: NaOH + HCl = NaCl + H2O 0,0685 моль 4.Делаем вывод о том, ν (NaCl) равно ν (НCl) NaOH + HCl = NaCl + H2O 0,0685 моль 0,0685 моль
5.Рассчитаем массу NaCl: m (NaCl) = ν • М = 0,0685 моль • 58,5 г/моль = 4 г 6.Найдем массовую долю NaCl в образовавшемся растворе, предварительно рассчитав массу этого раствора m (р-ра) = 50 + 8 = 58 г w (NaCl) = 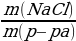 = = 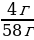 = 0,069, или 6,9% = 0,069, или 6,9% 7. Ответ: ν (NaCl) = 0,0685 моль m (NaCl) = 4 г w (NaCl) = 6,9% |
30 г 7% - ного раствора гидроксида калия смешали с 40 г 6%-ного раствора азотной кислоты.
1)Найдите массу образовавшейся соли. Ответ:m (KNO3) = 3.85 г
2)Вычислите массовую долю соли в полученном растворе. w (KNO3) = 5.5%
Расчеты по уравнениям последовательно протекающих реакций.
Хлор, полученный взаимодействием 30 мл 36%-ной соляной кислоты (плотностью 1,18 г/мл) с необходимым количеством оксида марганца (IV), пропустили через избыток раствора иодида калия. Вычислите массу иода, способного выделиться при этом.
| Дано: Vр-ра (HCl) = 30 мл w (HCl) = 36%, или 0,36 ρ = 1,18 г/мл m (I2 ) - ?
w = 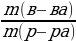 ; ; m (в-ва)= m (р-ра) • w ρ = 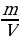 ; ; m = ρ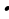 V V | Решение. 1.Записываем уравнения реакций, описанных в условии задачи; подчеркиваем что знаем, и что необходимо найти: 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
Cl2 + 2KI = 2KCl + I2
2.Находим количество известного нам вещества: ν (HCl) = 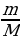 = =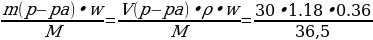 = = = 0,35 моль 3.По уравнению (1) делаем вывод о том, что количество вещества Cl2 в 4 раза меньше, чем количество вещества HCl, и находим его количество: 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O 0,35моль 0,0873 моль 4.Делаем переход на уравнение (2) и вывод о количестве вещества I2: Cl2 + 2KI = 2KCl + I2 0,0873 моль 0,0873 моль 5.Находим массу I2: m (I2 ) = ν • М = 0,0873 моль • 254 г/моль = 22,17 г 6. Ответ: m (I2 ) = 22,17 г |
Газ, полученный взаимодействием перманганата калия с концентрированной соляной кислотой, пропустили через раствор иодида калия. Какую минимальную массу перманганата калия нужно израсходовать в ходе этих реакций, для выделения 25,4 г иода?
Ответ: m (KMnO4) = 6,32 г
Задачи на смеси веществ.
Смесь железа и алюминия массой 5 г обработали раствором гидроксида натрия, при этом выделилось 3,36 л газа (н. у.). Рассчитайте массовые доли элементов в исходной смеси.
| Дано: mсмеси (Al и Fe) = 5 г V (H2) = 3.36 л w (Al) - ? w (Fe) - ?
| Решение. 1.Составим уравнение реакции. В данном случае одно из веществ в смеси не реагирует, это Fe, а весь выделившийся водород – в реакции с алюминием: 2Al + 2NaOH + 6H2O = 2 Na[Al(OH)4] + 3H2 2.Находим количество вещества водорода: ν (H2) = 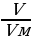 = = 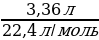 = 0,15 моль = 0,15 моль 3.По уравнению реакции находим количество вещества алюминия, зная, что он в 1,5 раз меньше количества H2: 2Al + 2NaOH + 6H2O = 2 Na[Al(OH)4] + 3H2 0,1 моль 0,15 моль 4.Вычислим массу алюминия и массовые доли металлов в смеси: m (Al) = ν • М = 0,1моль • 27 г/моль = 2,7 г w (Al) = 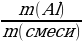 = = 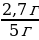 = 0,54, или 54% = 0,54, или 54% w (Fe) = 100 – 54 = 46% |
Медно-цинковый сплав массой 7 г поместили в соляную кислоту. В ходе этой реакции выделилось 1,12 л газа (н. у.). Вычислите массовые доли металлов в исходном образце сплава.
Ответ: w (Zn) = 46.4%, w (Cu) = 53.6%
Задачи с образованием кислой соли.
Раствор гидроксида калия, массой 112 г и массовой долей 10%, прилили к 49,5 мл 18%-ного раствора фосфорной кислоты, плотностью 1,1 г/мл.
1)Вычислите количество вещества и массу получившейся соли.
2)Какова массовая доля соли в получившемся растворе?
| Дано: mр-ра (КОН) = 112 г w (КОН) = 10%, или 0,1 Vр-ра (H3PO4) = 49.5 мл w (H3PO4) = 18%, или 0,18 ρ = 1,1 г/мл m (соли) - ? w (соли) - ?
| Решение. 1.С многоосновной кислотой возможно образование разных солей – средней и кислых, поэтому нужно сначала рассчитать, в каких отношения взяты кислота и соль. ν (КОН) = 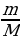 = =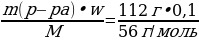 = 0,2 моль = 0,2 моль ν (H3PO4) = 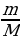 = =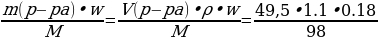 = = = 0,1 моль 2.Исходя из найденных количеств, составляем уравнение реакции и делаем вывод о количестве полученной соли: 2КОН + H3PO4 = К2HPO4 + 2Н2О 0,1 моль 0,1 моль 3.Вычислим массу гидрофосфата: m (К2HPO4) = ν • М = 0,1моль • 174 г/моль = 17,4 г
4.Найдем массовую долю К2HPO4 в получившемся растворе: mр-ра = 112 + 49,5 • 1,1 = 166,5 г w (К2HPO4) = 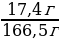 = 0,1045, или 10,45% = 0,1045, или 10,45%
5.Запишем ответ: m (К2HPO4) = 17,4 г w (К2HPO4) = 10,45% |
58. 196 мл раствора фосфорной кислоты с массовой долей 0,2 и плотностью 1,25 г/мл прореагировал с 400 г 5%-ного раствора гидроксида натрия.
1)Найдите количество вещества и массу образовавшейся соли.
2)Вычислите массовую долю соли в полученном растворе.
Ответ: m (КH2PO4) = 48,5 г; w (КH2PO4) = 7,76%
Задачи на смеси веществ, в случае параллельно протекающих реакций.
Сплав цинка и алюминия массой 4 г обработали избытком раствора гидроксида натрия. В этой реакции выделилось 3,808 л водорода (н.у.). Вычислите массовые доли элементов в данном сплаве.
| Дано: mсмеси (и Al) = 4 г V (H2) = 3.808 л w (Zn) - ? w (Al) - ?
| Решение. 1.Запишем уравнения протекающих реакций: Zn+ 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
2.Находим количество вещества водорода: ν (H2) = 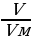 = = 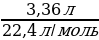 = 0,15 моль = 0,15 моль 3.По уравнению реакции находим количество вещества алюминия, зная, что он в 1,5 раз меньше количества H2: 2Al + 2NaOH + 6H2O = 2 Na[Al(OH)4] + 3H2 0,1 моль 0,15 моль 4.Вычислим массу алюминия и массовые доли металлов в смеси: m (Al) = ν • М = 0,1моль • 27 г/моль = 2,7 г w (Al) = 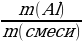 = = 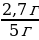 = 0,54, или 54% = 0,54, или 54% w (Fe) = 100 – 54 = 46% |
Смесь стружек магния и цинка массой 5,56 г растворили в избытке соляной кислоты. Рассчитайте массовые доли металлов в смеси, если в этой реакции было получено 3,36 л газа (н.у.).
Ответ: w (Mg) = 44%; w (Zn) = 56%







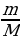 =
=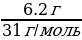 = 0,2 моль
= 0,2 моль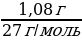 =0,04 моль
=0,04 моль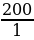 =
= 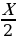 ; Х =
; Х = 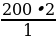 = 400 л
= 400 л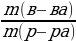 ;
;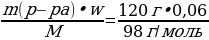 =0,0735 моль
=0,0735 моль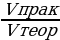
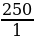 =
= 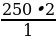 = 500 л
= 500 л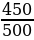 = 0,9, или 90%
= 0,9, или 90%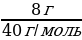 = 0,2 моль
= 0,2 моль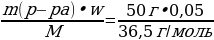 = 0,0685 моль
= 0,0685 моль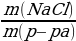 =
= 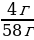 = 0,069, или 6,9%
= 0,069, или 6,9%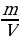 ;
; V
V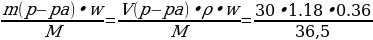 =
=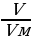 =
= 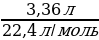 = 0,15 моль
= 0,15 моль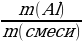 =
= 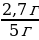 = 0,54, или 54%
= 0,54, или 54%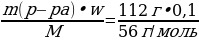 = 0,2 моль
= 0,2 моль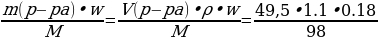 =
=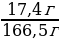 = 0,1045, или 10,45%
= 0,1045, или 10,45%
















