Дисциплина: Химия
Курс 1 Специальности: Технология продукции общественного питания
Лекция №____
Химические связи
План
Понятие о химической связи (сам. работа по Б-4)
Понятие электроотрицательности (беседа, объяснение преподавателя)
Ковалентная связь (объяснение преподавателя, работа по Б-4)
Ионная связь (объяснение преподавателя, работа по Б-4)
Металлическая связь (сам. работа по Б-4, объяснение преподавателя)
Водородная связь (сам. работа по Б-4, объяснение преподавателя)
Типы кристаллических решеток(объяснение преподавателя, работа по
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа. Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная и металлическая.
Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи. Самый электроотрицательный элемент - фтор, самый электроположительный - франций.

ряд электроотрицательностей
Относительные электроотрицательности элементов (по Полингу)
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
| H• + •H H : H | | 
| | 
|
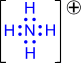
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
| 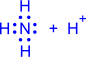
| | 
|
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной. Неполярная ковалентная связь возникает между атомами с одинаковой электроотрицательностью (ЭО) (H2, O2, N2 и т. д.). В этом случае центр общей электронной плотности находится на одинаковом расстоянии от ядер обоих атомов. По числу общих электронных пар (т.е. по кратности) различают одинарные, двойные и тройные ковалентные связи. Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется одинарной. Если между двумя атомами возникают две или три общие электронные пары, образуются кратные связи – двойные и тройные. Двойная связь состоит из одной  -связи и одной
-связи и одной  -связи. Тройная связь состоит из одной
-связи. Тройная связь состоит из одной  -связи и двух
-связи и двух  -связей.
-связей.
Ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов, называются  -связями.
-связями.
В образовании  -связей могут участвовать s- и s-электроны (Н2),
-связей могут участвовать s- и s-электроны (Н2),

s- и p-электроны (HCl),

р- и р-электроны (Cl2)

Кроме того,  -связи могут образовываться за счет перекрывания «чистых» и гибридных орбиталей.
-связи могут образовываться за счет перекрывания «чистых» и гибридных орбиталей.
Ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов, называются  -связями.
-связями.
В образовании  -связей могут участвовать только р- и d-электроны.
-связей могут участвовать только р- и d-электроны.

Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных связях:
Ниже линиями показаны химические связи в молекулах водорода, кислорода и азота:

где пары точек (:) – спаренные электроны; «крестики» (х) – неспаренные электроны.
| 
| | 
| (или NN) – тройная связь |
Если ковалентная связь образуется между атомами с различной ЭО, то центр общей электронной плотности смещен в сторону атома с большей ЭО. В этом случае имеет место ковалентная полярная связь. Двухатомная молекула, связанная ковалентной полярной связью, представляет собой диполь – электронейтральную систему, в которой центры положительного и отрицательного зарядов находятся на определенном расстоянии друг от друга.
Графический вид химических связей в молекулах хлороводорода и воды следующий:
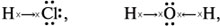
где стрелками показано смещение общей электронной плотности.
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Ковалентная связь – это химическая связь, осуществляемая за счет обобществления электронных пар. Теорию ковалентной связи предложил в 1916 г. американский ученый Гилберт Льюис. За счет ковалентной связи образуется большинство молекул, молекулярных ионов, свободных радикалов и атомных кристаллических решеток. Ковалентная связь характеризуется длиной (расстояние между атомами), направленностью (определенная пространственная ориентация электронных облаков при образовании химической связи), насыщаемостью (способность атомов образовывать определенное число ковалентных связей), энергией (количество энергии, которое необходимо затратить для разрыва химической связи).
Ионная связь.
Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
| 
| | 
|
(фторид натрия состоит из ионов натрия Na+ и фторид-ионов F-)
Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью.
Как уже подчеркивалось выше, способность того или иного атома образовывать ионную связь характеризуют понятием степени окисления элемента.
Степень окисления — условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер.
Это означает, что более электроотрицательный атом, смещая к себе полностью одну электронную пару, приобретает заряд l-. Неполярная ковалентная связь между одинаковыми атомами дает вклад в степень окисления:
При пользовании степенями окисления полезно придерживаться следующих правил:
1) сумма степеней окисления атомов в любой частице равна ее электрическому заряду. Следовательно, степень окисления элемента в его простом веществе равна нулю;
2) в соединениях фтор всегда проявляет степень окисления -1;
3) степень окисления кислорода в соединениях обычно равна -2 (кроме ОF2, Н2О2 и др.);
4) степень окисления водорода равна +1 в соединениях с неметаллами и -1 в соединениях с металлами (КН, СаН2).
Максимальная положительная степень окисления элемента обычно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления - минус восемь.
Исключение составляют фтор, кислород, железо: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе.
Понятие степени окисления введено в предположении о полном смещении пар электронов к тому или другому атому (показывая при этом заряд ионов, образующих ионное соединение). Поэтому следует помнить, что в полярных соединениях степень окисления означает число электронов, лишь смещенных от данного атома к атому, связанному с ним.
Совсем формальным понятие степени окисления становится, когда оно используется при рассмотрении ковалентного соединения.
Различие между понятием степени окисления и валентности в ковалентных соединениях наглядно можно проиллюстрировать на хлорпроизводных метана: валентность углерода везде равна четырем, а степень окисления его (считая степени окисления водорода + 1 и хлора -1 во всех соединениях) в каждом соединении разная:
-4 -2 0 +2 +4
CH4 CH3Cl CH2Cl2 CHCl3 CCl4
Металлическая связь.
Атомы большинства металлов содержат на внешнем энергетическом уровне (от 1 до 3) электронов. Эти электроны легко (отрываются), и атомы при этом превращаются (в положительно заряженные ионы- катионы). Оторвавшиеся электроны (беспорядочно движутся) от одного (атома или катиона) к другому, связывая их вместе. При присоединении электронов к иону временно образуются (атомы), а затем электроны снова отрываются от атома, и он снова превращается в (катионы). В куске металла существуют все время то (атомы), то (катионы). Их так и называют «атом-ионы». Связь в металлах между («атом-ионами») посредством (большого количества не связанных с ядрами подвижных электронов) называется (металлической связью).
Водородная связь. Водородная связь - это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь возникает между молекулами, в состав которых входит водород и атомы с высокой ЭО (кислород, фтор, азот). Ковалентные связи H–O, H–F, H–N являются сильно полярными, за счет чего на атоме водорода скапливается избыточный положительный заряд, а на противоположных полюсах – избыточный отрицательный заряд. Между разноименно заряженными полюсами возникают силы электростатического притяжения – водородные связи. Водородные связи могут быть как межмолекулярными, так и внутримолекулярными. Энергия водородной связи примерно в десять раз меньше энергии обычной ковалентной связи, но тем не менее водородные связи играют большую роль во многих физико-химических и биологических процессах. В частности, молекулы ДНК представляют собой двойные спирали, в которых две цепи нуклеотидов связаны между собой водородными связями.

Межмолекулярные водородные связи между молекулами воды и фтороводорода можно изобразить (точками) следующим образом:

Вещества с водородной связью имеют молекулярные кристаллические решетки. Наличие водородной связи приводит к образованию ассоциатов молекул и, как следствие, к повышению температур плавления и кипения.
Кристаллические решетки. Различные виды химической связи обусловливают существование различных типов кристаллических решеток.
Вещества, состоящие из молекул, имеют молекулярное строение. К таким веществам относятся все газы, жидкости, а также твердые вещества с молекулярной кристаллической решеткой, например йод. Твердые вещества с атомной, ионной или металлической решеткой имеют немолекулярное строение, в них нет молекул. Кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
К ристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изобра жают, как показано на рис.,
ристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изобра жают, как показано на рис.,
где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
К ристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число угле рода в алмазе.
ристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число угле рода в алмазе.
В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Примерами их являются лед, твердый оксид углерода (IV) ("сухой лед"), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рис . Большинство кристаллических органических соединений имеют молекулярную решетку.
| Особенность кристаллической решетки | Тип кристаллической решетки |
| Молекулярная | Ионная | Атомная | Металлическая |
| Частицы в узлах решетки | Молекулы | Kатионы и анионы | Атомы | Kатионы и атомы металлов |
| Характер связи между частицами | Силы межмолекулярного взаимодействия (в том числе водородные связи) | Ионные связи | Kовалентные связи | Металлическая связь |
| Прочность связи | Слабая | Прочная | Очень прочная | Разной прочности |
| Отличительные физические свойства веществ | Легкоплавкие или возгоняющиеся, небольшой твердости, многие растворимы в воде | Тугоплавкие, твердые, многие растворимы в воде. Растворы и расплавы проводят электрический ток | Очень тугоплавкие, очень твердые, практически нерастворимы в воде | Высокая электро- и теплопроводность, металлический блеск |
| Примеры веществ | Йод, вода, сухой лед | Хлорид натрия, гидроксид калия, нитрат бария | Алмаз, кремний, бор, германий | Медь, калий, цинк, железо |
|
|
|
|
|
|
|
|
| 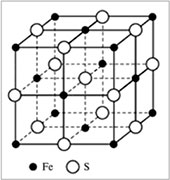 ная кристаллическая решетка сульфида железа FeS ная кристаллическая решетка сульфида железа FeS
|
|
|
|
|

| Молекулярная кристаллическая решетка
йода I2 |
Контрольные вопросы:
Что такое химическая связь?
(Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы)
Какие виды связи вам известны?
(Ковалентная, ионная, металлическая, водородная)
Что такое электроотрицательность? Как она изменяется в периодах и группах?
(Это способность атомов атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.В периодах слева направо она увеличивается, а в группах сверху вниз уменьшается)
Дайте определение ковалентной связи.
От чего зависит полярность связи?
Между какими элементами образуется ковалентная связь?
Какие механизмы образования ковалентной связи вы знаете?
Что называется степенью окисления?
Что такое ионы? Катионы? Анионы?
Дайте определение ионной связи.
Контрольные вопросы:
Тест по теме «Химическая связь. Строение вещества»
1. Сколько электронов участвует в образовании химических связей в молекуле аммиака?
а) 2; б) 6; в) 8; г) 10.
2. Для твердых веществ с ионной кристаллической решеткой характерна низкая:
а) температура плавления; б) энергия связи;
в) растворимость в воде; г) летучесть.
3. Расположите приведенные ниже вещества в порядке возрастания полярности ковалентных связей. В ответе укажите последовательность букв.
а) S8; б) SO2; в) H2S; г) SF6.
4. Какие частицы образуют кристалл нитрата натрия?
а) Атомы Na, N, O; б) ионы Na+, N5+, O2–;
в) молекулы NaNO3; г) ионы Na+, NO3–.
5. Укажите вещества, которые в твердом состоянии имеют атомные кристаллические решетки:
а) алмаз; б) хлор;
в) оксид кремния(IV); г) оксид кальция.
6. Укажите молекулу с наибольшей энергией связи:
а) фтороводород; б) хлороводород;
в) бромоводород; г) йодоводород.
7. Выберите пары веществ, все связи в которых ковалентные:
а) NaCl, HCl; б) CO2, NO;
в) CH3Cl, CH3K; г) SO2, NO2.
8. В каком ряду молекулы расположены в порядке увеличения полярности связей?
а) HBr, HCl, HF; б) NH3, PH3, AsH3;
в) H2Se, H2S, H2O; г) CO2, CS2, CSe2.
9. Вещество, в молекулах которого имеются кратные связи, – это:
а) углекислый газ; б) хлор;
в) вода; г) этанол.
10. На какое физическое свойство образование межмолекулярных водородных связей не оказывает влияния?
а) электропроводность;
б) плотность;
в) температура кипения;
г) температура плавления.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| б | г | а, б, в, г | г | а, в | а | б, г | а, в | а | а |
Используемая литература:
Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с.








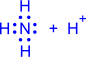





 ристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изобра жают, как показано на рис.,
ристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изобра жают, как показано на рис., ристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число угле рода в алмазе.
ристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число угле рода в алмазе. ная кристаллическая решетка сульфида железа FeS
ная кристаллическая решетка сульфида железа FeS

















