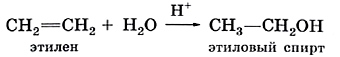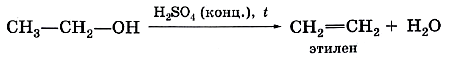Дисциплина/МДК: ОДБ.12 Химия
Специальность: 08.02.01 СЭЗС
Курс, группа: 11 группа
Преподаватель: Покотило Яна Валентиновна
Обратная связь: (электронная почта)
Дата занятия: 20.10.2022
Занятие № 7
Инструкция для обучающегося:
изучить теоретический материал;
выполнить задания контрольно-оценочного блока;
составить опорный конспект и ответить на вопросы для самоконтроля;
срок выполнения работы до следующего занятия, если не будет замен
Тема занятия СПИРТЫ
Постановка учебной цели.
Цель:
рассмотреть строение и свойства спиртов, как они воздействуют на живые организмы.
Задачи:
составлять структурные формулы спиртов и их изомеров, называть спирты по международной номенклатуре;
составлять уравнения реакций, характерных для спиртов;
характеризовать физиологическое действие метанола и этанола.
На занятии мы узнаем:
мы научимся:
объяснять зависимость свойств спиртов от наличия функциональной группы;
составлять уравнения реакций, характеризующих свойства спиртов;
мы сможем:
Мотивация. Сегодняшнее занятие хочу начать с высказывания французского писателя Анатоля Франса: «Чтобы переваривать знания, надо поглощать их с аппетитом».
Поэтому, на нашем занятии, в процессе поглощения новых знаний, я всем желаю «Приятного аппетита!»
Актуализация (создание предпосылок к восприятию учебного материала). С новым классом органических соединений Вы поверхностно знакомились на занятиях химии в 9 классе. Кроме того, Вы встречались с этим классом соединений на занятиях биологии при изучении темы «гликолиз».
Растворы, содержащие углеводы (например, глюкозу) под действием особых веществ природного происхождения – ферментов превращаются в эти вещества. Такой процесс называют спиртовым брожением.
Есть данные, что в древности арабский алхимик, нагревая в реторте без доступа воздуха дерево, получил жидкость, отведал её и ослеп. Что это за вещество и о чем сегодня пойдет речь, Вы сможете узнать, если отгадаете основное слово в кроссворде.
Изучение нового материала
План лекции.
Одноатомные спирты
Этиловый спирт и его действие на организм
Гомологический ряд предельных одноатомных спиртов
Номенклатура и изомерия спиртов
Физические свойства спиртов
Способы получения спиртов
Химические свойства спиртов
Применение спиртов
Рекомендуемые источники
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, 2014г. 268с.
Конспект лекции
Глоссарий
Алканолы – класс предельных одноатомных спиртов.
Алкоголяты – производные спиртов и металлов.
Водородная связь образуется между атомами водорода одной молекулы и атомами очень электроотрицательных элементов другой молекулы. (F,O,N,Cl). Водородная связь – это особый вид межмолекулярной связи, которая слабее обычной ковалентной связи в 10-20 раз, но она оказывает большое влияние на физические свойства соединений.
Дегидратация – реакция, идущая с отщеплением молекул воды от органических соединений.
Спирты – производные предельных углеводородов, в которых один или несколько атомов водорода замещен на гидроксогруппу.
Этерификация – реакция образования сложных эфиров из спиртов и кислот.
Изготавливать алкогольные напитки люди научились ещё до нашей эры. С давних времён способ получения вин сбраживанием фруктовых соков дошёл до наших дней.
Дурманящий компонент алкогольных напитков впервые был выделен алхимиками только в XI в. и получил название aqua vitae — жизненная вода. Вскоре за ним закрепилось название винный спирт. Употребление алкоголя нашими предками преследовало практическую цель: за счёт вина, разбавленного водой, или пива организм получал до 25 % энергии. До сих пор можно услышать, как пиво за его калорийность называют жидким хлебом.
Коварство алкогольных напитков заключается в том, что они очень быстро вызывают привыкание, а их токсическое действие на организм проявляется не сразу. Однозначно доказано, что любое, даже незначительное, употребление алкоголя вредит здоровью человека. При попадании винного спирта в организм происходят психические и неврологические изменения, снижаются острота мышления и чёткость восприятия, формируется неадекватное поведение. Кроме этого, под действием алкоголя происходит обезвоживание организма, кровеносные сосуды расширяются, усиливается ток крови в капиллярах, в результате чего появляется ощущение тепла и покраснение кожи. В больших количествах алкоголь приводит к тяжёлым отравлениям и гибели клеток печени.
Химическое название винного спирта вам уже знакомо: этиловый спирт, или этанол. Его химическая формула С2Н5ОН. Его молекулы содержат функциональную гидроксильную группу —ОН.
| Функциональная группа — атом или группа атомов, которые определяют наиболее характерные свойства вещества и его принадлежность к определённому классу соединений. |
Гомологический ряд предельных одноатомных спиртов Этиловый спирт относится к одному из классов кислородсодержащих органических соединений — спиртам.
| Спирты — органические вещества, в молекулах которых углеводородный радикал связан с гидроксильной группой —ОН. |
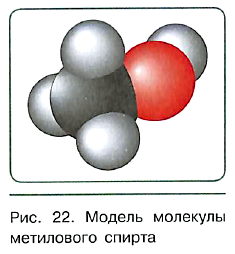
В молекуле этилового спирта содержится одна гидроксильная группа, связанная с остатком предельного углеводорода — этильным радикалом. Именно поэтому этиловый спирт относится к гомологическому ряду предельных одноатомных спиртов. Их состав соответствует общей формуле CnH2n+1OH.
Этиловый спирт, содержащий в молекуле два углеродных атома, является вторым представителем предельных одноатомных спиртов. Родоначальник гомологического ряда — метиловый спирт СН3ОН.
Химические формулы и названия первых представителей гомологического ряда предельных одноатомных спиртов приведены в таблице.
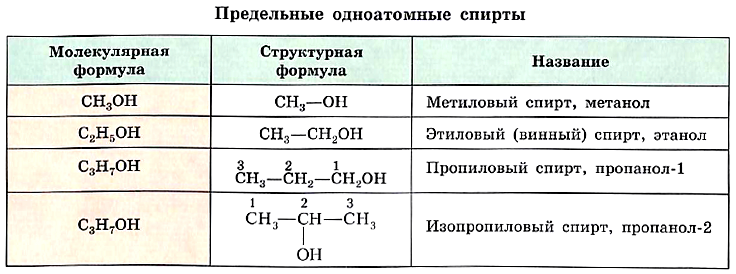
Номенклатура и изомерия спиртов По международной номенклатуре названия спиртов образуют от названия соответствующего алкана с добавлением суффикса -ол, указывающего на принадлежность вещества к данному классу органических соединений. Обратите внимание, что при составлении названия спиртов углеродные атомы нумеруют с того конца цепи, к которому ближе гидроксильная группа.
Два последних спирта (см. табл.) обладают одной и той же молекулярной формулой С3Н7ОН, а вот химическое строение у них различное. Пропанол-1 и пропанол-2 — это изомеры, различающиеся положением функциональной группы в молекуле. Это ещё один вид структурной изомерии.
Физические свойства спиртов В отличие от углеводородов, гомологические ряды которых начинаются с газообразных веществ, в ряду предельных одноатомных спиртов нет газов. Кроме того, в противоположность углеводородам, практически нерастворимым в воде, спирты с числом углеродных атомов от 1 до 4 смешиваются с водой в любых соотношениях. Оба эти свойства обусловлены способностью спиртов за счёт гидроксильных групп образовывать между молекулами особые связи, которые называют водородными связями.
| Связь между атомом водорода одной молекулы и атомом с высокой электроотрицательностью (фтор, кислород, азот) другой молекулы называют водородной связью. |
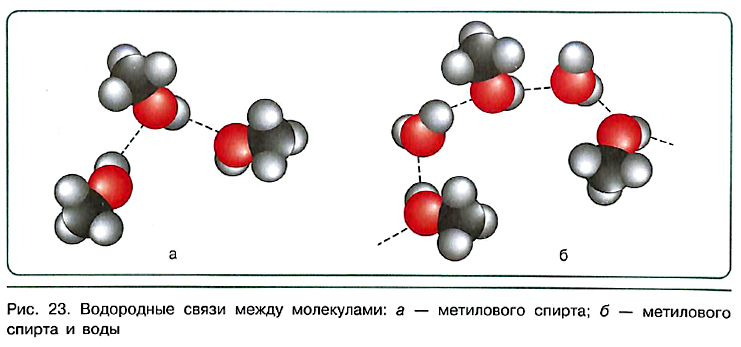
За счёт водородных связей молекулы спиртов ассоциированы в жидкости (рис. 23, а) и хорошо растворимы в воде (рис. 23, б).
Спирты — прекрасные растворители органических веществ.
Способы получения спиртов В промышленности спирты получают присоединением воды к этиленовым углеводородам. Например, в присутствии кислот этилен вступает в реакцию гидратации с образованием этилового спирта: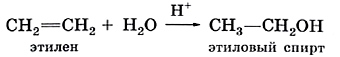
Ввести в молекулу органического вещества гидроксильную группу можно и с помощью реакции замещения. Так, при обработке галогеналканов водным раствором щёлочи атом галогена замещается группой ОН:
Химические свойства спиртов Подобно большинству органических веществ, спирты горят. Пламя, образующееся при горении спиртов с небольшим числом атомов углерода в молекуле, бледно-голубое, практически не коптит, при горении выделяется большое количество теплоты:
С2Н5ОН + 3O2 → 2СO2 + 3Н2O + Q
Горючесть спиртов позволяет использовать их в качестве добавки к автомобильному бензину. В некоторых странах (Бразилия, США, Венесуэла) миллионы автомобилей адаптированы к использованию в качестве топлива чистого этанола.
Окисление спиртов может протекать не только до углекислого газа и воды. Если в качестве окислителя использовать нагретый оксид меди(II), молекула спирта теряет два атома водорода, гидроксильная группа превращается в другую функциональную группу — альдегидную:
Данную реакцию можно использовать для обнаружения спиртов.
https://www.youtube.com/watch?v=VKZvvFM1dW8
От молекулы этилового спирта можно отщепить не только атомы водорода, но и молекулу воды. Дегидратация спиртов — один из способов получения углеводородов этиленового ряда: 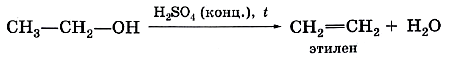
Из курса химии основной школы вам известно, что вода бурно реагирует с активными металлами (щелочными, щелочноземельными) с выделением водорода:
2Н—О—Н + 2Na = 2NaOH + H2↑
По строению молекулы спиртов напоминают молекулы воды, только вместо одного из двух атомов водорода они содержат углеводородный радикал. Как и вода, спирты способны взаимодействовать со щелочными металлами. При этом также выделяется водород и образуется производное спирта, подобное солям: 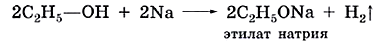
Ещё одно важное свойство спиртов — взаимодействие с карбоновыми кислотами с образованием сложных эфиров: 
Реакцию образования эфира называют реакцией этерификации.
Применение спиртов Область применения спиртов чрезвычайно широка. Метанол используют в качестве сырья для производства формальдегида, уксусной кислоты, пластмасс, лекарственных веществ. В некоторых странах его также используют как добавку к моторному топливу. В нашей стране в этих целях метанол не используют. Он очень ядовит! Уже 5—7 мл метанола, попавшие в организм, вызывают полную потерю зрения в результате поражения сетчатки глаза, а 30 мл и более могут привести к летальному исходу.
Этиловый спирт благодаря своей растворяющей способности используют в качестве растворителя лаков и красок. Также его применяют как компонент моющих жидкостей, в парфюмерной и фармацевтической промышленности. Кроме того, этиловый спирт широко применяют в медицине для дезинфекции, компрессов, обтираний и др.
На основе этилового спирта в промышленности получают десятки органических веществ: сложные эфиры, галогенпроизводные углеводородов, уксусную кислоту. Помимо спиртных напитков, этанол в небольших количествах содержат и продукты, получаемые брожением: кефир (0,1—0,2 %), квас (0,5—1 %), кумыс (до 3 %).
Контрольные вопросы:
1. Кратко охарактеризуйте метанол, этанол, этиленгликоль, глицерин. Где их используют?
2. Метанол начинает гомологический ряд предельных одноатомных спиртов. Запишите молекулярные формулы двух последующих спиртов. Выведите общую формулу предельных одноатомных спиртов.
3. Чем объясняется хорошая растворимость спиртов в вод?
4. Как действуют метанол и этанол на живые организмы?
Домашнее задание.
Учебник стр.98, №5 (б), №7. Выучить конспект
Обратная связь. Высылать конспект и решенное домашнее задание на электронную почту pokotilo.yana@bk.ru или личным сообщением