Урок на тему: «Коррозия металлов».
11 класс
Учитель химии высшей категории
Кушнерёва Оксана Олеговна
МБОУ СОШ №1 г.Гагарин
Цели:
Изучить явление коррозии, опираясь на базовые знания учащихся. Продолжить обучение методам экспериментального исследования. Интегрировать знания учащихся из области физики и химии для анализа полученных экспериментальных данных.
Развивать умения искать пути решения поставленной задачи и практические навыки при проведении эксперимента.
Воспитывать грамотное отношение к использованию научных достижений в практической деятельности человека.
Форма обучения: урок-изучение нового материала.
Методы обучения: самостоятельная работа в группах, проблемный эксперимент, объяснение, «мозговой штурм».
Оборудование для учителя: интерактивная доска, конспект интерактивной доски, железный гвоздь, соляная кислота, дихромат калия.
Оборудование и реактивы для учащихся: раствор HCl 5%, кусочек цинка, медная проволока, штатив для пробирок, пробирка, 3 пронумерованные пробирки с железным гвоздём (1), гвоздями, помещёнными 5 дней назад в воду (2) и раствор электролита (3).
Ход урока.
Перед уроком учащиеся разбиваются на группы по 5-6 человек. В каждой группе выбирается координатор. Координатор определяет вклад каждого участника группы, фиксирует идеи во время «мозгового штурма», оглашает результаты работы своей группы.
Учитель демонстрирует слайды с изображениями изделий, подвергающихся коррозии. Предлагает учащимся ответить на вопрос, о каком явлении сегодня пойдёт речь? Какие вопросы вы можете поставить для себя при изучении этой темы?
Учащиеся формулируют вопросы, учитель дополняет:
Узнать, что такое коррозия?
Как она протекает?
Что ослабляет или усиливает коррозию?
Каковы методы защиты от коррозии?
С какими русскими словами у вас ассоциируется слово «коррозия»? Ржавление, разрушение. Слово коррозия происходит от латинского слова «corrodere» - разъедать. Я думаю вам известно выражение: «Ржа ест железо». Действительно, самым распространённым видом коррозии является ржавление железа. Посмотрите на слайд. На нём записаны уравнения, отражающие процесс коррозии железа.
1) 2Fe + O2 + 2H2O = 2Fe(OH)2
2) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Ответьте на вопрос: с точки зрения изменения степеней окисления, к каким процессам относится коррозия? Учащиеся определяют степени окисления железа и отмечают их изменение:
Fe0 → Fe+2 Fe+2 → Fe+3
Какой процесс происходит с атомами железа? Окисление.
Какое определение можно дать для процесса коррозии?
Учащиеся предполагают, что коррозия – это процесс окисления металла.
Учитель уточняет определение.
Коррозия – это процесс самопроизвольного перехода металла в окисленную форму под действием внешних факторов.
Уточним, какими внешними факторами может вызываться коррозия:
влияние атмосферного воздуха;
погружение в воду или водные растворы;
воздействие агрессивных газов или жидкостей.
Сравним скорость протекания коррозии в различных средах. Учащиеся рассматривают содержимое пробирок на столах. Железные гвозди за 5 дней до начала урока были помещены в воду, раствор электролита (кислоты), 1 гвоздь остался на воздухе. Сделайте вывод, расположив факторы, вызывающие коррозию (влага, воздух, среда электролита), в порядке уменьшения их влияния. (Скорость коррозии выше всего в растворе электролита. Самая низкая скорость – в случае газовой коррозии.)
Если металл разрушается под действием окислителя, передавая электроны непосредственно ему, то такая коррозия называется химической.
Примером химической коррозии и является ржавление железа.
Перенесите уравнения химической коррозии железа в тетрадь, составьте электронные схемы процесса окисления железа.
В дальнейшем гидроксид железа (III) переходит в гидратную форму Fe2O3 * nH2O и осаждается на поверхности металла в виде чешуек ржавчины. Интересно, что этот гидратированный оксид является автокатализатором коррозии.
Кроме химической, существует ещё одна разновидность коррозии – электрохимическая. Чтобы выяснить её сущность, проделаем опыт.
К кусочку цинка добавьте раствор соляной кислоты. Что наблюдаете? Теперь возьмите медную проволочку и прикоснитесь ей к кусочку цинка. Что наблюдаете? Учащиеся отмечают, что пузырьков водорода стало больше. Они отрываются не только от кусочка цинка, но и от медной проволочки.
Как же так? Ведь всем известно, что медь не взаимодействует с соляной кислотой, поскольку расположена после водорода в ряду напряжений.
Учитель объявляет «мозговой штурм».
Учащиеся выдвигают гипотезы, способные объяснить данное противоречие. Координаторы в группах фиксируют гипотезы. Затем идёт обсуждение гипотез.
Обсуждение различных гипотез можно начать с того, что написать уравнение реакции между цинком и соляной кислотой и рассмотреть его с точки зрения окисления-восстановления.
Zn + 2HCl = ZnCl2 + H2
Zn + 2H+ = Zn2+ + H2
Zn0 -2e → Zn2+
2H+ +2e → H20
Приходим к выводу, что цинк – восстановитель, а ионы водорода – окислители. То есть, электроны с кусочка цинка переходят в раствор, где восстанавливают катионы водорода. Затем мы прикоснулись к цинку медной проволокой. Чем служит медь для электронов?
Учащиеся объясняют, что медь служит проводником электронов от цинка к ионам водорода, поэтому от меди и отрываются пузырьки водорода. Ионы водорода восстанавливаются на поверхности меди электронами, которые отдал цинк.
Данный процесс можно представить в виде схемы (на интерактивной доске):
H2 H2

H+ H+ H+ H+
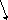

![]()
е е е е
(А) Zn Сu (K)
![]()
Zn2+ HCl
Сделайте вывод, когда возникает электрохимическая коррозия? Какой из металлов, находящихся в контакте разрушается быстрее?
Более активный металл заряжается положительно и выполняет роль анода, а менее активный – отрицательно и выполняет роль катода.
Коррозия приносит огромный вред народному хозяйству. Каждая шестая домна работает лишь для того, чтобы восполнить потери металлов, «съеденных» ржавчиной. Ежегодно в мире теряется более 200 млн. тонн металла. Потери от коррозии в сотни раз превосходят стоимость самого металла, так как они означают напрасный труд людей, создавших конструкцию, и предполагают дополнительный труд по замене проржавевших изделий, потери готовой продукции, загрязнение окружающей среды.
Вспомните, какие методы защиты от коррозии вам известны? Обсудите этот вопрос в группах. После обсуждения учащиеся рассказывают об уже известных им методах защиты от коррозии.
Нанесение защитных покрытий.
Интересно, что некоторые металлы сами защищают себя от коррозии. Например, алюминий образует на своей поверхности прочную оксидную плёнку, плотно прилегающую к поверхности металла.
Электрохимические методы защиты.
Можно наносить на железные изделия покрытия из стойких к коррозии металлов: цинка или олова. Однако при нарушении целостности покрытия в дело вступит электрохимическая коррозия, и активный металл будет быстро разрушаться. Какой металл разрушится быстрее в паре Zn/Fe? Fe/Sn? В ряде случаев к железным изделиям прикрепляют кусочки более активных металлов. Такой способ получил название протекторный способ защиты. Он эффективен для подземных коммуникаций или корпусов судов. Схема на интерактивной доске:
![]()

![]()
![]()
![]()
е



Mg2+
Mg
Fe
 В катодном способе защиты используют источник тока в качестве протектора. Металл становится катодом и это предотвращает его разрушение. Схема на интерактивной доске:
В катодном способе защиты используют источник тока в качестве протектора. Металл становится катодом и это предотвращает его разрушение. Схема на интерактивной доске:

![]()
![]()
![]()
![]() - -- +
- -- +

![]()
![]()
![]()
![]()
Конструкция Земля
Использование ингибиторов коррозии.
Учитель демонстрирует опыт: железный гвоздь активно реагирует с раствором кислоты. Добавляем в реакционную смесь несколько кристалликов дихромата калия, наблюдается прекращение реакции.
В конце урока учитель проводит рефлексию:
Удалось ли нам ответить на поставленные в начале урока вопросы?
Помог ли вам эксперимент разобраться в причинах коррозии?
Какую практическую пользу вы извлекли из данного урока?
Домашнее задание. Выполнить творческое письменное задание: составить текст рекламного объявления, стихотворения, телеграммы по теме занятия.