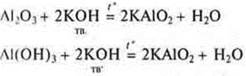Урок №23 22.02.2022
Тема: Оксиды и гидроксиды металлов.
Цели: систематизация знаний учащихся по характеру оксидов и гидроксидов металлов, формирование знаний и умений по определению характера оксида в зависимости от степени окисления металла, его положения в ПСХЭ и радиуса атома и иона.
Задачи урока
Обучающие:
восстановить в памяти понятия об оксидах, обобщить и систематизировать знания учащихся о классификации оксидов;
сформировать знания о закономерности изменения свойств оксидов и гидроксидов металлов зависимости от степени окисления (СО) и положения металла в ПСХЭ.
Развивающие:
развитие образовательных компетенций:
учебно-познавательных: развить умение применять теоретические знания; умение обобщать факты, строить аналогии и делать выводы;
коммуникативных: развитие умения отвечать на поставленный вопрос; организовывать и анализировать собственную деятельность;
развивать способность учащихся к химическому прогнозированию;
Воспитательные:
воспитывать сознательное отношение к учебному труду, развивать чувство ответственности за полученные знания и интерес к знаниям;
закрепить навыки безопасного обращения с реактивами;
продолжать развитие культуры общения, умения высказывать свои взгляды и суждения;
Тип урока: урок систематизации и развития знаний, умений и навыков.
| Планируемые образовательные результаты |
| Предметные | Метапредметные | Личностные |
| Регулятивные | Познавательные | Коммуникативные |
| Знать: понятие оксид, классификацию оксидов. Уметь: характеризовать оксид металла по положению металла в ПСХЭ, применять полученные знания для решения практических задач | Постановка учебной задачи на основе соотнесения того, что уже известно и усвоено учащимся, и того, что еще неизвестно. Выбор, принятие и сохранение учебной цели и задачи. Составление плана, осуществление самоконтроля и самооценки, осознание качества и уровня усвоения. | Сравнение, обобщение, конкретизация, анализ; самостоятельное выделение и формулирование познавательной цели; поиск и выделение необходимой информации, применение методов информационного поиска, в том числе с помощью компьютерных средств. Умение структурировать знания; умение осознанно и произвольно строить речевое высказывание в устной и письменной форме; рефлексия способов и условий действия, контроль и оценка процесса и результатов деятельности; | Умение формулировать собственное мнение и позицию. Осознанное построение речевых высказываний. Восприятие выступлений учащихся. Участие в обсуждении содержания материала. Взаимоконтроль, взаимопроверка. Планирование учебного сотрудничества с учителем и сверстниками – определение цели, функций участников, способов взаимодействия. | Рефлексия собственной деятельности. Действие смыслообразования, т. е. установление учащимися связи между целью учебной деятельности и ее мотивом. |
Структура урока
Организационный этап.
Актуализация знаний.
1. Мотивация.
2. Основной этап (усвоение новых знаний и способов действий).
3. Закрепление и применение знаний.
4. Подведение итогов. Рефлексия.
5. Домашнее задание.
Ход урока
Организационный этап.
Актуализация знаний.
Тест
Вариант I Вариант II
1. Металлический элемент: 1. Переходный элемент:
a) S; б) Ва; в) Al. a) Zn; б) Р; в) Na.
2. Металл, способный вытеснить водород:
из воды: из раствора кислоты:
а) Сu; б) Li; в) Рb. а) Са; б) Ag; в) Hg.
3. Из раствора соли сульфата меди (II)
медь могут вытеснить: медь не вытесняют:
a) Zn; б) Са; в) Fe; г) Na; д) Ag.
4. Растворится ли образец смеси металлов
Al, Мn, Сu в растворе: Fe, Ag, Zn в растворе:
a) HCl; б) КОН. a) H2 SO4 ; б) КОН.
Составить уравнения реакций.
Ответы на вопросы теста
Вариант I
1) «б»;
2) «б»;
3) «а», «в»;
4) а) в НСl;
Вариант II
1) «а»;
2) «а»;
3) «б», «г», «д»;
4) a)
Мотивация
Основной этап (усвоение новых знаний и способов действий).
1. Оксиды, образованные металлами, особенности их свойств в зависимости от С.О. элемента и радиуса иона; изменение свойств оксидов элементов в периодах и в группах, главных подгруппах.
2. Гидроксиды, образованные оксидами металлов; изменение характера гидроксида в зависимости от С.О. элемента и радиуса его иона.
3. Характер оксидов и гидроксидов, образованных металлами побочных подгрупп. ПСХЭ длиннопериодная и укороченная.
Все металлы образуют солеобразующие оксиды. Однако одни оксиды проявляют свойства основных оксидов, а другие проявляют кислотно-основные, то есть амфотерные свойства. От чего это зависит? Следует знать следующее — металл, проявляющий С.О. +1, +2 образует оксиды основного характера, т. к. это типичные металлы, которые расположены в I и II группах, главных подгруппах.
Пример: 1 группа, главная подгруппа представлена элементами Li, Na, К, Rb, Cs, Fe. К концу группы главной подгруппы у элементов возрастает атомный радиус. При отдаче электрона с внешнего уровня образуются катионы. С.О. у всех элементов к концу группы не изменяется, а вот характер оксидов — основной, будет усиливаться,

Усиливается основной характер

Возрастает радиус нового элемента
Если рассмотреть изменение свойств оксидов элементов по периоду на примере элементов III периода, то следует отметить, что в атомах этих элементов количество энергетических уровней одинаково, однако изменяется С.О. К концу периода она возрастает, что вызывает уменьшение радиуса иона. Вследствие чего характер оксида изменяется от основного через амфотерный к кислотному.
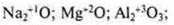
С.О. возрастает

Радиус иона уменьшается, характер оксида изменяется от основного к амфотерному
Оксидам металлов соответствуют гидроксиды. Если С.О. металлов +1, +2, +3, +4, то они образуют оксиды:  и гидроксиды:
и гидроксиды: 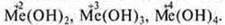
Характер гидроксида зависит также от С.О. элемента и радиуса иона. Чем больше С.О., тем меньше радиус иона, характер гидроксида в большей степени кислотно-основной, то есть проявляет амфотерность:
в периодах:
Пример: III период.
Гидроксиды: 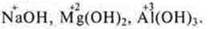
Ослабление свойства основания, усиление кислотного свойства

Возрастает С.О.: уменьшается радиус иона; щелочь, основание, амфотерное основание.
в группах, главных подгруппах:
Пример: I группа, главная подгруппа.
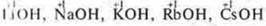
С.О. не изменяется

Возрастает радиус иона, усиливаются свойства гидроксидов как оснований
Переходные элементы, расположенные в малых периодах — это Ве (II период), Аl (IIIпериод), образуют оксиды BeO, Аl2O3 и гидроксиды Ве(ОН)2 и Аl(ОН)3 — проявляющие амфотерные кислотно-основные свойства. Что это означает?
Эксперимент
Al(OH)3: а) получение, б) кислотно-основные свойства.
Основные свойства: взаимодействие с кислотами, оксидами и гидроксидами.

Кислотные свойства: взаимодействие с щелочами и оксидов, и гидроксидов.
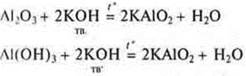
и если раствор щелочи, то образуется комплекс

Итак, с увеличением С.О. металла происходит уменьшение радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от основного к кислотно-основному, а далее проявляют кислотный характер.
У элементов побочных подгрупп изменение С.О. можно рассмотреть на примере одного металла.
Пример: металл хром может проявлять С.О. +2, +3, +6.
 — основной оксид, гидроксид Сr(ОН)2 — основание;
— основной оксид, гидроксид Сr(ОН)2 — основание;
 — амфотерный оксид, гидроксид Сr(ОН)3 — амфотерное основание;
— амфотерный оксид, гидроксид Сr(ОН)3 — амфотерное основание;
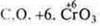 — кислотный оксид, гидроксид Н2СrO4, Н2Сr2O7 — кислота.
— кислотный оксид, гидроксид Н2СrO4, Н2Сr2O7 — кислота.
Нам известно, что С.О. максимальная определяется по номеру группы. Элемент хром расположен в VI группе, побочной подгруппе. Элемент сера также расположен в VI группе, только главной подгруппе. В высшей степени окисления они образуют кислотные оксиды 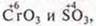 которым соответствуют кислоты
которым соответствуют кислоты
Н2СrO4 и H2SO4. Знание такого сходства многих элементов позволило Д. И. Менделееву построить укороченную таблицу химических элементов, где в отличие от длиннопериодной кроме групп появились подгруппы главная и побочная. Все элементы одной группы проявляют максимальную валентность, С.О. соответственно равна номеру группы.
Вернемся к примеру с хромом.
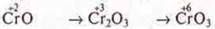 — оксиды
— оксиды
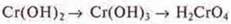 — гидроксиды
— гидроксиды
1) Что происходит со С.О.?
Ответ: С.О. возрастает.
2) Как вы думаете, а радиус иона как изменяется?
Ответ: радиус иона хрома с увеличением С.О. уменьшается.
3) Как эти изменения сказываются на свойствах соединения?
Ответ: происходит изменение свойств оксидов и гидроксидов от основного, через амфотерный к кислотным.
5. Закрепление и применение знаний
Составить формулу оксида и гидроксида хрома (III). Уравнениями реакций подтвердить их амфотерность.
Ответ: Сr2O3 — оксид хрома (II).
 — основной оксид взаимодействия с кислотой.
— основной оксид взаимодействия с кислотой.
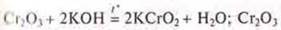 — кислотный оксид взаимодействия с щелочью.
— кислотный оксид взаимодействия с щелочью.
 — гидроксил хрома (III).
— гидроксил хрома (III).
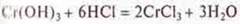 — осадок исчезает.
— осадок исчезает.
Гидроксид хрома — основание, взаимодействует с кислотой.
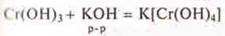 — осадок исчезает.
— осадок исчезает.
Гидроксид хрома проявляет кислотные свойства, т. к. взаимодействует с растворами щелочи.
6. Подведение итогов. Рефлексия.
| 1. На уроке я работал 2. Своей работой на уроке я 3. Урок для меня показался 4. За урок я 5. Мое настроение 6. Материал урока мне был | активно / пассивно доволен / не доволен коротким / длинным не устал / устал стало лучше / стало хуже понятен / не понятен |
Домашнее задание
Вариант I
1. Металлический элемент:
a) S; б) Ва; в) Al.
2. Металл, способный вытеснить водород из воды:
а) Сu; б) Li; в) Рb.
3. Из раствора соли сульфата меди (II) медь могут вытеснить:
a) Zn; б) Са; в) Fe; г) Na; д) Ag.
4. Растворится ли образец смеси металлов Al, Мn, Сu в растворе
a) HCl; б) КОН.
Составить уравнения реакций.
Вариант II
1. Переходный элемент:
a) Zn; б) Р; в) Na.
2. Металл, способный вытеснить водород из раствора кислоты:
а) Са; б) Ag; в) Hg.
3. Из раствора соли сульфата меди (II) медь не вытесняют:
a) Zn; б) Са; в) Fe; г) Na; д) Ag.
4. Растворится ли образец смеси металлов Fe, Ag, Zn в растворе:
a) H2 SO4 ; б) КОН.
Составить уравнения реакций.
Вариант I
1. Металлический элемент:
a) S; б) Ва; в) Al.
2. Металл, способный вытеснить водород из воды:
а) Сu; б) Li; в) Рb.
3. Из раствора соли сульфата меди (II) медь могут вытеснить:
a) Zn; б) Са; в) Fe; г) Na; д) Ag.
4. Растворится ли образец смеси металлов Al, Мn, Сu в растворе
a) HCl; б) КОН.
Составить уравнения реакций.
Вариант II
1. Переходный элемент:
a) Zn; б) Р; в) Na.
2. Металл, способный вытеснить водород из раствора кислоты:
а) Са; б) Ag; в) Hg.
3. Из раствора соли сульфата меди (II) медь не вытесняют:
a) Zn; б) Са; в) Fe; г) Na; д) Ag.
4. Растворится ли образец смеси металлов Fe, Ag, Zn в растворе:
a) H2 SO4 ; б) КОН.
Составить уравнения реакций.