Көмүртек атомунун түзүлүшү. Изомерия кубулушу. Гомологиялык катар. Номенклатурасы
Д.И.Менделеевдин мезгилдик системасында көмүртек 4-топто, экинчи мезгилде жайгашкан. Көмүртек атомунун түзүлүшүнүн электрондук формуласы: С+6 1s22s2 2p2


Дүүлүккөн абалда көмүртек атомунун 2s2 электрондун бирөө 2p бош орбиталына өтөт. Көмүртек атомунун козголгон абалда 2p3 орбиталында
жупсуз үч электрон жайгашкан. Ошентип Көмүртек атому дүүлүккөн абалда сырткы энергетикалык деӊгелинде төрт жупсуз электронго ээ болуп төрт валенттүүлүктү көрсөтөт.



Бирдей молекулалык курамга , молекулалык маасага ээ болуп, түзүлүшү жана касиеттери ар башка затты пайда кылуу кубулушу изомерия деп аталат.

Химиялык касиеттери окшош , курамдары бир-бирнен –СН2- тобу менен айырмаланган заттарды гомологдор дейбиз. Салыштырмалуу молекулалык маасаларынын өсүш тартибинде жайгаштырылган гомологдор, гомологиялык катарды түзөт. –СН2- бул гомологиялык айырмачылык деп аталат.
Гомология термини гректин “гомолог” –окшош деген сөзүнөн алынган.
Метандын гомологдорунда көмүртектин атому С1-С4 –газ абалынды, С5-С16 чейинкилер суюктуктар, андан жогоркулары катуу заттар.

Изомерия жана номенклатура.
Углеводороддордун атын атоодо үч номенклатура колдонулат: тарыхый, рационалдык жана систематикалык ( ИЮПАК). Тарыхый номеклатура боюнча алкандардын 1-төрт өкүлүн немец окумуштуусу А.Гофман метан, этан, пропан, бутан деп атаган. Калган алкандардын тарыхый аттары молекуладагы көмүртектин санына жараша гректин саноо сандарынан алынып « ан» мүчөсү кошулуп аталат. С5Н12-пентан, С6Н14-гексан ж.б. Тарыхый номенклатура боюнча структуралык изомерлерди атоо бир топ кыйынчылыктарды пайда кылгандыктан, рационалдык номенклатура кабыл алынган. Рационалдык номенклатура боюнча углеводороддордун молекуласынын бир бөлүгүн метан деп, калган бөлүгүн метандын молекуласындагы Н атому менен орун алмашкан радикалдар деп атайбыз. Эгерде оюбуздан алардын формулаларынан суутектин бирден атомдорун алып таштай турган болсок анда радикалдар деп аталган атомдордун топтору келип чыгат. Радикалдардын аттары тийиштүү көмүрсуутектердин аттарынан –ан деген мүчөнү -ил деген мүчө менен өзгөртүү аркылуу пайда болот, мисалы:
метил СН3-,
этил СН3-СН2-,
пропил СН3-СН2-СН2-,
бутил СН3-СН2-СН2-СН2- ж.б.у.с.
1- радикалдардын аты аталып, ага«метан» деген сөз кошулуп жазылат. Мисалы:
СН3—СН3– метил метан
СН3—СН2–СН3– диметилметан
С9Н20 га барганда, алы жетпей систематикалык номенклатура колдонулат. Бутактанган тизмектүү чектүү углеводороддордун аттарын атоо үчүн бардык молекулалардагы суутектин атомдору ар кандай радикалдар менен орун алмашкан деп кабыл алышат. Берилген углеводороддордун аттарын атоо үчүн белгилүү бир тартип сакталат:
1.Формуладагы көмүртектин бир кыйла узун тизмегин тандап алышып, андагы көмүртектин атомдорунун символдорун тизмектин бутактанган жерине жакын жагынан баштап номерлешет:

2. Радикалдарды (эң жөнөкөйлөрүнөн баштап) аташат да, цифралардын
жардамы менен көмүртектин номерленген атомдорундагы алардын ордун көрсөтүшөт. Эгерде көмүртектин бир эле атомунда бирдей эки радикал болсо, анда номер эки жолу кайталанат. Бирдей радикалдардын санын грек тилинде сандын жардамы менен көрсөтүшөт(«ди»-эки, «три»-үч, « тетра»-төрт ж.б.у.с.)
а) 2-метил…
б) 2,2-диметил…
в) 3-метил…
г) 2,3-диметил…
3. Берилген көмүрсуутектердин толук атын номерленген тизмектеги
көмүртектин атомдорунун саны боюнча беришет:
а) 2-метилпентан
б) 2,2-диметилбутан
в) 3-метилпентан
г) 2,3-диметилбутан
Углеводороддордун санынын көптүгү изомерия кубулушу менен түшүндүрүлөт. Стин скелети татаалдаган сайын, изомерлери да көбөйүп отурат. Мисалы: бутанда алар -2, пентанда -3, гександа –5, ал эми деканда С10Н22 болсо, 75 ке жетет. Алкандар үчүн структуралык изомерия кубулушу мүнөздүү. Бутактануу бутандан башталат.

Просмотр содержимого документа
«Көмүртек атомунун түзүлүшү. Изомерия кубулушу. Гомологиялык катар. Номенклатурасы.»

Көмүртек атомунун түзүлүшү. Көмүртек атомунун валенттик абалы.

Атом
е‾ электрон
Электрондук
Электрондор
булутча
волна
частица
1s ²
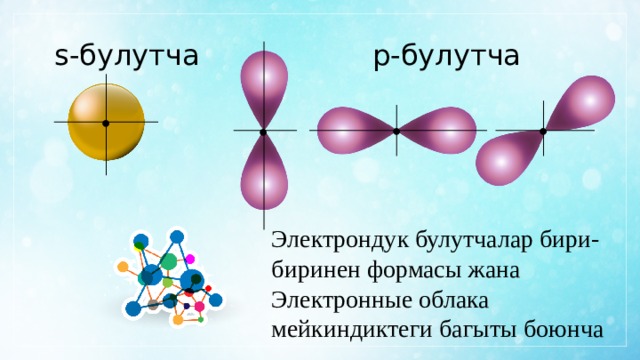
s-булутча
p-булутча
●
●
●
●
Электрондук булутчалар бири-биринен формасы жана
Электронные облака мейкиндиктеги багыты боюнча

Эки атомдун сырткы электрондук булутчасы жабылышканда коваленттик байланыш пайда болот.
Жалпы энергиясы минимумга төмөндөйт.
σ-байланыш
σ-байланыш
●
●
●
●

Көмүртек атому
е‾ электрон
-
-
-
-
волна
частица
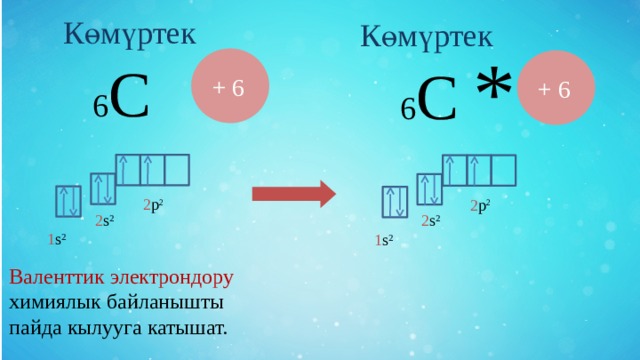
1s 2 2s 2 2p 2

К өмүртек
6 С
+ 6
2 р 2
2 s ²
1 s ²
Валенттик электрондору химиялык байланышты пайда кылууда катышат.
6

Көмүртек органикалык бирикмелерде дайыма төрт валенттүү.
Көмүртек
Көмүртек
*
6 С
6 С
+ 6
+ 6
2 р 2
2 р 2
2 s ²
2 s ²
1 s ²
1 s ²
Валенттик электрондору химиялык байланышты пайда кылууга катышат.
8
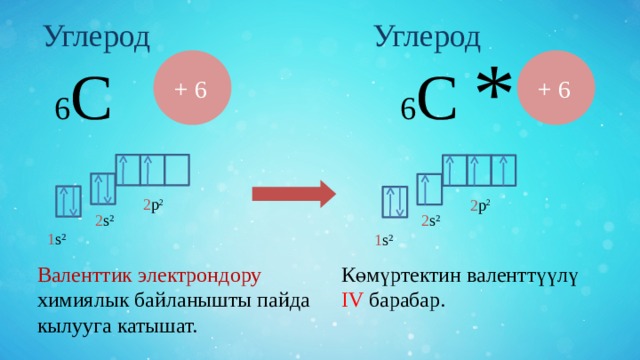
Углерод
Углерод
*
6 С
6 С
+ 6
+ 6
2 р 2
2 р 2
2 s ²
2 s ²
1 s ²
1 s ²
Валенттик электрондору химиялык байланышты пайда кылууга катышат.
Көмүртектин валенттүүлү IV барабар.
9
● ●
● ●
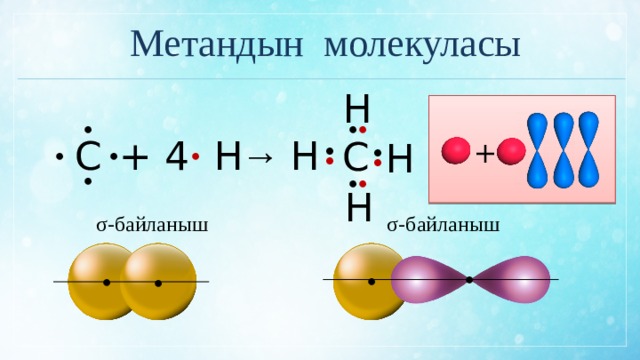
Метандын молекуласы
Н
● ●
●
→
Н
+ 4 Н
С
С
Н
+
●
●
●
●
● ●
Н
σ-байланыш
σ-байланыш
●
●
●
●
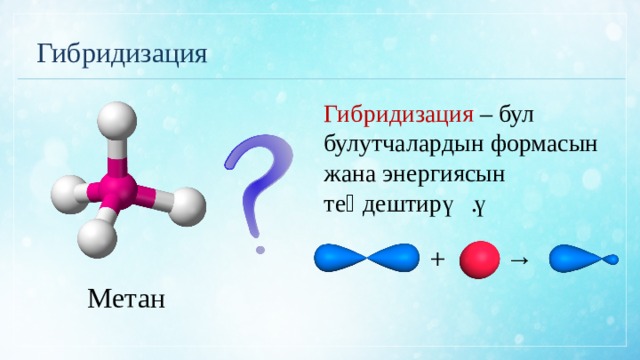
Гибридизация
Гибридизация – бул булутчалардын формасын жана энергиясын теӊдештирүү.
+
→
Метан
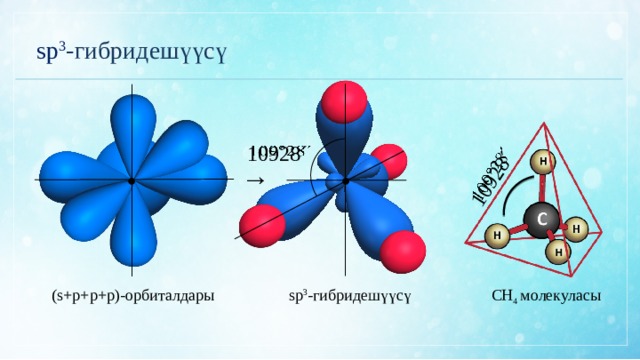
10928´
sp 3 -гибридешүүсү
10928´
→
●
●
sp 3 -гибридешүүсү
(s+p+p+р)-орбиталдары
СН 4 молекуласы
● ●
● ●
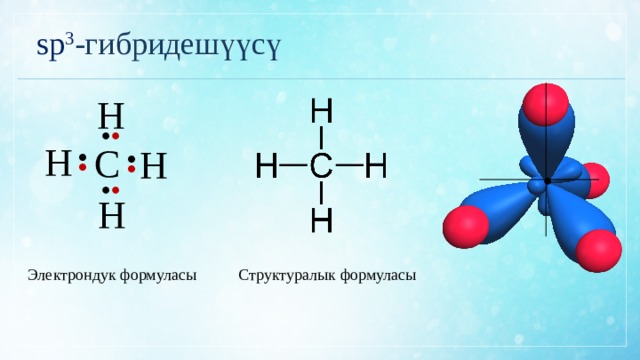
sp 3 -гибридешүүсү
Н
● ●
Н
С
Н
●
● ●
Н
Структуралык формуласы
Электрондук формуласы
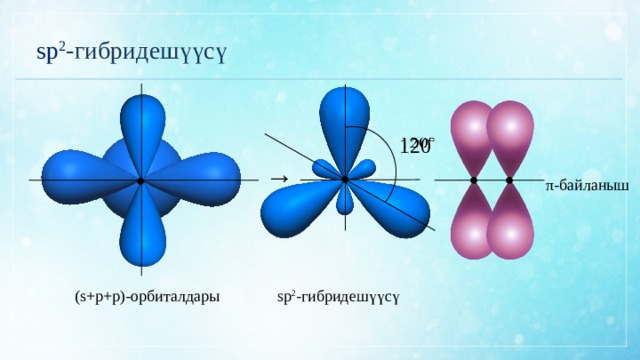
sp 2 -гибридешүүсү
120
→
●
●
●
●
π-байланыш
sp 2 -гибридешүүсү
(s+p+p)-орбиталдары
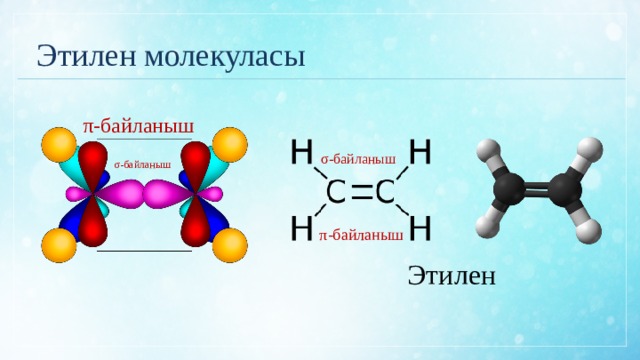
Этилен молекуласы
π-байланыш
σ-байланыш
σ-байланыш
π-байланыш
Этилен
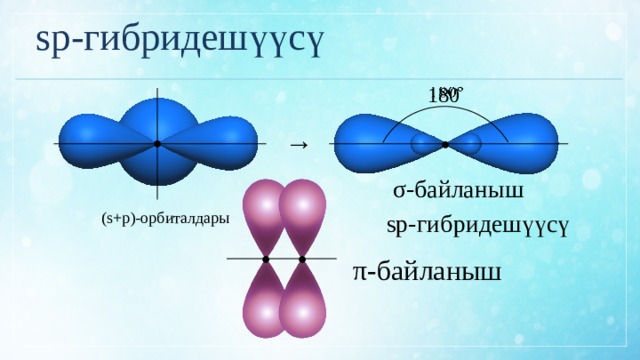
sp-гибридешүүсү
180
→
●
●
σ-байланыш
(s+p)-орбиталдары
sp-гибридешүүсү
●
●
π-байланыш
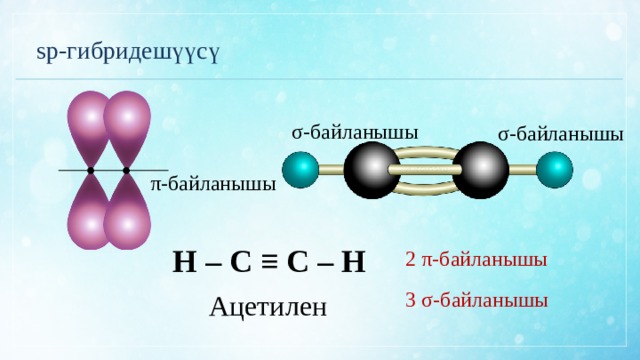
sp-гибридешүүсү
σ-байланышы
σ-байланышы
●
●
π-байланышы
Н – С ≡ С – Н
2 π-байланышы
3 σ-байланышы
Ацетилен

Гибридешүүнүн тиби
sp 3 -гибридешүүсү- эгерде молекуладагы көмүртек атому төрт атом менен байланышса;
sp 2 -гибридешүүсү- эгерде молекуладагы көмүртек атому үч атом менен байланышып, ошол эле учурда көмүртек көмүртек атомдорунун ортосунда кош байланыш болсо;
sp-гибридешүүсү эгерде молекуладагы көмүртек атому эки атом менен байланышып, ошол эле учурда көмүртек көмүртек атомдорунун ортосунда үчтүк байланыш болсо;

Гибридешүү тиби боюнча бөлүштүрү
sp
sp 3
sp 2
sp 2
sp
sp
СН ≡ С – СН = С = СН – СН 3
1
2
6
5
4
3

Органикалык бирикмелерде көмүртек атому 2s- электрондорунун
2p деӊгээлчесине өтүшүнүн эсебинен төрт валенттүү боло алат.
Көмүртек атому органикалык бирикмелерде sp 3 -, sp 2 - жана sp - гибридешүү абалында .





















































