Классификация оксидов (8 класс)
Цели:
Образовательные: закрепить знания о металлах и неметаллах (элементах и веществах), дать первые представления об основных классах химических соединений, рассмотреть оксиды как самостоятельный класс неорганических веществ, совершенствовать умения устанавливать существенные признаки, являющиеся основой классификации веществ.
Воспитательные: продолжить формирование мировоззрения учащихся, общеучебных навыков, внимания, аккуратности, показать взаимосвязь химических понятий (оксиды, степени окисления, ионы и т.п.).
Развивающие: совершенствовать речь учащихся, навыки по исследованию химических веществ, умения анализировать, обобщать, сравнивать, классифицировать, развивать познавательный интерес школьников.
Оборудование и реактивы.
На демонстрационном столе и столах учащихся:
штатив с пробирками, стеклянная палочка, медь, алюминий, цинк, железо, сера, оксид меди(II), оксид магния, оксид кремния(IV).
ХОД УРОКА
Организационный этап
Он включает приветствие, фиксацию отсутствующих, организацию внимания.
Проверка ранее изученного материала
Проверка домашнего задания. На предыдущем уроке учащиеся знакомились с классификацией веществ на простые и сложные, а также рассмотрели особенности строения простых веществ – металлов и неметаллов. В качестве письменного задания.
Текст задания: «Составьте электронные формулы и нарисуйте распределение электронов по орбиталям атома кислорода в степени окисления 0, –2, –1 и +2».
К доске приглашаются два ученика для выполнения домашнего задания
Работа с классом.
Фронтальная беседа (о металлах и неметаллах).
Как классифицируют неорганические вещества по составу?
Какие вещества называют простыми? Приведите примеры простых веществ.
Какие вещества называют сложными? Приведите примеры сложных веществ.
На какие группы подразделяют простые вещества?
Какие вещества называют металлами? Каковы их физические свойства? Приведите примеры металлов.
Какие элементы называют металлами? В чем особенности строения атомов металлов?
Какие вещества называют неметаллами? Каковы их физические свойства? Приведите примеры неметаллов.
Какие элементы называют неметаллами? В чем особенности строения атомов неметаллов?
Игра «Волшебный цветок».

На доске с помощью магнитов прикреплен «волшебный цветок», на лепестках которого написаны разнообразные химические формулы.
К доске приглашается ученик, который должен поместить лепестки с формулами в соответствующие колонки таблицы:
| Металлы | Неметаллы | Сложные
вещества |
| | | |
Тестовая проверка
Вопросы для тестовой проверки написаны на доске.
| Вопросы теста | Варианты ответа |
| 1 | 2 | 3 | 4 |
| Неметаллические свойства
характерны для | Mg | As | Fe | Ca |
| Жидкое состояние при
обычных условиях имеет | Hg | O2 | Ba | S |
| Бинарным веществом
является | H–O–Cl | H2O | N N N | NaClO |
| Ковалентная полярная связь
имеется в веществе | NaCl | F–F | H2S | Mg |
| Окислительные свойства
проявляет частица | Ca0 | Na+ | S2– | Cl+ |
| Марганец проявляет
степень окисления +7в веществе | MnO2 | MnCl2 | HMnO4 | K2MnO4 |
Проверка тестов проводится фронтально: после каждого вопроса ребята сигналят при помощи красных и зеленых значков о выбранном варианте ответа.
Изучение новой темы
Учитель. На прошлом уроке мы начали заполнять схему классификации неорганических веществ. Продолжим работу с этой схемой. Все сложные неорганические вещества можно разделить на четыре класса: оксиды, основания, кислоты и соли. Деление веществ на классы основано на сходстве строения и свойств.
Учитель демонстрирует схему классификации веществ .
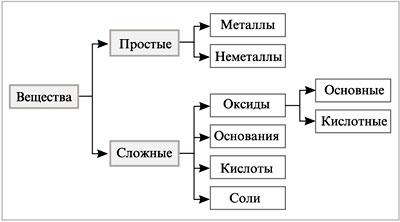
Учитель.
Итак, ребята, кто сможет назвать тему урока, опираясь на материал предыдущих уроков? Ребята называют тему урока.
Кто сможет дать определение оксидов, опираясь на изученный материал?
Учащиеся, как правило, дают определение оксидов как веществ, содержащих кислород, поэтому в ходе беседы учитель задает ряд вопросов.
Учитель. Согласно данному вами определению вещество О2 тоже является оксидом. Так ли это?
Ученики уточняют, что оксиды – это сложные вещества, содержащие кислород.
Учитель. Значит, вещество Н2SО4 – это оксид. Согласны ли вы со мной?
Учащиеся говорят, что оксиды являются бинарными веществами. Учитель обращает внимание школьников на лепестки «волшебного цветка» и просит их найти сходство между предложенными веществами (все содержат кислород).
Учитель. Можно ли сказать, что все эти вещества оксиды?
Обычно учащиеся соглашаются, т.е. вещество ОF2 тоже относят к оксидам.
Учитель. В чем отличие данных бинарных веществ друг от друга?
Учащиеся обращают внимание, что степень окисления кислорода в веществе О2F равна +2, а в веществе Н2О2 равна –1.
Учитель предлагает всем посмотреть на доску. Там уже подготовлено учениками решение домашнего задания, представлены схемы распределения электронов по орбиталям атома кислорода в разных степенях окисления.
Учитель. В каком случае кислород проявляет положительную степень окисления? Почему? Что такое электроотрицательность?
Учитель объясняет, что вещество Н2О2 – это пероксид водорода, а ОF2 – это фторид кислорода. И наконец, обращает внимание на текст определение «оксидов» в учебнике
| Оксиды – это бинарные соединения, в состав которых входит кислород со степенью окисления –2. |
Учитель. Чем отличаются по составу друг от друга следующие оксиды: MgO и СО2, К2О и SO3?
Учащиеся объясняют, что оксиды К2О и MgO образованы металлами, а оксиды SO3 и СО2 образованы неметаллами.
Учитель. Классификация оксидов основана на свойствах элементов, образующих данный оксид. Оксиды делятся на несколько групп. Сегодня мы познакомимся с двумя группами оксидов.
Продолжение работы со схемой.

| Основные оксиды – это оксиды, которым соответствуют основания. Эти оксиды образованы кислородом и металлами со степенью окисления +1 и +2 (кроме BеО и ZnО). |
Учитель. Примеры основных оксидов – Na2O, CaO. Для образования соответствующего основания к оксиду необходимо прибавить воду.

Учитель предлагает учащимся самостоятельно составить формулу основания, соответствующего оксиду натрия.
| Кислотные оксиды – это оксиды, которым соответствуют кислоты. Они образованы кислородом и неметаллами (в любой степени окисления), а также металлами со степенью окисления +5, +6, +7. |
Учитель. Пример кислотного оксида – SO3. Для образования соответствующей кислоты к оксиду надо прибавить воду.

Учитель просит учащихся самостоятельно составить формулу кислоты, соответствующей оксиду серы(IV).
Назовите формы оксидов, проявляющих основные свойства (по лепесткам «волшебного цветка»).
Дайте названия этим оксидам.
Назовите формулы оксидов, проявляющих кислотные свойства (по лепесткам «волшебного цветка»).
Дайте названия этим оксидам. (Обращаем внимание учащихся на элементы, имеющие переменную валентность.)
Каков характер оксида, имеющего формулу Аs2O5? Обоснуйте свой ответ.
Учитель. Ребята, у вас на столах находятся склянки с оксидами. Распределите эти вещества на две группы: основные и кислотные оксиды.
Опишите вещество СuО.
Сравните физические свойства меди и оксида меди(II).
Проверьте вещество СuО на растворимость в воде. (Ученики проводят лабораторный опыт.)
Как называется полученная система, состоящая из оксида меди(II) и воды?
Докажите, что данная смесь веществ неоднородна.
Каким способом можно разделить данную смесь?
Как рассчитать массовую долю оксида меди(II) в этой смеси, если предположить, что масса оксида меди(II) равна 4 г, а масса воды – 12 г? (Учащиеся решают задачу.)
Ученик (сообщение). Вода – одно из самых распространенных и наиболее важных соединений на Земле. Почти 3/4 поверхности Земли покрыто водой. Мозг человека содержит 81% воды, в крови на воду приходится 4/5 части. Интересно, что высохшая мумия весит только 8 кг. Вода нужна всем: человеку в сутки необходимо примерно 3 л, 30-летней березе – 60 л. Велика роль воды в клетке, она участвует в химических процессах. Из воды и углекислого газа в результате фотосинтеза образуется крахмал. Вода нужна всем отраслям народного хозяйства: и сельскому хозяйству, и энергетике, и коммунальным хозяйствам. Воду надо беречь, не засорять ее бытовыми и промышленными отходами.
Учитель.
Ребята, давайте вернемся к «волшебному цветку» и посмотрим на формулы оксидов.
Какой тип связи в основных оксидах?
Что такое ионы?
Покажите механизм образования химических связей в молекуле оксида магния. (Ученик работает у доски.)
Почему магний отдает именно 2 электрона?
Демонстрация.
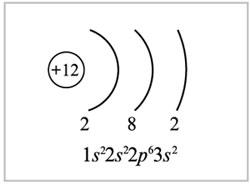
Учитель. Какой тип химической связи в кислотных оксидах, образованных неметаллами?
Что такое ковалентная полярная связь?
Составьте структурную формулу оксида серы(IV).
Ученик отвечает у доски.
Закрепление нового материала
Игра «Что лишнее?»
Перед вами ряд веществ, исключите лишнее. Почему вы исключили именно это вещество?
| 1-й вариант: К2О, СаО, Аg2О, СО2, МgО.
2-й вариант: СО2, SiO2, SO3, FеО, P2O5, CrO3. |
Химические загадки.
О каких элементах идет речь? Каков характер их оксидов?
«Я светоносный элемент,
Я спичку вам зажгу в момент.
Сожгут меня – и под водой
Оксид мой станет кислотой».
(Фосфор.)
«Иду на мелкую монету,
В колоколах люблю звенеть,
Мне ставят памятник за это
И знают: имя мое...»
(Медь.)
Образуйте соответствующие этим элементам кислоту и основание.
(Н3РО4 и Cu(OH)2.)
Химические ребусы.
Учитель предлагает ребятам отгадать ребусы, на которых зашифрованы названия химических элементов, составить формулы их оксидов и указать характер этих оксидов.
Игра «Химический снегопад».
«Снег идет, и снег кружится,
Он ковром везде ложится.
Приглашаю всех я вас
Поиграть в снежки сейчас».
Но снежки, ребята, у нас будут необыкновенные – химические. На снежинках разного цвета написаны задания разной степени трудности. Вы должны выбрать для себя задание либо на оценку «3», либо на «4», либо на «5».
Тексты с заданиями учитель раздает учащимся после объявления игры.
Задание на «3» (синяя снежинка). Какие из перечисленных веществ являются кислотными оксидами: МgО, SiO2, Сu2О, Al2О3, N2O5, Сl2О5, Nа2О, FеСl3?
Задание на «4» (белая снежинка). 1.В каком веществе массовая доля кислорода больше: в оксиде серы(IV) или в оксиде серы(VI)? Приведите расчеты и определите характер оксидов.
2.В каком веществе массовая доля кислорода больше: в оксиде фосфора(V) или в оксиде фосфора(III)? Приведите расчеты и определите характер оксидов.
Задание на «5» (голубая снежинка). 1. Какой объем воздуха (н.у.), содержащего 21% кислорода, потребуется для сжигания магния, чтобы образовалось 240 г оксида магния? 2. Массовая доля фосфора в неизвестном оксиде составляет 43,7%. Определите формулу оксида. Каков характер этого оксида?
Домашнее задание: по учебнику «Химия-8» О.С Габриелян ( Дрофа) § 18,40. Упр. 1
Подведение итогов
Подведение итогов урока, комментарии отметок и оценка работы учащихся.
































