Класс ОКСИДЫ

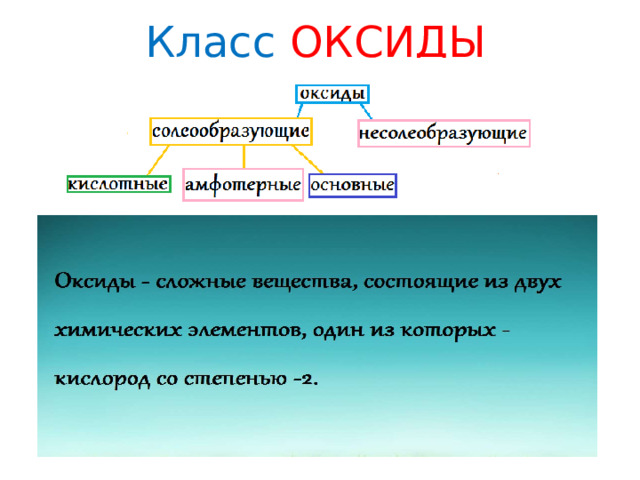
Классификация оксидов
- Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, образованные атомами металлов с валентностью I и II.
Кислотные оксиды — это оксиды, образованные атомами металлов c валентностью V, VI, VII, а также атомами ВСЕХ неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов с валентностью III и IV, а также четыре оксида c валентностью II: ZnO, PbO, SnO и BeO.
- Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды.
К несолеобразующим относят четыре оксида: CO, NO, N 2 O и SiO.

НОМЕНКЛАТУРА – это правила составления названий веществ
Первое слово в названии «оксид», второе название кислотообразующего элемента в родительном падеже. При переменной валентности кислотообразующего элемента, ставить её в конце в скобочках римскими цифрами.
SO 2 оксид серы (IV)
MgО оксид магния

Общие способы получения оксидов:
- Взаимодействие простых веществ МЕТАЛЛОВ с кислородом:
4Al + 3O 2 → 2Al 2 O 3
- Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3) :
4Fe + 3O 2 → 2Fe 2 O 3
4Cr + 3O 2 → 2Cr 2 O 3
- Железо также горит с образованием железной окалины — оксида железа (II, III):
3Fe + 2O 2 → Fe 3 O 4

2. Взаимодействие простых веществ НЕМЕТАЛЛОВ с кислородом:
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления , если кислород в избытке .
Или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
4P + 5O 2(изб.) → 2P 2 O 5
4P + 3O 2(нед.) → 2P 2 O 3
ИСКЛЮЧЕНИЯ: сера сгорает только до оксида серы (IV)
S + O 2 → SO 2
2SO 2 + O 2 = 2SO 3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
N 2 + O 2 = 2NO

3. Горением на воздухе сложных веществ:
А) Сероводород :
2H 2 S + 3O 2(изб.) → 2H 2 O + 2SO 2
2H 2 S + O 2(нед.) → 2H 2 O + 2S
Б) Аммиак горит с образованием простого вещества N 2 :
4NH 3 + 3O 2 →2N 2 + 6H 2 O
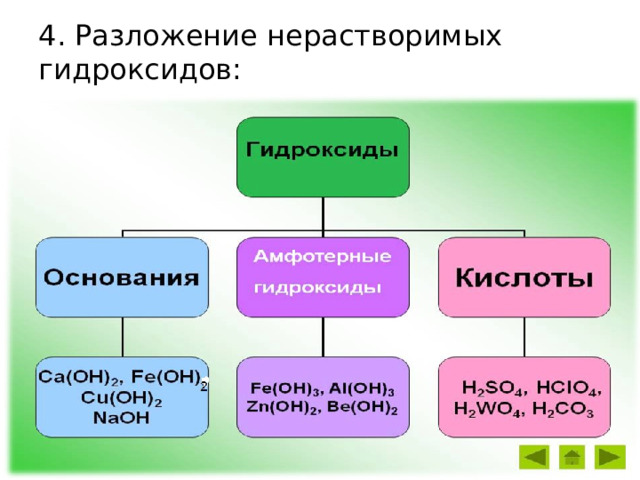
4. Разложение нерастворимых гидроксидов:
гидроксид → оксид + вода

5. Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония , гидроксиды серебра (I)и меди (I):
H 2 CO 3 → H 2 O + CO 2
H 2 SO 3 → H 2 O + SO 2
NH 4 OH → NH 3 + H 2 O
2AgOH → Ag 2 O + H 2 O
2CuOH → Cu 2 O + H 2 O
6. При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
H 2 SiO 3 → H 2 O + SiO 2
2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O

7. Разложение солей:
Например , нерастворимые карбонат кальция и карбонат магния при нагревании разлагаются на оксиды:
MgCO 3 → CO 2 + Mg 2 O
CaCO 3 → CaO + CO 2

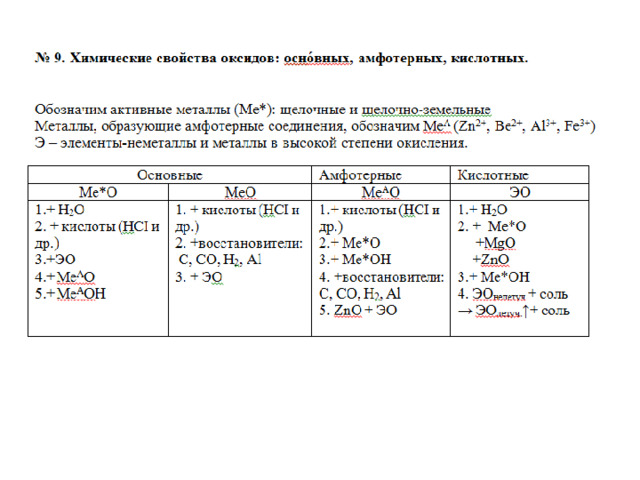
Химические свойства оксидов
Взаимодействие оксидов металлов с восстановителями.
Нужно использовать электрохимический ряд напряжений металлов:

1. Восстановление углем или угарным газом .
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO
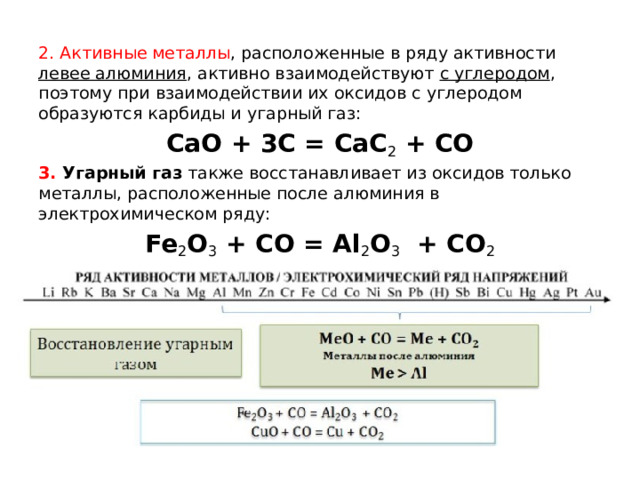
2. Активные металлы , расположенные в ряду активности левее алюминия , активно взаимодействуют с углеродом , поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC 2 + CO
3. Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
Fe 2 O 3 + CO = Al 2 O 3 + CO 2
CuO + CO = Cu + CO 2

4. Восстановление водородом .
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H 2 = Cu + H 2 O

5. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла )
При этом более активные металлы вытесняют менее активные.
То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al 2 O 3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al 2 O 3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием:
CuO + Mg = Cu + MgO

6. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например , аммиак восстанавливает оксид меди (II):
3CuO + 2NH 3 = 3Cu + 3H 2 O + N 2
7. Взаимодействие оксидов металлов с окислителями .
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe 2+ , Cr 2+ , Mn 2+ и др.) могут выступать в качестве восстановителей.
Например , оксид железа (II) можно окислить кислородом до оксида железа (III):
4FeO + O 2 = 2Fe 2 O 3