
Классификация и особенности органических реакций .

Классификация органических реакций
За основу классификации принимают способ разрыва старых химических связей и образования новых. В этом случае органические реакции классифицируют по характеру химических превращений или по механизму их протекания.

Классификация органических реакций
I . По характеру химических превращений органические реакции делят на следующие типы:
1. Реакции замещения ( обозначается буквой S , от англ. substitution – «замещение» ). Один атом (или группа атомов) замещается на другой атом (или группу атомов) с образованием новой молекулы

Классификация органических реакций
2. Реакции присоединения (обозначается символом А или Ad , от англ. аddition – «присоединение» ). Из двух или нескольких молекул образуется одно новое вещество:
Как правило, в таких реакциях происходит присоединение различных реагентов к кратным связям.
Классификация органических реакций
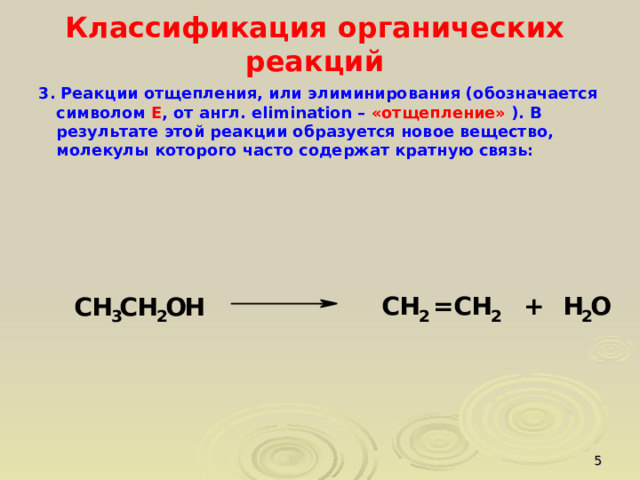
3. Реакции отщепления, или элиминирования (обозначается символом Е , от англ. еlimination – «отщепление» ). В результате этой реакции образуется новое вещество, молекулы которого часто содержат кратную связь:
Классификация органических реакций
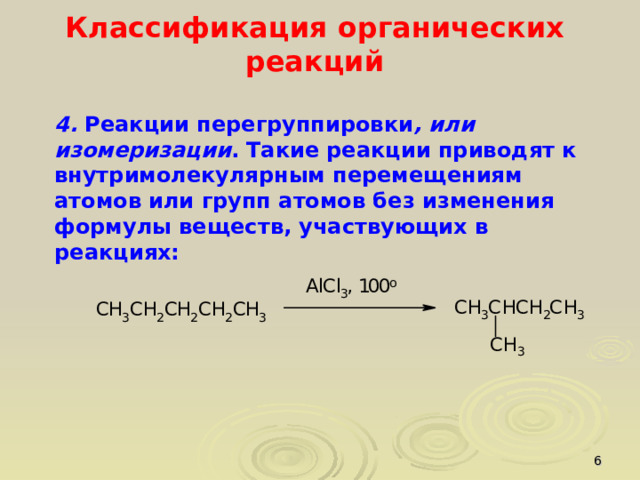
4. Реакции перегруппировки , или изомеризации . Такие реакции приводят к внутримолекулярным перемещениям атомов или групп атомов без изменения формулы веществ, участвующих в реакциях:

Классификация органических реакций
5. Реакции окисления и обратные им реакции восстановления . В результате этих реакций меняется степень окисления атома углерода, являющегося реакционным центром.
Степень окисления атома углерода соответствует числу его свзей с элементами более электроотрицательными, чем водород. Так, степень окисления атома углерода в метане СН 4 нулевая, в метиловом спирте СН 3 ОН – первая, в формальдегиде СН 2 =О – вторая, в муравьиной кислоте НСООН – третья, в оксиде углерода СО 2 – четвертая.
В окислительно-восстановительном процессе всегда участвуют два типа веществ: окислитель (соединение, принимающее электроны) и восстановитель (соединение отдающее электроны).

Классификация органических реакций
II. По механизму протекания органические реакции делят на следующие типы
1. Гомолитические , или радикальные , реакции идут с участием свободных радикалов – частиц с неспаренным электроном. Индекс R . Пример радикального замещения S R :

Классификация органических реакций
2. Гетеролитические , или ионные , реакции идут с участием ионов, а также частиц с неподеленной парой электронов или вакантной орбиталью, то есть нуклеофилов и электрофилов .

Классификация органических реакций
Если атакующая частица (реагент) является нуклеофилом , то говорят, что реакция нуклеофильная (обозначают индексом N ). Пример реакций нуклеофильного замещения S N
Классификация органических реакций
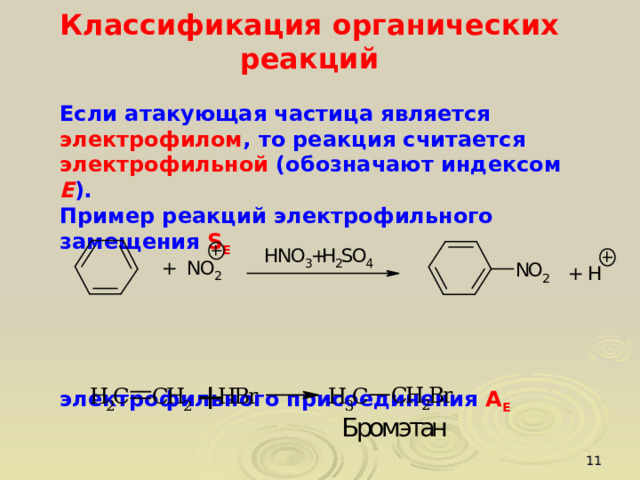
Если атакующая частица является электрофилом , то реакция считается электрофильной (обозначают индексом E ).
Пример реакций электрофильного замещения S E
электрофильного присоединения А Е

Реагирующие органические частицы
Нуклеофил – химическое соединение, способное быть донором электронной пары (дословно – «любящий, стремящийся к ядру», т. е. к положительному заряду). К нуклеофилам относятся все анионы и органические соединения с атомами, несущими неподеленные пары электронов.

Реагирующие органические частицы
Электрофил – химическое соединение, способное принимать на себя электронные пары (дословно – «любящий, стремящийся к электрону», т. е. к отрицательному заряду) . К электрофилам относятся все катионы и кислоты Льюиса – галогениды алюминия, железа, олова, цинка и сурьмы
H + , Li + , BF 3 , AlCl 3 , NO 2 + и др.

Реагирующие органические частицы
- Радикал – нейтральная частица, содержащая один или несколько неспаренных электронов
Взаимное влияние атомов в молекуле
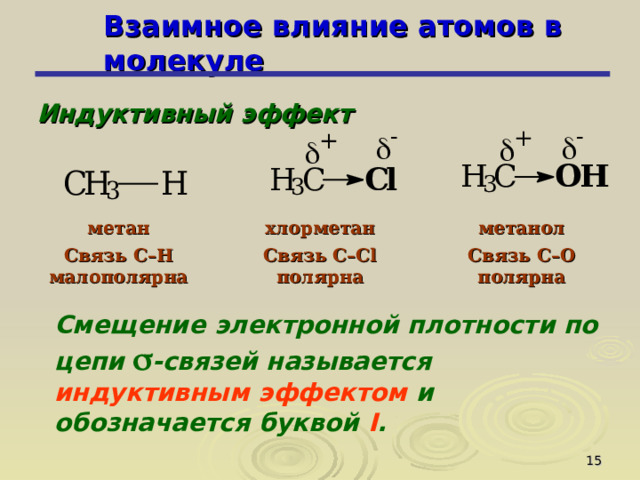
Индуктивный эффект
метан
Связь C–H малополярна
хлорметан
метанол
Связь C–Cl полярна
Связь C–O полярна
Смещение электронной плотности по цепи -связей называется индуктивным эффектом и обозначается буквой I .

Взаимное влияние атомов в молекуле
Индуктивный эффект
Электроноакцепторные заместители , т.е. атом или группа атомов, смещающие электронную плотность -связи от атома углерода, проявляют отрицательный индуктивный эффект ( -I-эффект ).
Электронодонорные заместители , т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект ( +I-эффект ).
 С= O, – COOH . пропен " width="640"
С= O, – COOH . пропен " width="640"
Взаимное влияние атомов в молекуле
Индуктивный эффект
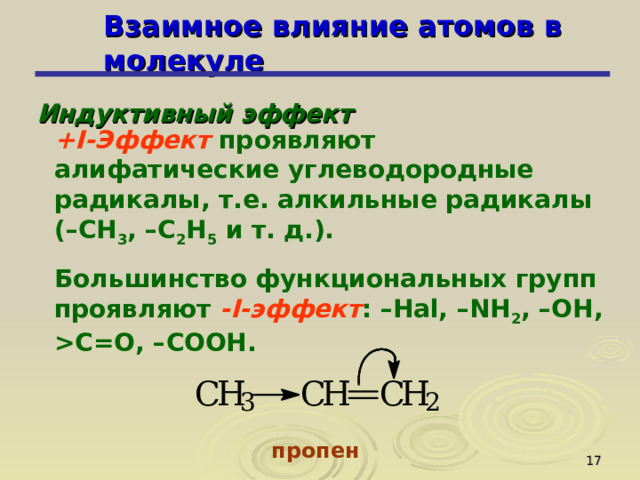
+ I -Эффект проявляют алифатические углеводородные радикалы, т.е. алкильные радикалы ( – CH 3 , –C 2 H 5 и т. д.).
Большинство функциональных групп проявляют - I -эффект : – Hal , – NH 2 , – OH , С= O, – COOH .
пропен

Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Мезомерный эффект (эффект сопряжения, резонансный эффект) является результатом перераспределения электронной плотности в сопряженных системах с участием π и n - орбиталей.
Этот эффект возникает за счет смещения π-электронного облака вдоль системы с образованием на противоположных концах такой системы, равных по величине, но различных по знаку частичных зарядов. Мезомерный может передаваться по цепи сопряжения на более дальние расстояния.

Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Мезомерный эффект ( M) – это электронные смещения в сопряженных системах с участием π - электронов кратных связей, неподеленных пар
электронов, вакантных орбиталей.
эффект сопряжения ( C) , резонансный эффект ( R) .
Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
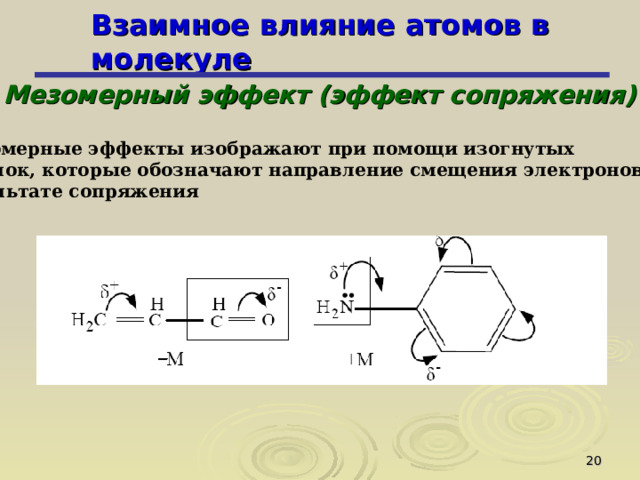
Мезомерные эффекты изображают при помощи изогнутых
стрелок, которые обозначают направление смещения электронов в
результате сопряжения

Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Вследствие сопряжения π - орбитали двойной связи с
n р -орбиталями фтора распределение электронной плотности в реальной молекуле винилфторида не такое, как показывает формула
СН 2 = СН - F. Делокализация электронов (резонанс) показана на схеме
Эта запись означает, что истинное распределение электронов является промежуточным между двумя граничными (резонансными, мезомерными, предельными) структурами. Граничные структуры являются лишь условными способами изображения, не отвечая действительному состоянию молекулы. Действительное состояние молекулы лежит где-то между изображенными с помощью предельных структур фиктивными крайними положениями. Именно это и выражает термин "мезомерия" (между частями). Смысл граничных структур подчеркивается с помощью двусторонней стрелки (↔), которую ни в коем случае нельзя путать со стрелками ( ), обозначающими равновесие.

Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Таким образом, альтернативными способами изображения мезомерного эффекта следует считать:
С помощью Резонансные (предельные) Резонансный
изогнутых стрелок структуры гибрид

Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Положительным мезомерным эффектом (+ М) обладают электронодонорные группы, способные к частичной или полной передаче пары электронов в общую сопряженную систему

Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Электроноакцепторные группы, поляризующие сопряженную систему в противоположном направлении, характеризуются отрицательным мезомерным эффектом (—М)

Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
Функциональные заместители, вызывающие мезомерный эффект
Отрицательный мезомерный
эффект (–М)
-NO 2 , -C≡N, -C(R)=O, -COOH,
-SO 3 H, -C + R2( карбкатионы )
Положительный мезомерный
эффект (+ М )
Галогены : F,Cl,Br,I; -OH, -OR,
-NH 2 , -NR 2 , -SH, -SR,
Взаимное влияние атомов в молекуле
Мезомерный эффект (эффект сопряжения)
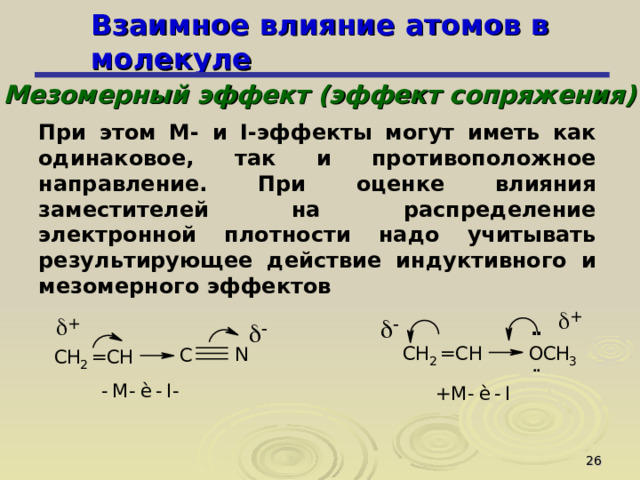
При этом М- и I -эффекты могут иметь как одинаковое, так и противоположное направление. При оценке влияния заместителей на распределение электронной плотности надо учитывать результирующее действие индуктивного и мезомерного эффектов























 С= O, – COOH . пропен " width="640"
С= O, – COOH . пропен " width="640"

























