
Кислородные
соединения
углерода

Напишите уравнения по схеме:
С---СаС2---С2Н2---СО2---СО
1
2
3
4
1) Са + 2C = CaC2
2) CaC2 + 2H2O = C2H2 + Ca(OH)2
3)2C2H2 + 5O2 = 4CO2 + 2H2O
4) CO2 +С = 2СО

Выберите из предложенных утверждений только те, которые справедливы: I вариант- для алмаза II вариант – для графита
- Прозрачный, бесцветный.
- Очень твердый.
- Ковалентная неполярная связь.
- Не проводит электрический ток.
- Используют как добавку в смазке.
- Непрозрачный, серого цвета, с металлическим блеском.
- Электропроводен.
- Атомная кристаллическая решетка.
- Легко расслаивается на отдельные мельчайшие пластинки.
- При обычных условиях химически инертен, при высокой температуре становится активным.
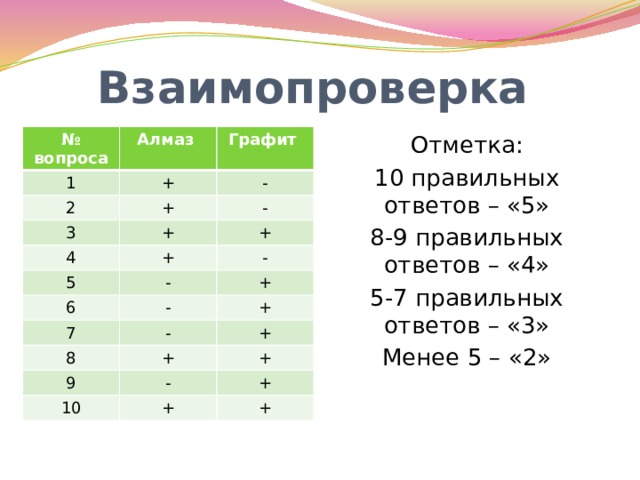
Взаимопроверка
Отметка:
10 правильных ответов – «5»
8-9 правильных ответов – «4»
5-7 правильных ответов – «3»
Менее 5 – «2»
№ вопроса
Алмаз
1
2
Графит
+
+
-
3
-
+
4
+
+
5
6
-
-
-
7
+
-
+
8
+
9
+
-
10
+
+
+
+
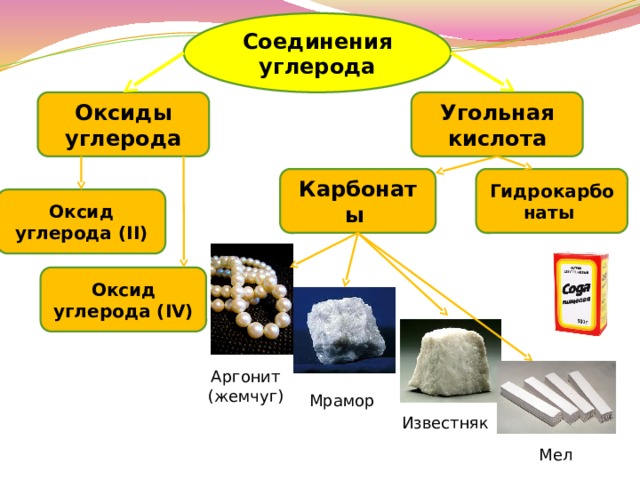
Соединения углерода
Оксиды углерода
Угольная кислота
Карбонаты
Гидрокарбонаты
Оксид углерода (II)
Оксид углерода (IV)
Аргонит
(жемчуг)
Мрамор
Известняк
Мел
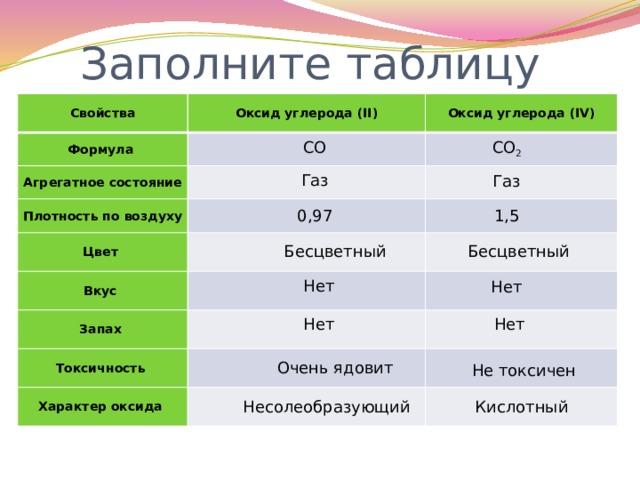
Заполните таблицу
Свойства
Оксид углерода (II)
Формула
Оксид углерода (IV)
Агрегатное состояние
Плотность по воздуху
Цвет
Вкус
Запах
Токсичность
Характер оксида
СО 2
СО
Газ
Газ
0,97
1,5
Бесцветный
Бесцветный
Нет
Нет
Нет
Нет
Очень ядовит
Не токсичен
Несолеобразующий
Кислотный

+2
CO
Оксид углерода (II)
Оксид углерода (II)
Угарный газ
Монооксид углерода
Несолеобразующий оксид
Без цвета
Без запаха
Чуть легче воздуха
Плохо р-м в воде
яд
Хороший восстановитель
(т.к. СО= +2)
0
+4
+2
2 СО + О2 = 2СО2
-2е
+4
+2
+3
0
Fe2O3 + 3 CO = 2Fe + 3 CO2
-6е

В.Ф. Одоевский «Мороз Иванович»
- « …а я затем в окошки стучусь,- отвечал Мороз Иванович,- чтобы не забывали печей топить, да трубы вовремя закрывать, а не то, ведь я знаю, есть такие неряхи, что печку истопить истопят, а трубу закрыть не закроют, да не вовремя, когда ещё не все угольки прогорели, а оттого в горнице угарно бывает, голова у людей болит, в глазах зелено, даже и совсем от угара помереть можно».

Получение СО
В промышленности оксид углерода (II) получают:
- Неполным сжиганием кокса:
2 С + 0₂ = ͭ 2 СО.
2. Пропусканием через раскаленный кокс водяного пара, при этом образуется смесь оксида углерода (II) с водородом — водяной газ:
С + Н₂О = ͭ СО + Н₂ водяной газ
или оксида углерода (IV): СO₂ + С = ͭ 2 СО .




Применяется оксид углерода (II) при производстве чугуна и метанола
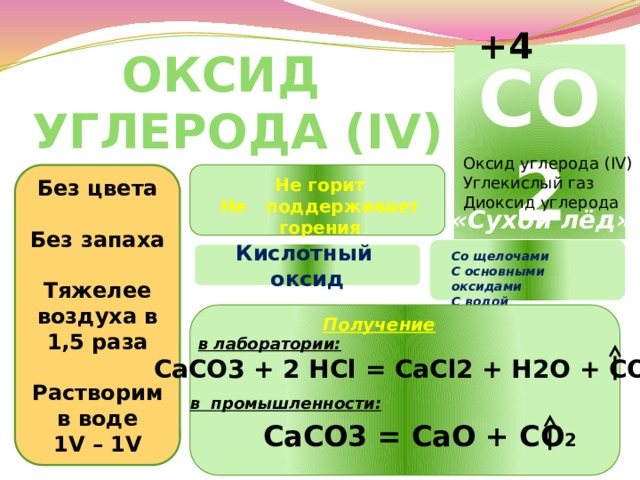
+4
Оксид углерода (IV)
CO2
Оксид углерода (IV)
Углекислый газ
Диоксид углерода
Без цвета
Без запаха
Тяжелее
воздуха в 1,5 раза
Растворим в воде
1V – 1V
Не горит
Не поддерживает
горения
«Сухой лёд»
Кислотный оксид
Со щелочами
С основными оксидами
С водой
Получение
в лаборатории:
СаСО3 + 2 HCl = CaCl2 + H2O + CO2
в промышленности:
CaCO3 = CaO + CO 2

Химические свойства
Оксид углерода (IV) — типичный кислотный оксид,
( взаимодействует со щелочами и основными оксидами, с водой):
1) 2 NaOH + С0 2 = Na 2 C0 3 + Н 2 0;
2 NaOH + С0 2 = NaНC0 3
Са(ОН) 2 + С0 2 = СаС0 3 ↓ + Н 2 0 .
Эта реакция является качественной на оксид углерода (IV).
2) СаО + С0 2 =ͭ СаС0 3 .
3) С0 2 + Н 2 0 ↔Н 2 С0 3 .
4) 2 Mg + СO₂ = ͭ 2 Mg0 + С
Карбонат натрия
Гидрокарбонат натрия (пищевая сода)
Карбонат кальция (Мрамор, мел, известняк)


Н2СО3
Угольная кислота
Нестойкая, разлагается:
СО2 + Н2О = Н2СО3
Н2СО3=СО2 + Н2О
Образует два типа солей:
средние
кислые
Na2CO3
NaHCO3
CaCO3
Ca(HCO3)2
карбонаты
гидрокарбонаты

карбонаты
гидрокарбонаты
CaCO3 + H2O + CO2 = Ca(HCO3)2
Ca(HCO3)2 = CaCO3 + H2O + CO2

На земле живут три брата Из семейства карбонатов. Старший брат – красавец Мрамор, Славен именем Каррары. Превосходный зодчий, он Строил Рим и Парфенон.

Всем известен Известняк, Потому и назван так. Знаменит своим трудом, Строит он за домом дом.

И способен, и умел Младший мягкий братец Мел. Как рисует, посмотри, Этот СаСО 3

Г. Р. Хаггард «Клеопатра»

- «…она вынула из уха одну из огромных жемчужин и …опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется в крепком уксусе. Вот от нее не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила весь до последней капли.»
(Г.Р. Хаггард. «Клеопатра»)

Сталактиты и сталагмиты

Наличие карбонатов и гидрокарбонатов в воде делает её жесткой. В ней плохо мылится мыло, на стенках чайников и паровых котлов образуется накипь
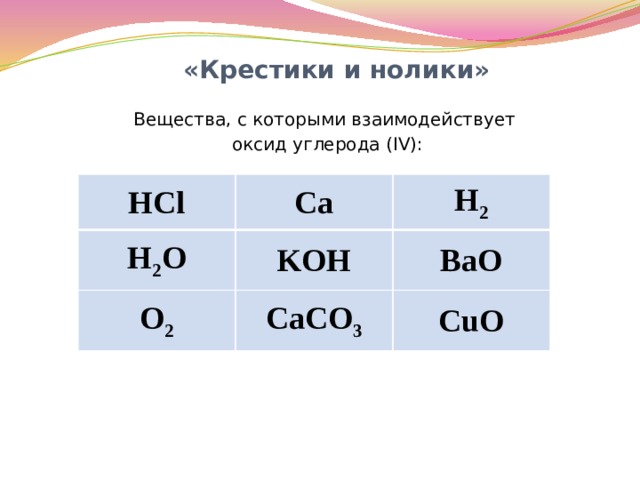
«Крестики и нолики»
Вещества, с которыми взаимодействует
оксид углерода (IV):
HCl
Ca
H 2 O
H 2
KOH
O 2
CaCO 3
ВаО
CuO

«Крестики – нолики»
Вещества, имеющие одинаковое значение степени окисления углерода:
CO 2
H 2 CO 3
СО
CaC 2
CH 4
Na 2 CO 3
Na 2 CO 3
Al 4 C 3
C 2 H 6

Домашнее задание
- § 30 упр. 1, 4, 5, 6
- составьте кроссворд
- Доклад «Жесткость воды»




















































