Исследовательская работа учителя химии и математики МБОУ СОШ с.Кадырово МР Илишевский район Республики Башкортостан Маликовой Ильсияр Хадитовны:
«Использование опорных схем
на уроках химии в средней общеобразовательной школе»
На сегодняшний день современное общество ставит перед школой задачу подготовки выпускников, которые способны ориентироваться в меняющихся жизненных ситуациях, самостоятельно приобретать необходимые знания, применять их на практике для решения разнообразных возникающих проблем. Задача учителя заключается в воспитании человека гармонично развитой личности.
В настоящее время в школьной практике применяется много новаций. Большинство современных образовательных технологий предполагает организацию на уроке активной деятельности учащихся на разных уровнях познавательной самостоятельности. Именно в этом заключается важнейшее условие реализации воспитательного потенциала современного урока – активная познавательная деятельность детей, особо востребованная в современном мире.
В свете введения ФГОС идея и опыт педагога-новатора В.Ф. Шаталова по использованию опорных сигналов приобретает особую актуальность.
Опорные сигналы - это схематическое изображение основных направлений изучаемой темы. Они позволяют каждому ученику уловить суть идеи, запомнить главное, которое складывается из частностей. Сейчас трудно представить, что законы и правила составления опорных сигналов, разработанные Шаталовым, прежде были неведомы школе.
В связи с вышесказанным, исследования в данной области знаний являются актуальными.
Цель работы: изучение и анализ различных методик по составлению и использованию опорных схем, способствующих повышению качества обучения химии.
Исходя из цели, поставлены следующие задачи:
1. Изучить литературу по теме исследования;
2. Исследовать различные методики по составлению и использованию опорных схем;
3. Разработать опорные схемы, используемые при объяснении нового материала и для решения расчетных задач.
4. Апробировать полученный материал в школьной практике.
Предмет исследования: использование опорных схем в школьной практике.
Объект исследования: процесс использования опорных схем при изучении конкретных тем школьного курса химии.
База исследования: БФ БашГУ, МБОУ СОШ с. Кадырово Илишевского района РБ.
Научная новизна исследования состоит в том, что изучена и проанализирована литература по исследуемой проблеме и составлены опорные схемы.
Практическая значимость исследования: разработка опорных схем, используемых на уроках школьного курса химии
Апробация и внедрение результатов исследования: результаты работы апробированы на базе муниципального общеобразовательного учреждения средняя общеобразовательная школа с. Кадырово Илишевского района Республики Башкортостан; результаты представлены в материалах научно-методической конференции «Инновационные технологии в преподавании дисциплин естественно-научного цикла в школе и ВУЗе 2013г.
Все люди когда-нибудь учились в школе. Поэтому каждый знает, как тяжело порой доходит до ума самая удивительная из наук - химия. В ней столько всего непонятного, с одной стороны, но в то же время интересного, поучительного и захватывающего, с другой стороны.
Например, принцип Ле Шателье. Сколько проблем он доставляет школьникам и учителям. Первым он непонятен, вторым он понятен, но как объяснить, чтобы у учащихся что-нибудь отложилось в памяти, а у учителя не получился очередной прокол в работе? Вопрос не из легких?
Ещё Конфуций говорил: «Я слышу – и забываю,
я вижу – и запоминаю,
я делаю – и понимаю».
Современные цифровые образовательные технологии позволяют создавать неповторимые схемы. Кроме того, важным является принцип неожиданности для удивления и восхищения ученика увиденным.
Рассмотрим опорные схемы при объяснении темы в 9 классе «Химическое равновесие. Условия смещения химического равновесия». Допустим, что химическое равновесие - чашечные весы, находящиеся в равновесии. Не правда ли очень просто?
На левой чаше находятся исходные вещества, а на правой - продукты реакции. 
Теперь рассмотрим влияние различных факторов на смещение химического равновесия.
1.Концентрация
Увеличение концентрации реагирующих веществ

Концентрация исходных веществ увеличилась, следовательно, левая чаша весов становится тяжелее, смещение – в сторону продуктов реакции.
1.2.Повышение концентрации продуктов реакции

Концентрация продуктов реакции увеличилась, следовательно, правая чаша весов становится тяжелее, смещение химического равновесия – влево.
C понижением концентрации все происходит наоборот.
A+B=C+D+Q-экзотермическая реакция
Повышение температуры экзотермической реакции

Мы «добавляем» теплоту в правую чашу весов, она становится тяжелее,
смещение в сторону исходных веществ.
Понижение температуры экзотермической реакции

Мы «отводим» теплоту с правой чашки весов, она становится легче,
В случае эндотермической реакции происходит наоборот.
3. Давление
N2 (г )+3H2( г )↔2NH3(г)
1V+3V↔2V
4V ↔2V
↔2V
Повышение давления
4 V

2V
Повышение давления приводит к уменьшению объема, следовательно, реакция будет идти в сторону уменьшения объема, т.е. вправо.
Понижение давления
4V
2V

Понижение давления приводит к увеличению объема, следовательно, реакция будет идти в сторону увеличения объема.
Давление не влияет на смещение химического равновесия, если объемы в правой и левой частях одинаковы.
Задачи на закрепление:
Задача1. В какую сторону сместится равновесие при увеличении температуры:
CaCO3(т) ↔ CaO(т) + CO2(т) – Q
2CO(г) + O2(г) ↔ 2CO2(г) + Q
2SO2(г) + O2(г) ↔ 2SO3(г) + Q
C4H10 (г) ↔ C4H6(г) + 2H2(г) -Q
а) 2H2S(г) + 3O2(г) = 2H2O(г) + 2SO2(г)
б) 2H2(г) + O2(г) = 2H2O (г)
в) H2(г) + I2(г) = 2HI (г)
г) SO2(г) + CL2(г) = SO2CL2(г)
Задача 2. Укажите, как повлияет увеличение концентрации кислорода на равновесие системы:
2CO (г) + O2 (г) ↔ 2CO2 (г) + Q
Задача 3. В какой системе увеличение концентрации водорода смещает химическое равновесие влево?
1) 
2) 
3) 
4) 
Задача 4. Верны ли следующие суждения о смещении химического равновесия в системе 
А. При увеличении температуры химическое равновесие в данной системе сместится
в сторону продуктов реакции.
Б. При уменьшении концентрации углекислого газа равновесие системы сместится в сторону продуктов реакции.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Задача 5. Равновесие  смещается в сторону исходных веществ при
смещается в сторону исходных веществ при
1) уменьшении давления
2) нагревании
3) введении катализатора
4) добавлении водорода
Задача 6.
Условие. Для смещения равновесия в сторону продуктов реакции:
C2H5OH + CH3COOH = CH3COOC2H5 +H2O-Q нужно:
Решение: В первом, втором и третьем случаях мы как бы «добавляем» в правую чашу весов, поэтому смещение – в сторону реагентов. В случае 4)-добавляем теплоту и левая чаша весов перевесит.
Ответ: 4
Задача 7.
Условие. Укажите, как повлияет:
1) повышение давления;
2) повышение температуры;
3) увеличение концентрации кислорода на равновесие системы:
2CO (г) + O2 (г) ↔ 2CO2 (г) + Q
Решение:
Считаем объемы только газов
3 V 2V - cмещение вправо в сторону меньшего объема
V 2V - cмещение вправо в сторону меньшего объема
Смещение будет в сторону эндотермической реакции, т.е. влево
Кислород - реагент, поэтому левая чаша весов становится тяжелее- смещение влево.
При таком подходе к изучению нового материала и его закреплению принцип Ле-Шателье становится более доступным для понимания.
Расчетные задачи в школьном курсе химии выполняют множество функций: они развивают рациональный образ мышления, самостоятельность учащихся, позволяют реализовать межпредметные связи, способствуют закреплению полученной на уроках информации, и следовательно, дают возможность учителю не только проверить знания учащихся, но и оценить стиль их мышления и творческие способности.
В 8 классе трудно даются задачи на вычисление. Для решения задач предлагаю «волшебные треугольники», которые помогают учащимся не запоминать, а выводить формулы для вычислений.
Изучение школьных предметов нельзя воспринимать разрозненно. Весь учебный процесс – это постоянная взаимосвязь знаний разных областей с целью более глубокого изучения различных тем. Математика может оказать химии помощь при расчётах, подтвердить выводы, полученные теоретически.
Имея основное базовое образование учителя физики и математики, преподаю уроки математики в старших классах. Поэтому при изучении некоторых тем я применяю интегрированные уроки химии и математики. Задачам, связанным с расчетом концентрации раствора, большое значение уделяется в ГИА и на ЕГЭ . Наконец, эти расчеты могут пригодиться и в быту. Эти задачи можно решить используя соответствующую формулу и используя знания о составлении пропорции.
Так, много лет использую рисунки при решении задач на растворы. Идея не моя, но замечательная. Была опубликована в журнале “Химия в школе”. Я ее изменила и применяю по-своему. Эти задачи в таком же виде есть на ЕГЭ по математике в В11. Рассмотрим в 11 классе тему «Решение задач на растворы». Я предлагаю совсем другой способ решения задач на эту тему.
1. Смешение растворов разной концентрации или сплавы:
| mв1 |
| mв2 | 
| mв3 |
| mр1 | mр2 | mр3 |
| W1 | W2 | w3 |
mв3 = mв1 + mв2
mр3 = mр1 + mр2
wв3= mв3 / mр3
Если добавляют кристаллогидрат, то это тоже раствор, надо только вычислить массовую долю растворенного вещества.
Зная формулу для массовой доли растворенного вещества, задачи можно решить прямо на схеме.
Задачи такого типа можно решить с помощью «метода стаканов». Имеются 2 стакана с растворами разной концентрации. Мысленно стакан разделим на три части:
1-массовая доля растворенного вещества
2-масса раствора
3-масса растворенного вещества.
Как видно из схемы, при смешении стаканов с растворами массы растворов складываются, также складываются массы веществ. Чтобы найти массовую долю растворенного вещества (3) третьего стакана, нужно найти отношение массы вещества (3) к массе раствора (3).
Задача 1. Даны два куска с различным содержанием олова. Первый, массой 300 г, содержит 20% олова, Второй, массой 200 г, содержит 40% олова. Сколько процентов олова будет содержать сплав, полученный из этих кусков?
|
|
|
| 
| |
| 300 | 200 |
|
| 0,2 | 0,4 | w3 |
| 60 |
| 80 | 
| 140 |
| 300 | 200 | 500 |
| 0,2 | 0,4 | w3 |
Ответ. 28%.
Задача 2. Сколько надо взять 5 %-го и 25 %-го раствора кислоты, чтобы получить 4 л 10 %-го раствора кислоты?
| 0,05х |
| 0,25*(4-х) | 
| 0,4 |
| Х | (4-х) | 4 |
| 0,05 | 0,25 | 0,1 |
Составляем и решаем уравнение 0,05х+0,25*(4-х)=0,4
0,20х=0,6
Х=3
Ответ. 3 л первого и 1 л второго.
Задача 2. Имеется 2 раствора поваренной соли разной концентрации. Если слить вместе 100г первого раствора и 200г второго раствора, то получится 50%-ный раствор. Если же слить вместе 300г первого раствора и 200 г второго, то получится 42%-ный раствор. Найти концентрацию второго раствора.
| 100x |
| 200 y | 
| 150 |
| 100 | 200 | 300 |
| х | Y | 0,5 |
| 300x |
| 200 y | 
| 210 |
| 300 | 200 | 500 |
| х | Y | 0,42 |
Решаем систему уравнений:
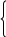 100х+200y=150
100х+200y=150
300х+200y=210
200х=60
х=0,3=30%
y=0,6=60% Ответ. 60%
2. Разбавление раствора водой
| mв1 |
| | 
| mв1 |
| mр1 | mводы | mр1+ mводы |
| W1 |
|
|
| w2 |
mР2 = mр1+ mводы
w2= mв1 / mр1+ mводы
Задача. К 15% раствору, масса которого 80г, добавили 30г воды. Какой стала массовая доля растворённого вещества в полученном растворе?
w2 =12/80+30=0,109=10,9%
3. Добавление твердого вещества
| mв1 |
| mсоли | 
| mв1+ mсоли |
| mР1 | | mР1+ mсоли |
| W1 |
|
|
| w2 |
mВ2= mв1 + mсоли
mР2= mР1+ mсоли
w2= mв1 + mсоли / mР1+ mсоли
Задача . Сколько граммов хлорида натрия надо добавить к 200 г. 10%-ного раствора, чтобы получить 20%-ный раствор?
| 20 |
| mсоли | 
| 20+ mсоли |
| 200 | | 200+ mсоли |
| 0,1 |
|
|
| 0,2 |
0,2*(200+ mсоли )= 20+ mсоли
40+0,2 mсоли =20+ mсоли
0,8 mсоли=20 mсоли =25
Ответ: 25 г.
Наконец, задача из ЕГЭ, которая есть и по химии и по математике:
Условие. Смешав 40 % и 15 % растворы кислоты, добавили 3 кг чистой воды и получили 20 % раствор кислоты. Если бы вместо 3 кг воды добавили 3 кг 80 % раствора той же кислоты, то получили бы 50 %-ный раствор кислоты. Сколько килограммов 40 % -го и 15 % растворов кислоты было смешано?
Решение: Для решения задачи можно нарисовать стаканы:
| 0,4х |
| 0,15у | - | 
| 0,4х+0,15у |
| х | У | 3 | х+у+3 |
| 0,4 | 0,15 |
| 0,2 |
| 0,4х |
| 0,15у | 2,4 | 
| 0,4х+0,15у+2,4 |
| Х | у | 3 | х+у+3 |
| 0,4 | 0,15 | 0,8 | 0,5 |
З атем получаем систему уравнений:
атем получаем систему уравнений:
0,4х+0,15у=0,2*(х+у+30),
0,4х+0,15у+0,8*3=0,5*(х+у+3)
Решаем систему уравнений и получаем:
х=3,4
у=1,6
Ответ:3,4 кг 40 % кислоты и 1,6 кг 15 % кислоты.
Как и во всех науках, в математике и в химии нет прописных истин и «царских дорог». К решению каждой задачи надо подходить творчески.
Когда показываю этот метод детям, они в восторге. Особенно, если до этого пытались разобрать правило креста. Я этот метод и сама не использую и детей не учу. Вышеизложенный метод – просто прелесть. Никогда не подводил и легко запоминается.
Решение любой задачи я советую детям начинать с анимации, пусть даже с помощью рисунков. Моя любимая фраза: «Пока вы не научитесь представлять задачи, вы не научитесь их решать».
Всем знакомо правило: «Бесталанных нет, а есть занятые не своим делом». Использование метода опорных схем даёт возможность не только успевающим, но и слабым ученикам использовать свои сильные стороны. 

 Схемы помогают экономить время на уроке, слабые учащиеся приобретают уверенность в себе. Опорные схемы положительно влияют на обучение всех учащихся, особенно тех, которые испытывают затруднения. Используя ОС, я пришла к выводу, что они позволяют повысить эффективность обучения за счет того, что учащиеся стремятся к поиску общей картины и смысла явлений, т.е. формированию восприятия любой информации в целостности. Они развивают зрительную память и учат применять свои знания и умения на практике, они помогают привить интерес к обучению, дают возможность поверить в себя.
Схемы помогают экономить время на уроке, слабые учащиеся приобретают уверенность в себе. Опорные схемы положительно влияют на обучение всех учащихся, особенно тех, которые испытывают затруднения. Используя ОС, я пришла к выводу, что они позволяют повысить эффективность обучения за счет того, что учащиеся стремятся к поиску общей картины и смысла явлений, т.е. формированию восприятия любой информации в целостности. Они развивают зрительную память и учат применять свои знания и умения на практике, они помогают привить интерес к обучению, дают возможность поверить в себя.
Образовательная технология интенсификации обучения на основе схемных и знаковых моделей учебного материала, использованная мной при подготовке учащихся к ЕГЭ, - это всего лишь один из многочисленных вариантов, позволяющий организовать процесс подготовки учащихся к ЕГЭ с целью добиться результатов, удовлетворяющих как учителя, так и ученика.
В результате такой работы в классе создаётся чёткий, единый темп работы, который задается самими же учащимися: каждый становится организатором труда одноклассников, повышается интерес к учению.
Выпускники 11 класса из года в год успешно сдают экзамен за курс средней школы, демонстрируют прочные знания по предмету, выходящие за рамки школьной программы. Средний балл по школе превышает средний балл по району и республике.










 ↔2V
↔2V

 V 2V - cмещение вправо в сторону меньшего объема
V 2V - cмещение вправо в сторону меньшего объема
 100х+200y=150
100х+200y=150 атем получаем систему уравнений:
атем получаем систему уравнений:

















