Урок №41 8 класс «____»_____20____г.
Тема. Амфотерные оксиды и гидроксиды. Л.О.№4 Получение осадков нерастворимых гидроксидов и изучение их свойств.
Цель урока: раскрыть понятие «амфотерность», показать двойственный амфотерный характер оксидов и гидроксидов.
Задачи:
Образовательные: повторить и углубить знания об оксидах и основаниях; дать понятие «амфотерность».
Развивающие: развивать навыки составления уравнений химических реакций с участием амфотерных соединений; показать условность деления гидроксидов на кислоты и основания.
Воспитательные: формирование познавательного интереса к предмету.
Планируемые результаты обучения
Предметные. Уметь экспериментально доказывать амфотерный характер оксидов и гидроксидов.
Метапредметные. Развивать умения соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, формулировать выводы.
Личностные. Формировать ответственное отношение к учению, коммуникативную компетентность в общении со сверстниками и учителем.
Основные понятия. Амфотерные оксиды и гидроксиды.
Оборудование и материалы: Периодическая система химических элементов Д. И. Менделеева, таблица растворимости; растворы соли цинка, щелочи, кислоты; штативы с пробирками.
Тип урока: комбинированный
ХОД УРОКА
Организационный этап (проверка готовности класса к уроку) 1—2 мин
Актуализация опорных знаний 10 мин
Какие вещества называются оксидами? Оксиды — это бинарные соединения, состоящие из двух химических элементов, один из которых — кислород в с. о. —2. Общая ф-ла RxOy
Кто такие гидроксиды? Сложные вещества, в состав которых входят атомы металла и гидроксогруппа ОН. Общая ф-ла Ме(ОН) п
Какими химическими свойствами обладают оксиды?
Какими химическими свойствами обладают гидроксиды?
Выполним задание на с.145 №4


Какое химическое свойство является наиболее характерным для оснований? (Взаимодействие с кислотами.)
Мотивация
Посмотрите на два эти рисунка Что общего? АМФОРА и АМФИБИЯ
Греч. «амфо» - двоякий, двойной
Амфора – древнегреческий сосуд с двумя ручками
Амфибии – земноводные животные
Возникает вопрос, а при чем здесь химия? Может уже кто-то догадался?
Сегодня на уроке мы и попытаемся в этом разобраться. Сформулируем тему и цель нашего урока.
Эпиграфом к уроку хочу взять слова Д Хевеши
Мыслящий ум не чувствует себя счастливым,
пока не удается связать воедино,
разрозненные факты, им наблюдаемые
Изучение нового материала 20 мин
Что такое амфотерность? Это способность химического вещества проявлять как кислотные, так и основные свойства, в зависимости от условий реакции.
Вещества, проявляющие амфотерные свойства элементы А-групп Периодической системы - Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., большинство элементов Б-групп - Cr, Mn, Fe, Zn, Cd, Au и др
Познакомимся с некоторыми физическими свойствами оксидов и гидроксидов.
Fe2O3 - твердое вещество, имеющее красно-коричневый цвет. В природе встречается в виде минерала гематита.
Al2O3 - твердое вещество белого цвета. В природе его часть можно встретить в виде глинозема, а также сапфира и рубина.
ZnO - твердое вещество, не имеющее цвета, в воде не растворяется.
Использование:
Fe(OН)2 - гидроксид железа (бесцветное твердое вещество) в изготовлении аккумуляторов;
Al(OН)3- гидроксид алюминия — для очистки воды;
Ве(ОН)2 -гидроксид бериллия — для получения оксида.
Работа с учебником с. 147 Лабораторный опыт №4
Тема. Получение осадков нерастворимых гидроксидов и изучение их свойств.
Как можно получить в лаборатории нерастворимое основание, например гидроксид магния или гидроксид цинка? 2NaOH + ZnCl2 - 2NaCl + Zn(OH)2 (белый осадок)
Какими свойствами обладают нерастворимые основания?
1) Zn(OH)2 +2НС1 - ZnCl2 +2Н2О
2) Zn(OH)2 + 2NaOH - Na2ZnО2 + 2Н2О
Гидроксид цинка взаимодействует и с кислотами, и с основаниями. Такие гидроксиды (и оксиды) называются амфотерными, они обладают свойствами кислот и оснований. Приставка амфо говорит о двойственности свойств.
Для лучшего понимания можно написать формулу гидроксида цинка таким образом: H2ZnО2.
Тогда H2ZnО2 + 2NaOH - Na2ZnO2 + 2Н2О
3) ZnO + 2HC1 = ZnCl2 + H2О
4) ZnO + 2KOH = K2ZnО2 + H2О идет при сплавлении реагирующих веществ
Подведение итогов урока 10 мин
Используя прием «Один ум – хорошо, а два – лучше» будем работать в паре. Перед вами карточка- таблица с заданиями. Вам необходимо проставить знак + где происходит реакция.
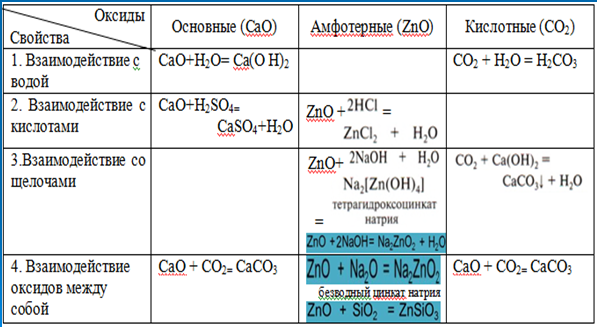
Откройте учебник §43 ст. 146 и продолжайте заполнять таблицу для амфотерных оксидов
Домашнее задание 1 мин §43используя ст. 146 напишите уравнения для Al, тестовые задания.
Рефлексия 2 мин. Продолжите фразу:





























