
Мавзу: УГЛЕВОДОРОДЛАР
Углеводородлар деб углерод ва водороддан ташкил топган органик бирикмаларга айтилади. Углерод-углерод орасидаги боғланишнинг характери ва углерод билан водородлар миқдорий нисбатига қараб улар тўйинган ва тўйинмаган углеводородларга бўлинади.

- Тўйинган углеводородлар – АЛКАНЛАР
С n H 2n + 2 - умумий формуласи
- Тўйинмаган углеводородлар
АЛКЕНЛАР АЛКИНЛАР АЛКАДИЕНЛАР
С n H 2n , С n H 2n - 2

Маъруза режаси
- Алканлар, уларнинг номланиши ва изомерияси
- Алканларнинг олиниш усуллари
- Кимёвий хоссалари
- Алканларнинг ишлатилиши
- Айрим вакиллари.

Алканлар -
- Тўйинган углеводородлар деб углерод қўшни углерод атомлари билан боғланишга ўзининг фақат бир валентлигини сарфлаб, қолганлари водород атомлари билан боғланган бирикмаларга айтилади. Углероднинг ҳамма атомлари sp3-гибридланган ҳолатда бўлади .
- С n H 2n+2 умумий формулага мувофиқ келадиган барча органик моддалар алканлар дейилади. Бу ерда n = 1, 2, 3, 4 ... бутун сонларни қабул қилади.

Гомологик қатор – Битта умумий формулага мувофиқ келадиган органик моддалар қаторига гомологик қатор дейилади ва улар бир-бирига гомолог ҳисобланади.
СН 4 – метан СН 4
С 2 Н 6 – этан СН 3 – СН 3
С 3 Н 8 – пропан СН 3 – СН 2 – СН 3
С 4 Н 10 – бутан СН 3 – СН 2 – СН 2 – СН 3
С 5 Н 12 – пентан СН 3 – СН 2 – СН 2 – СН 2 – СН 3
С 6 Н 14 – гексан СН 3 – (СН 2 ) 4 – СН 3
С 7 Н 16 – гептан СН 3 – (СН 2 ) 5 – СН 3
С 8 Н 18 – октан СН 3 – (СН 2 ) 6 – СН 3
С 9 Н 20 – нонан СН 3 – (СН 2 ) 7 – СН 3
С 10 Н 22 – декан СН 3 – (СН 2 ) 8 – СН 3
С 11 Н 24 – ундекан СН 3 – (СН 2 ) 9 – СН 3
С 12 Н 26 – додекан СН 3 – (СН 2 ) 10 – СН 3
С 15 Н 32 – пентадекан ва х.к.
– СН 2 – гуруҳи гомологик фарқ дейилади

Алканлар изомерияси
Алканларда бир хил – тузилиш (углерод скелет ёки структура) изомерияси кузатилади.
- С n H 2n+2 формулада 1,2 ва 3 га тенг бўлган углеводородлар учун фақат битта тузилиш формулалари мавжуд
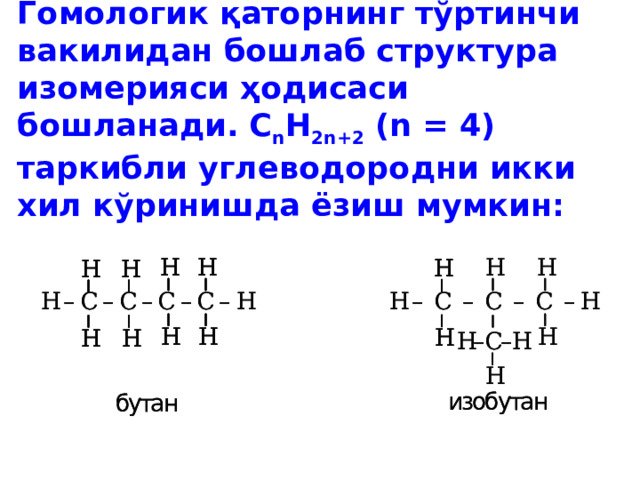
Гомологик қаторнинг тўртинчи вакилидан бошлаб структура изомерияси ҳодисаси бошланади. С n H 2n+2 (n = 4) таркибли углеводородни икки хил кўринишда ёзиш мумкин:
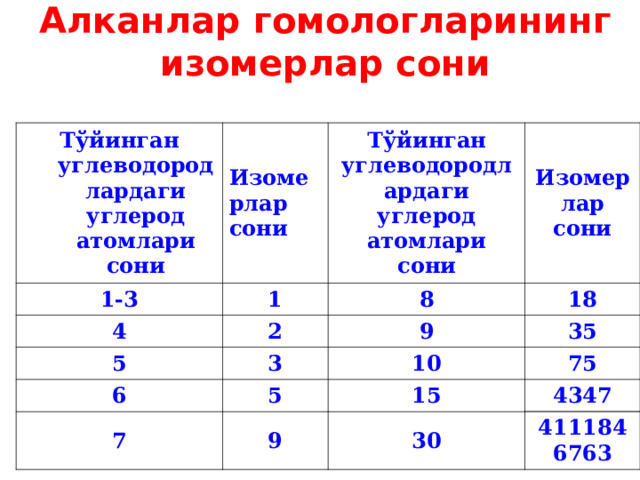
Алканлар гомологларининг изомерлар сони
Тўйинган углеводородлардаги углерод атомлари сони
Изомерлар сони
1-3
1
Тўйинган углеводородлардаги углерод атомлари сони
4
Изомерлар сони
8
2
5
3
18
9
6
7
5
35
10
75
9
15
4347
30
4111846763

НОМЕНКЛАТУРА
Органик бирималарни номлаш – номенклатура деб аталади
Органик кимёда уч хил –
1. Эмперик (тарихий, тасодифий);
2. Рационал;
3. Систематик номенклатуралардан фойдаланилади.

I. Эмпирик (тарихий, тасодифий) номенклатура
Органик бирималарни табиий бирикмалардан нималарда учраши, (лимон кислотаси, вино спирт, сирка кислотаси, ёғоч спирти ва х.к.) асос қилиб олинган. Кўпчилик ҳолларда бу номлар тасодифий бўлиб, хеч қандай маънога эга бўлмаслиги ҳам мумкин (метан, этан, ацетон ва х.к.).

Рациональ номенклатура
Органик бирикмаларни бу номенклатура бўйича номлаганда ҳар бир синф бирикмаларининг биринчи (альдегид ва кислоталарда иккинчи) вакили асос қилиб олинади. Қолганлари эса бу биринчи вакилининг ҳосиласи деб қаралади.
Тўйинган углеводородларнинг биринчи вакили метан бўлганлиги учун қолганлари унинг ҳосиласи деб қаралади. Масалан :

Систематик номенклатура
Бу номенклатуранинг асосий принциплари 1892 йилда Женевада кимёгарлар съездида қабул қилинган. Н оменклатурага 1957 ва 1965 йилларда амалий ва назарий кимё бўйича Ҳалқаро кимёгарлар иттифоқининг (ИЮПАК) Парижда бўлган съездларида қўшимчалар ва ўзгартиришлар киритилди.
Органик моддаларни систематик номенклатура бўйича номлашда радикаллардан фойдаланилади.

Тўйинган бир валентли радикаллар
- Радикаллар СnH2n+1 умумий формула билан ифодаланади ва R ҳарфи билан белгиланади

У зун тўғри углеводород занжири танлаб олинади. Сўнгра кичик радикал яқин турган томондан бошлаб бу занжар рақамлар билан рақамланади ва радикаллар ҳолати, ҳамда номи кўрсатиб тўғри занжар ўқилади. Масалан:

Углеводородларнинг олиниш усуллари
Углеводородларни олинишини 3 та асосий турга бўлиш мумкин
- Табиий бирикмалардан ажратиб олиш.
Тўйинган углеводородларни С 11 Н 24 гача бўлганлари нефтдан ва уни қайта ишлаш маҳсулотларидан, табиий газ, тоғ муми, газоконденсатдан олинади.

- Саноат усули. Саноатда тўйинган углеводородларни СО ва водороддан, нефтни крекинлаб, тўйинмаган углеводородларга водород бириктириб олиш мумкин.
Катализатор сифатида СuO, Cr 2 O 3 ва бошқалар ишлатилганда водородни бирикиш жараёни босим остида олиб борилади

- Алканларни лаборатория шароитида олишнинг бир неча усуллари ишлаб чиқилган . Галоген алканларни водород билан каталитик қайтариб олиш. Бунда водород Pd, Pt, ёки Ni металлари юзасида ютилиб қўзғалган (фаол) ҳолатга ўтади.

- Йодли ҳосилаларини водород йодид билан қайтариб ҳам олиш мумкин:
- Карбон кислоталарнинг натрийли ёки калийли тузларини ўювчи ишқорлар билан қиздириш орқали ҳам олиш мумкин (Кольбе реакцияси):
Бу реакция декарбоксиллаш реакцияси дейилади

- Немис олими Вюрц кашф этган усул. Галогенли ҳосилалар (галоид алкиллар)га натрий металли таъсир эттириш .
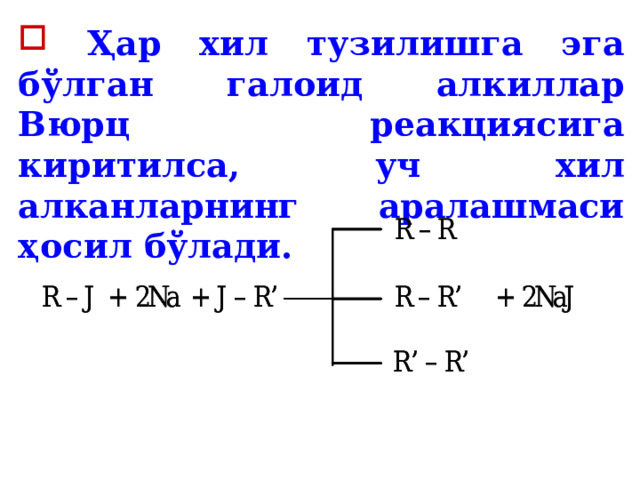
- Ҳар хил тузилишга эга бўлган галоид алкиллар Вюрц реакциясига киритилса, уч хил алканларнинг аралашмаси ҳосил бўлади.

- Вюрц реакцияси механизмини рус олими П.П. Шаригин ўрганган. Реакция икки босқичда боради:
Натрий металли ўрнига литий, рух, магний каби металлардан ҳам фойдаланиш мумкин.

- Алканлар металл карбидларига сув таъсир эттириб, карбон кислоталар ва уларнинг тузлари эритмаларини электролиз қилиб, металл орагник бирикмалардан ҳам олинади.

Физик хоссалари
- Дастлабки вакиллари газсимон, С 5 Н 12 дан С 16 Н 34 гача суюқлик, С 16 Н 34 дан бошлаб эса қаттиқ моддалар.
- Молекуляр массалари ортиб бориши билан қайнаш ва суюқланиш ҳароратлари, зичлиги, нур синдириш кўрсаткичи ортиб боради. Тўғри занжирли углеводородлар тармоқланган занжирли изомерларига нисбатан юқори ҳароратда қайнайди.
- Алканлар сувда жуда кам эрийди.

- Углерод-углерод орасидаги боғланиш узунлиги
- У льтрабинафша нурланиш тўлқинларини 200 нм дан кичик соҳаларда ютади.
- Инфрақизил спектрда 2800-3000 см –1 да – С–Н боғланишнинг валент тебранишлари ва 1380-1470 см –1 да эса деформация тебраниши характерлидир.
- ЯМР-спектрларида (ядро-магнит резонанси) алканлардаги турли протонлар 0,5-2,0 м.д. ўртасида ютилишни намоён қилади.

Кимёвий хоссалари.
Алкан лар кимёвий жиҳатдан деярли инерт б ўлиб, тегишли шароит яратилганда парчаланиш ва алмашиниш реакция ларига киришди.
Алканларга кимёвий инерт бўлгани учун парафинлар дейилади. Парафин – грек тилидан олинган бўлиб, хоссага ларидан махрум маъносини беради.
Оддий шароитда алканларга конц. м и нерал кислота ва оксидловчилар таъсир этмайди (HNO 3 , H 2 SO 4 , KMnO 4 ).
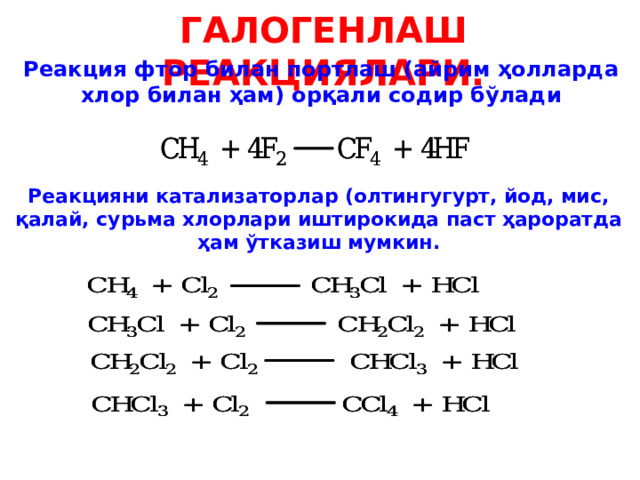
ГАЛОГЕНЛАШ РЕАКЦИЯЛАРИ.
Реакция фтор билан портлаш (айрим ҳолларда хлор билан ҳам) орқали содир бўлади
Реакцияни катализаторлар (олтингугурт, йод, мис, қалай, сурьма хлорлари иштирокида паст ҳароратда ҳам ўтказиш мумкин.
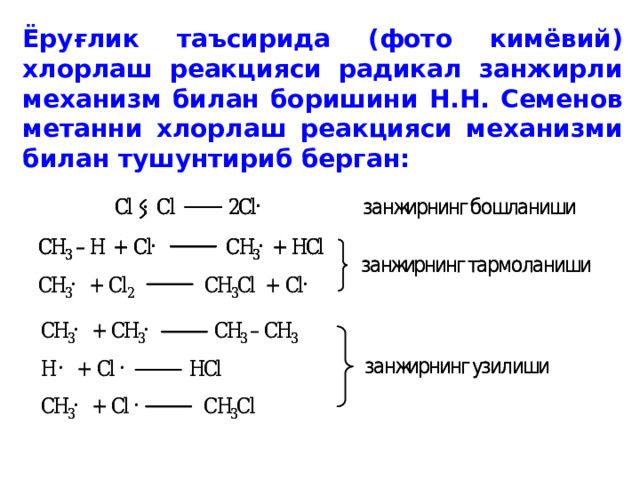
Ёруғлик таъсирида (фото кимёвий) хлорлаш реакцияси радикал занжирли механизм билан боришини Н.Н. Семенов метанни хлорлаш реакцияси механизми билан тушунтириб берган:

Бромлаш реакцияси хлорлашга қараганда осон ва мақсадга мувофиқ йўналишда боради.

Алканларни катализаторлар – Льюисни протонсиз кислоталари (АlСl 3 , F eСl 3 , Z nСl 2 ва х.к.) иштирокида хлорлаш занжирли ион механизми бўйича содир бўлади:

Алканларнинг галогенли (айниқса, фторли ва хлорли) ҳосилалари арзон саноат маҳсулотлари – эритувчилар, органик синтез учун хом ашёлар ва бошқалар сифатида ишлатилади.

Сулфохлорлаш ва сулфооксидлаш.
Алифатик сулфокислоталарнинг аҳамияти катта. Булар сулфохлорлаш ва сулфооксидлаш реакциялари ёрдамида олинади:
а) сульфохлорлаш
б) сульфооксидлаш

Сулфохлорлаш реакцияси радикал занжирли механизм билан содир бўлади:
Алкансулфокислоталар ва сулфохлоридлар саноатда синтетик ювувчи воситалар, сирт актив моддалар олишда ишлатилади.
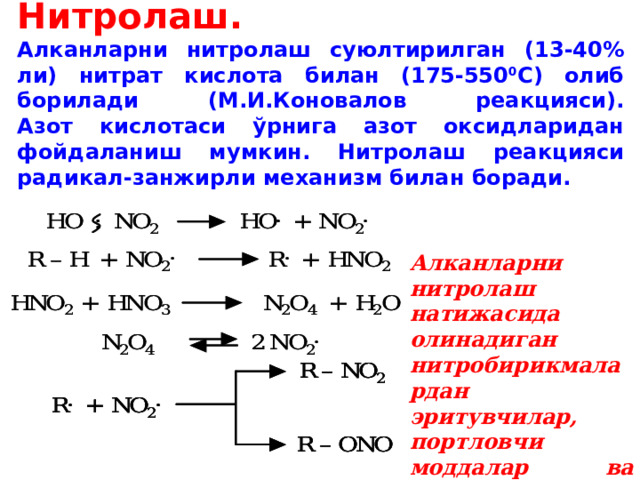
Нитролаш. Алканларни нитролаш суюлтирилган (13-40% ли) нитрат кислота билан (175-550 0 С) олиб борилади (М.И.Коновалов реакцияси). Азот кислотаси ўрнига азот оксидларидан фойдаланиш мумкин. Нитролаш реакцияси радикал-занжирли механизм билан боради.
Алканларни нитролаш натижасида олинадиган нитробирикмалардан эритувчилар, портловчи моддалар ва бошқалар сифатида фойдаланилади.

Оксидлаш.
Алканларга оксидловчилар оддий шароитда таъсир этмайди. Юқори ҳароратда эса улар углерод-(IV)-оксидгача оксид лана ди.

Алкан ларни оксидлаш вақтида оралиқ маҳсулот сифатида гидропероксидлар ҳосил бўлади. Улар юқори ҳароратда оксидланаётган алкан лар билан турли кислородли бирикмалар ҳосил қилади.
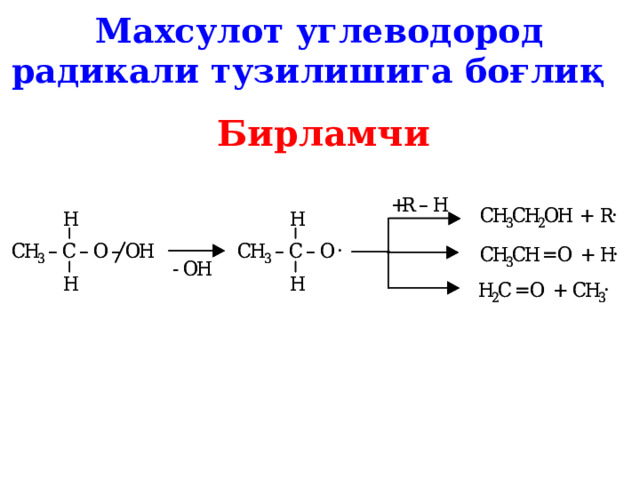
Махсулот углеводород радикали тузилишига боғлиқ
Бирламчи
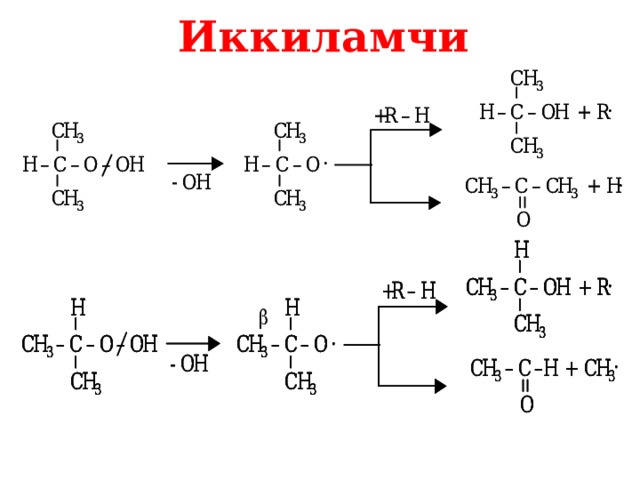
Иккиламчи
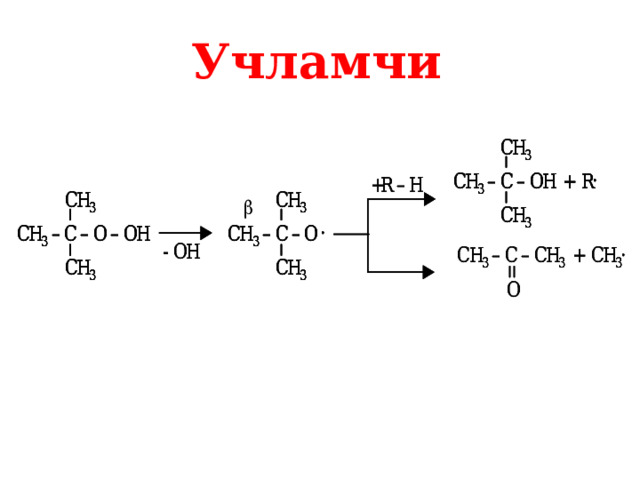
Учламчи
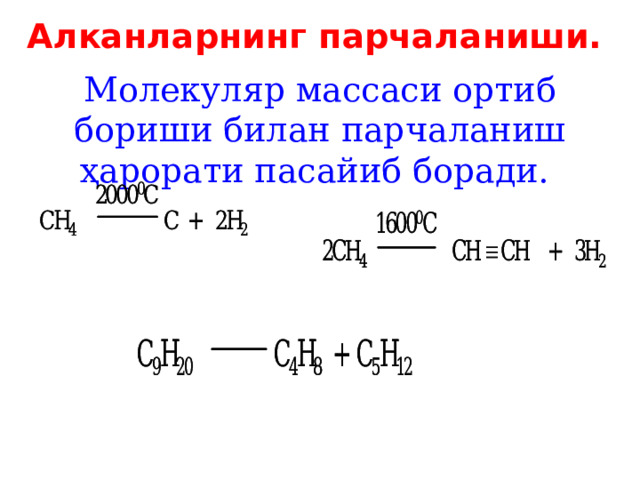
Алкан ларнинг парчаланиши.
Молекуляр массаси ортиб бориши билан парчаланиш ҳарорати пасайиб боради.

Парчаланиш жараёни механизми мураккаб бўлиб, у қуйидаги босқичлар орқали ўтади ва ҳосил бўлган оралиқ маҳсулот турли ўзгаришларга учраши мумкин
Радикалларни бирикиши:
Қайта гуруҳланиш (диспропорцияланиш):

Метан сув буғи билан 900 0 С, юқори босимда (200 – 500 атм катализатор никель-хром) парчаланиб, синтез газ ҳосил бўлади:
СО билан Н 2 аралашмасидан метил спирти, сирка кислотаси, чумоли альдегиди ва алканлар олинади.

Ишлатилиши
Алканлар арзон саноат хом ашёси.
- Метан – ёқилғи.
- Этан, пропан, бутан ва пентан – саноатда этилен ва диен углеводородларини олишда ишлатилади.
- Суюқ углеводородлар – мотор ёқилғиси
- Изооктан (2,2,4-триметилпентан) – октан сони 100 га тенг.
- Катта молекуляр массага эга бўлган алканлар техникада дизел ёқилғиси, сурков мойлари сифатида ишлатилади.




































































