№ 28. 8 класс.
Тема. Строение атома. Объяснение электрических явлений.
Цель урока: Обеспечить усвоение учащимися знаний о строении атома. Понятий:
электрон, протон, нейтрон, положительный и отрицательный ионы.
Научить пользоваться Периодической системой Менделеева для
Определения состава атома. Сформировать умение извлекать информацию,
представленную в различных видах, умение работать с учебником,
рисунком, таблицей.
Материальная база: 1)электронное приложение к учебнику физика 8 класс ( Сферы).
Анимации: строение атома, строение ядра атома, атомы водорода,
гелия и углерода.
2).презентация « Строение атома»
План урока.
| № | Этап урока | Приемы и методы
| Рейтинг | Время |
| I | Мотивация. | . Вступительное слово учителя. |
| 3 мин |
| II | Изучение нового материала. |
|
|
|
|
| 1)Изучение §30.
| Самостоятельная работа с учебником |
| 5 мин |
|
| 2) Обсуждение прочитанного. | Фронтальная беседа. Просмотр анимаций. |
| 5 мин |
|
| 3)Составление схемы атома. | Самостоятельная работа. Рабочая карта. | 7 | 3 мин |
|
| 4)Заполнение таблицы – 1.
| Самостоятельная работа с таблицей Менделеева. | 28/2 + 4 | 5 мин |
|
| 5)Заполнение таблицы – 2
| Работа со справочным материалом. | 14/2 | 5 мин |
|
| 6) Ионы . | Презентация. Конструирование ионов и атомов. |
| 5 мин |
|
| 7) Заполнение таблицы - 3 | Самостоятельная работа с таблицей Менделеева и схемами ионов. | 12/2 | 2мин |
| III | Контроль знаний. | Тест. Строение атома. | 11 | 7 мин |
| IV | Итог урока. Рефлексия. | Заполнение таблицы «Рефлексия» |
| 2 мин |
|
| Домашнее задание. | §30, 31. Составить ОК. |
|
|
Сценарий урока.
В течение всего урока учащиеся работают с рабочими картами (приложение -1), в которых даны все таблицы, предназначенные для заполнения учащимися. В карте дается, также, рейтинговая карта, в которой ученик фиксирует личный рейтинг.
I этап урока. Мотивация.
Учитель. В 7 классе вы познакомились со строением вещества. Давайте вспомним, из чего состоят вещества? (ответы учащихся). До конца 19-го века атом считался неделимой частицей. После того, как было доказано существование электрона, возникли предположения, что атом является составной частицей. Первую модель строения атома предложил Томпсон, которому принадлежит открытие электрона. Он считал. Что атом состоит из положительного заряда, напичканного электронами, как кекс изюмом. Но эта модель противоречила законам физики и была отвергнута. И вот, в начале 20-го века английским физиком Эрнестом Резерфордом была предложена модель атома, с которой мы сегодня познакомимся. (слайд 1). В качестве одного из эпиграфов к нашему уроку, я выбрала фразу, произнесенную одним физиком, касающаяся его друга, который бросил заниматься физикой. «Он стал поэтом. Для занятий физикой у него было слишком мало воображения». (слайд 2). Для того, чтобы понять строение атома нужно включить наше воображение по максимуму.
II этап урока.
1).Самостоятельная работа с учебником. Учащиеся изучают §30.
2).Фронтальное обсуждение прочитанного материала. Примерный ход обсуждения
отражен в следующей таблице.
| № | Вопрос учителя | Ответы учащихся. |
| 1 | Чем отличаются атомы разных химических элементов7 | Числом электронов. |
| 2 | Почему число электронов не является главной характеристикой атома? | Электроны могут отрываться от атомов и общий заряд электронов изменяется. |
| 3 | Что же является главной характеристикой атома? Почему? | Заряд ядра. Его изменить трудно. |
| 4 | Из чего состоит ядро атома? | Из протонов_ частиц с положительным зарядом и нейтронов- частиц , не имеющих заряда. |
| 5 | Что вы можете сказать о зарядах протона и электрона? | Равны по модулю и отличаются знаком заряда. |
| 6 | Имеет ли заряд атом? | Нет. Так число протонов и электронов равны. |
| 7. | Итак подведем итог. Из чего состоит атом? | Из положительного ядра и электронов. |
| 8 | Из чего состоит ядро атома. | Из положительно заряженных протонов и нейтронов не имеющих заряда. |
Фронтальная беседа завершается демонстрацией анимаций, отражающих строение некоторых атомов.
3 )Чтобы закрепить знания о строении атома, составим схему его строения. (слайд 3).
Необходимо элементы. Которые находятся на слайде справа переместить в схему строения атома. ( в рабочей карте учащиеся вписывают знаки частиц и подписывают их названия). После завершения работы проводится проверка, с помощью анимации частицы и их названия занимают свое место на схеме. Учащиеся подсчитывают сколько элементов расставлено правильно и записывают свой рейтинг в рейтинговую таблицу. Поскольку в задании нужно расставить 9 элементов, то максимальный рейтинг составит 9 баллов.
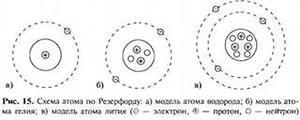
4) Следующий этап работы- это заполнение таблицы- 1. ( слады 4 и 5).В работе учащиеся используют модели атомов и таблицу Менделеева. После заполнения таблицы учащиеся должны сделать выводы о том, что заряд ядра, число протонов в ядре, число электронов и порядковый номер элемента, это одно и тоже число, а общее число протонов и нейтронов равно массе атома. Проверка заполнения проводится с помощью слайда 5.
| № |
| Водород Н | Гелий Не | Литий Li |
| 1 | Модель атома | 
| 
| 
|
| 2 | Заряд ядра | 1 | 2 | 3 |
| 3 | Число протонов | 1 | 2 | 3 |
| 4 | Число электронов | 1 | 2 | 3 |
| 5 | Порядковый номер элемента. | 1 | 2 | 3 |
| 6 | Число нейтронов. | 0 | 2 | 4 |
| 7 | Общее число протонов и нейтронов. | 1 | 4 | 7 |
| 8 | Атомная масса. | 1 | 4 | 7 |
5) Следующий этап работа со справочным материалом. Заряды частиц и их массы можно выразить в атомных единицах и в единицах СИ. Хочу обратить ваше внимание на то, что заряд протона в атомной физике равен 1, а заряд электрона -1. Учащиеся заполняют таблицу 2. Проверка заполнения поводится с помощью слайда -8.
| Название частицы | обозначение | Заряд в атомной физике | Заряд в Кулонах | Масса в атомных единицах массы. | Масса в кг. |
| Электрон. | e | -1 | -1,6∙10-19 Кл | 5,5∙10-4 | 9,1∙10-31 |
| Протон. | р | 1 | 1,6∙10-19 Кл | 1 | 1,6726∙10-27 |
| Нейтрон. | n | 0 | 0 | 1 | 1,6750∙10-27 |
6).Ребята. давайте обсудим понятие иона. Демонстрируется слайд -9.
| № | Вопросы учителя. | Ответы учащихся. |
| 1 | Что изображено нс слайде7 | Схема атома Бора |
| 2 | От атома отрывается электрон. Что можно сказать суммарном положительном и суммарном отрицательном зарядах в образовавшейся частицы? | Положительный заряд больше отрицательного. |
| 3 | Как вы думаете, чему равен заряд этой частицы? | Равен +1 |
| 4 | Электрон возвращается. Что произошло с частицей? | Стала атомом. |
| 5 | Присоединим лишний электрон. Какой заряд положительный или отрицательный будет преобладать? | Преобладает отрицательный. |
| 6 | Какая частица образовалась и чему равен ее заряд? | Отрицательный ион с зарядом -1 |
| 7 | Что вы можете сказать массах ионов? | У положительного иона незначительно уменьшается, у отрицательного- незначительно увеличивается, т.к. масса электрона ничтожна. |
Учащиеся наблюдают превращения атома в положительный ион, затем снова в атом, а затем в отрицательный ион. Учащиеся должны понять, что атом потерявший электрон, становится положительным ионом с зарядом 1, а атом, присоединивший лишний электрон, становится отрицательным ионом с зарядом -1.
7). Для закрепления понятия иона учащимся предлагается заполнить таблицу-3
| Характеристики. | Положительный ион бериллия | Атом бериллия | Отрицательный ион бериллия. |
| Число протонов. | 4 | 4 | 4 |
| Число электронов. | 3 | 4 | 5 |
| Заряд. | +1 | 0 | -1 |
| Масса по сравнению с массой атома. | уменьшилась | m | увеличилась |
Проверка заполнения проводится с помощью слайда 11. Учащиеся подсчитывают свой рейтинг и вносят в рейтинговую таблицу.
III этап урока. Контрольный тест.
Тест.
Учащиеся вносят номера правильных ответов в таблицу, что помогает более быстрой проверке.
После проверки теста, учащиеся также вносят свой результат в рейтинговую таблицу.
Итог урока.
Учащиеся подсчитывают свой рейтинг и выставляют оценку. Рейтинг за заполнение таблиц 1,2.3. подсчитывается так: число правильных ответов делится пополам.
В заключение учащиеся заполняют таблицу рефлексии (приложение-1)















































