| Методическая разработка урока по теме: "Модели атомов. Опыт Резерфорда" 
Цели урока: Образовательные: Закрепить знания о радиоактивности и видах излучения, формирование у школьников научного мировоззрения, глубже познакомить учащихся с процессом физического познания мира. Синтез знаний, полученных на уроке химии, для формирования представления об атоме. Учащиеся должны знать опыт Резерфорда (установку, ход эксперимента, результаты), планетарную модель атома, должны уметь объяснять результаты опыта Резерфорда. Развивающие: продолжить развитие мышления, умения анализировать, сравнивать, делать логические выводы. Воспитательные: развитие навыков интеллектуальной коллективной работы; воспитание основ нравственного самосознания (мысль: ответственность ученого, первооткрывателя за плоды своих открытий); пробудить у учащихся интерес к научно – популярной литературе, к изучению предпосылок открытия конкретных явлений. Тип урока: изучение нового материала. Форма урока: комбинированный урок. Методы урока: словесные, наглядные, практические. Оборудование: персональный компьютер; интерактивная доска; презентация в Power Point. Интернет ресурс: «Страницы биографии Эрнеста Резерфорда». Раздаточный материал: Карточки. Ход урока. Организация работы. Объявление темы и цели урока, порядка работы на уроке. (Слайд№1). Задача нашего урока – совершить экскурс в историю развития взглядов на строение атома, начиная с древних времен до начала 20-го века, познакомиться с фундаментальными экспериментальными и теоретическими работами конца 19-го – начала 20-го века, которые перевернули представления об атоме и привели к созданию новой квантовой модели атома. 1. Из истории развития взглядов на строение и природу атома (представление работы учащихся) Гипотеза о существовании атомов, тех неделимых частиц, различные конфигурации которых в пустоте образуют окружающий нас объективный мир, так же стара, как и наша цивилизация. Понятие атома существует уже по крайней мере 25 столетий. Демокрит (460-370 гг. до н.э.). Демокрит происходил из богатого и знаменитого рода в Северной Греции. Все доставшиеся ему в наследство деньги он потратил на путешествия. За это его осудили: по греческим законам растрата отцовского имущества являлась серьезным преступлением. Но он был оправдан, так как ему удалось доказать, что в своих путешествиях он приобрел обширные знания. В конечном счете, горожане признали Демокрита мудрецом и выделили денежное содержание, которое позволило ему продолжать научные занятия. Основные элементы его картины природы таковы:
-Все тела состоят из атомов, которые неделимы и имеют неизменную форму.
-Число атомов бесконечно, число различных типов атомов тоже бесконечно.
-Атомы обладают различными выступами, углублениями и крючками, позволяющими им сцепляться друг с другом и тем самым образовывать устойчивые соединения. Философ был настолько убежденным атомистом, что даже человеческую душу представлял в виде комбинации атомов. В России идеи о мельчайших частицах вещества развивал Михаил Васильевич Ломоносов (1711-1765). Различая два вида частиц материи, он дает им названия “элементы” (равные понятию “атом”) и “корпускулы” (равные понятию “молекула”). По Ломоносову, “элемент есть часть тела, не состоящая из каких-либо других меньших частиц”, а “корпускула есть собрание элементов в одну небольшую массу”. Английский ученый Джон Дальтон (1766-1844) впервые предпринял попытку количественного описания свойств атомов. Именно им было введено понятие атомной массы и составлена первая таблица относительных атомных масс различных химических элементов. При этом атом представляется как мельчайшая неделимая, то есть бесструктурная, частица вещества. Однако, к концу 19-го века появляются неопровержимые факты, свидетельствующие о сложном строении атома. Наиболее серьезный удар по привычным представлениям об атомах нанесло открытие электрона – частицы, входящей в состав атома. открыли первую элементарную частицу с массой 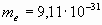 кг и с наименьшей величиной электрического заряда. В дальнейшем она получила название "электрон". 30 апреля 1897 г., когда Джозеф Джон Томсон доложил о своих исследованиях, считается “днём рождения” электрона. кг и с наименьшей величиной электрического заряда. В дальнейшем она получила название "электрон". 30 апреля 1897 г., когда Джозеф Джон Томсон доложил о своих исследованиях, считается “днём рождения” электрона.
2. Повторение изученного.Этап подготовки к активному и сознательному усвоению материала (актуализация знаний). Учитель: Мир сложен –
Он полон событий, сомнений
И тайн бесконечных,
И смелых догадок.
Как чудо природы
Является гений
И в хаосе этом
Находит порядок. Кто же этот гений, этот чудак, который совершил величайшее открытие в прошлом столетии? Чудаки украшают жизнь. Это беспокойные, необыкновенно пытливые и безгранично любопытные люди, упорно выискивающие малопонятные проблемы. Упорно что-то открывают, изобретают, экспериментируют, изготавливают. Много проблем ставит перед нами жизнь. Одни из них решаются очень легко. Над другими бьются несколько поколений ученых. Казалось бы, почти детский вопрос «Как устроен атом?». А ответ на него люди искали около 2500 лет. На предыдущем уроке мы говорили о существовании фактов, подтверждающих сложное строение атома. (Слайд№2). Вопросы: В чем заключается открытие, сделанное А. Беккерелем в 1896 году? Как стали называть способность атомов некоторых химических элементов к самопроизвольному излучению? Расскажите, как проводился опыт под руководством Э.Резерфорда, схема которого изображена на слайде. Что выяснилось в результате этого опыта? Как были названы частицы, входящие в состав радиоактивного излучения? Что представляют собой эти частицы? 3. Изучение нового материала. Учитель: Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий тому назад. Сторонники атомистической теории рассматривали атом как мельчайшую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц – атомов. Учитель: Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества. Люди поняли, что атом делим и в природе существуют частицы, меньше атома. Вопрос. Какие вы знаете частицы, меньше атома? Учащиеся: электрон, протон, нейтрон. Учитель: После всех этих открытий, когда стало ясно, что атом может иметь сложную структуру, несколькими учеными были предложены различные теоретические модели строения атома. Наибольшую популярность из них получила модель, предложенная Дж.Дж Томсоном. (Слайд№3). Учитель: Джозеф Джон Томсон показал на основе классической электромагнитной теории, что размеры электрона должны быть порядка 10 – 15 м, кроме того было известно, что размеры атомов составляют несколько ангстрем (один ангстрем равен 10 – 10 м). На этом основании Томсон в 1903 году предложил модель атома, согласно которой атомы представляют собой однородные шары из положительно заряженного вещества, в котором находятся электроны. Суммарный (отрицательный) заряд электронов равен положительному заряду атома. Поэтому атом в целом нейтрален. Эта модель получила название «пудинг», так как электроны были вкраплены в положительную среду, подобно изюму в пудинге. (Слайд№4).  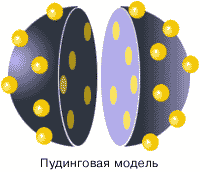 Отклонение электрона в атоме от положения равновесия приводит к возникновению вращающей силы. Поэтому электрон, выведенный каким-либо образом из положения равновесия, совершает колебания, а потому является источником электромагнитного излучения. Модель Томсона казалась привлекательной с той точки зрения, что предполагала наличие электрона в атоме. Однако она просуществовала только до 1911 года. Опыт Резерфорда. Итак, модель атома построена. Теперь необходимо проверить ее с помощью эксперимента. А что в ней проверять? Конечно, как распределен внутри атома положительный заряд и как в нем расположены электроны. Но ведь для этого нужно проникнуть внутрь атома! Разве это возможно? Чтобы проникнуть внутрь атома, нужны частицы таких же или меньших размеров. Такие частицы и были обнаружены при изучении явления радиоактивности. (Слайд№5). Вопросы. Как называются эти частицы? (альфа, бета – частицы и гамма –излучение) Каков их заряд? (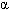 – частицы имеют положительный заряд, – частицы имеют положительный заряд, 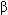 - частицы имеют отрицательный заряд, - частицы имеют отрицательный заряд, 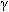 – частицы (излучение) нейтральны). – частицы (излучение) нейтральны). Какие частицы вы выбрали бы в качестве снарядов для проникновения в атом? Обоснуйте свой выбор. (Чтобы узнать, как внутри атома расположен электрический заряд, нужны заряженные частицы.) Задание 1. Рассчитайте, во сколько раз 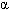 – частица тяжелее электрона. – частица тяжелее электрона. Учащиеся: (Решив самостоятельно) В 7350 раз. Поэтому в качестве снарядов нужно выбрать 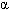 – частицу. – частицу. Учитель. Вы правы. Экспериментом, который внес решающий вклад в создание современной теории строения атома, стал опыт, проведенный в 1911 году Эрнестом Резерфордом, совместно с его ассистентами Г. Гейгером и Э. Марсденом. (Слайд№6). Учитель: (Слайд№7). Детально рассмотрим схему опыта Резерфорда. В свинцовый контейнер помещали крупинку радиоактивного вещества – радия (Rn). Через небольшое отверстие из контейнера выходил узкий пучок 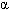 – частиц. Напротив отверстия располагался экран, покрытый сернистым цинком. (Слайд№8) .Попадая на него, – частиц. Напротив отверстия располагался экран, покрытый сернистым цинком. (Слайд№8) .Попадая на него, 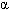 – частицы вызывали сцинтилляции в небольшой части экрана, как раз напротив выходного отверстия. (Слайд№9). Когда на пути поместили тонкую фольгу из золота, область экрана, на которой наблюдались сцинтилляции, значительно увеличилась. Это означало, что – частицы вызывали сцинтилляции в небольшой части экрана, как раз напротив выходного отверстия. (Слайд№9). Когда на пути поместили тонкую фольгу из золота, область экрана, на которой наблюдались сцинтилляции, значительно увеличилась. Это означало, что 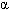 – частицы изменили свое первоначальное направление – испытали рассеяние. – частицы изменили свое первоначальное направление – испытали рассеяние. Вопрос. Как вы думаете, что могло явиться причиной отклонения 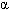 – частиц? – частиц? Учащиеся. Электроны не могли изменить направление движения 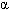 – частиц, так как их масса во много раз меньше массы – частиц, так как их масса во много раз меньше массы 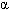 – частицы. Значит что-то другое. – частицы. Значит что-то другое. Задание 2. Учитывая, что в твердом теле атомы упакованы плотно, а расстояние между их центрами составляет величину порядка 2,5 ·10-10 м (по данным Рентгена – структурного анализа), рассчитайте, сколько слоев атомов по толщине содержит золотая фольга толщиной 0,4 мкм. Учащиеся: (решив самостоятельно) примерно 1600 слоев. Учитель: Итак: тот факт, что многие 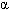 – частицы пролетают через тысячи атомов золота, не взаимодействую с ними, следует, что атом не является сплошным. (Модель атома Томсона не подтверждается). Если – частицы пролетают через тысячи атомов золота, не взаимодействую с ними, следует, что атом не является сплошным. (Модель атома Томсона не подтверждается). Если 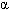 – частица не испытывает действия положительного заряда атома, направление движения ее не меняется. Если такое действие есть, то направление движения меняется, причем тем сильнее отклоняется, чем сильнее действие. Чтобы обнаружить всевозможные отклонения частиц, экран сделали сферическим. (Слайд№10). – частица не испытывает действия положительного заряда атома, направление движения ее не меняется. Если такое действие есть, то направление движения меняется, причем тем сильнее отклоняется, чем сильнее действие. Чтобы обнаружить всевозможные отклонения частиц, экран сделали сферическим. (Слайд№10). Вопрос. При проведении опытов обычно проводят измерения. Какие, по вашему мнению, проводились измерения в опытах Резерфорда? Учащиеся: Подсчитывалось количество 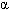 – частиц, которые не испытали взаимодействия с атомами золота, и которые отклонились на различные углы. – частиц, которые не испытали взаимодействия с атомами золота, и которые отклонились на различные углы. Учитель: Подсчет рассеянных частиц дал следующие результаты: Большинство 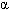 – частиц проходило через фольгу почти беспрепятственно, отклоняясь на углы, не превышающие 1 – 20. – частиц проходило через фольгу почти беспрепятственно, отклоняясь на углы, не превышающие 1 – 20. Небольшая часть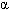 – частиц рассеялась на углы больше 20 и примерно одна из каждых 20 000 отклонилась на углы 900 и более. – частиц рассеялась на углы больше 20 и примерно одна из каждых 20 000 отклонилась на углы 900 и более. Последнего результата никто не ожидал, так как все в то время придерживались модели Томсона, согласно которой атомы представлялись настолько «рыхлыми», что не были способны вызвать столь значительные отклонения частиц. Много позже Резерфорд рассказывал, как к нему «пришел страшно возбужденный Гейгер и сказал: «Нам удалось наблюдать 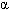 – частицы, возвращающиеся назад». Это было самым невероятным событием, которое мне пришлось пережить. Это было почти столь же невероятно, как если бы вы выстрелили 15-дюймовым снарядом в листок папиросной бумаги, и он вернулся бы назад и угодил бы в вас. Поразмыслив, я понял, что это обратное рассеяние должно быть результатом однократного столкновения, а когда я произвел расчеты, то увидел, что невозможно получить величину такого же порядка, разве что вы рассматриваете систему, в которой большая часть массы атома сконцентрирована в малом ядре». – частицы, возвращающиеся назад». Это было самым невероятным событием, которое мне пришлось пережить. Это было почти столь же невероятно, как если бы вы выстрелили 15-дюймовым снарядом в листок папиросной бумаги, и он вернулся бы назад и угодил бы в вас. Поразмыслив, я понял, что это обратное рассеяние должно быть результатом однократного столкновения, а когда я произвел расчеты, то увидел, что невозможно получить величину такого же порядка, разве что вы рассматриваете систему, в которой большая часть массы атома сконцентрирована в малом ядре». Для теоретического анализа полученных данных необходимо было знать теорию вероятностей. Чтобы ликвидировать пробелы в знаниях этого раздела математики, Резерфорд не постеснялся вновь сесть на студенческую скамью, вызвав удивление собственных студентов, неожиданно увидевших своего профессора рядом с собой. Проанализировав результаты опытов, Резерфорд пришел к выводу: (Слайд№11) - что столь сильное отклонение 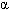 – частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле. Было рассчитано, что такое поле могло быть создано зарядом, сконцентрированным в очень малом объеме (по сравнению с объемом атома); – частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле. Было рассчитано, что такое поле могло быть создано зарядом, сконцентрированным в очень малом объеме (по сравнению с объемом атома); - так как m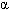 me примерно в 8000 раз, то электроны, входящие в состав атома, не могли изменить направление движения me примерно в 8000 раз, то электроны, входящие в состав атома, не могли изменить направление движения  – частиц. – частиц. Исходя из этих соображений, Резерфорд предложил ядерную модель (планетарную) строения атома. Атом напоминает Солнечную систему, только вместо Солнца в нем находится ядро, а вместо планет – электроны. 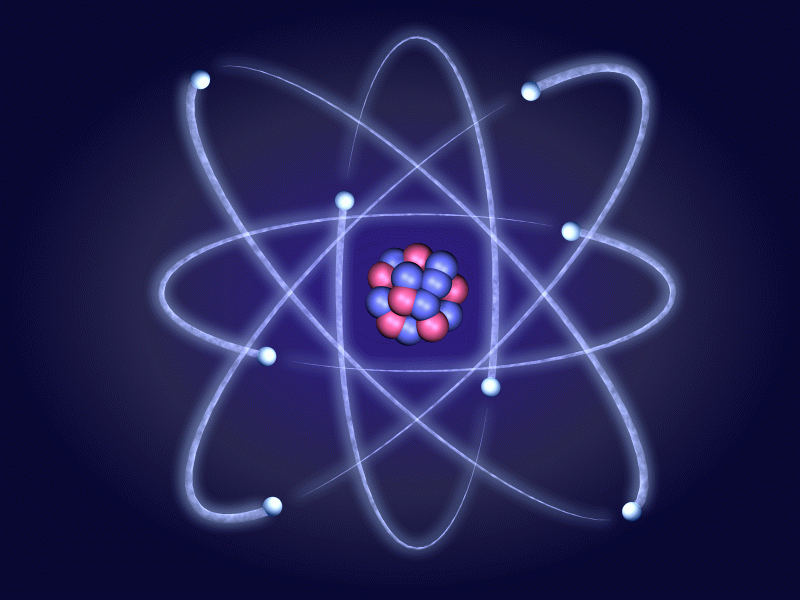 . . 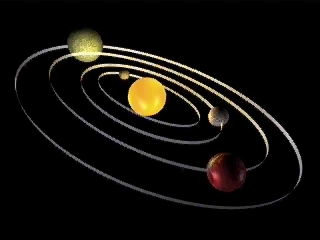 Ядерная модель оказалась очень изящной и намного более простой, чем модель атома Томсона. Резерфорд был доволен. Ещё бы! Ведь он оказался первым человеком, которому открылась тайна строения атома. Масштабы атома «по Резерфорду» можно представить так: (Слайд№12). Ядро меньше атома во столько раз, во сколько раз маковое зерно меньше здания Дагестанского государственного педагогического университета в городе Махачкала; Если увеличить атом приблизительно в 1015 раз, то он станет размером с город Москва; 4. Изложение материала развивающего характера. Интернет ресурс: «Страницы биографии Эрнеста Резерфорда». http://video.mail.ru/mail/rushimfiz01/1736/1808.html 5.Закрепление новых знаний. 1) Самостоятельная работа (4 – 5 мин). (Слайд№13). (Слайд№14).Ученики обмениваются карточками. ПРОВЕРЬ своего друга! (Слайд№15). Выставление отметок учениками. 2) Вопросы на закрепление: (Слайд№16).
6. Подведение итогов. Ученикам, отвечавшим на вопросы и самостоятельно размышлявшим в ходе урока, выставляются оценки. При ответах оценивается не только правильность ответа, но и ход рассуждений, количество и качество ошибок. Домашнее задание §56. Нарисовать схему модели атома лития, азота, кислорода, фтора. Определить заряд ядра каждого атома. (Слайд№17). -- (Слайд№18).
Литература Физика –9 кл. А. В.Перышкин ,Е. М. Гутник Москва:,Дрофа,2003г. Теория и методика обучения физике в школе. Частные вопросы. Под редакций С.Е.Каменецкого Москва:,Akademia,2000 г. Физика –11 кл. С.В.Громов Москва:,Просвещение,1999 г. Интернет – ресурсы: http://video.mail.ru/mail/rushimfiz01/1736/1808.html | 








 .
. 

















