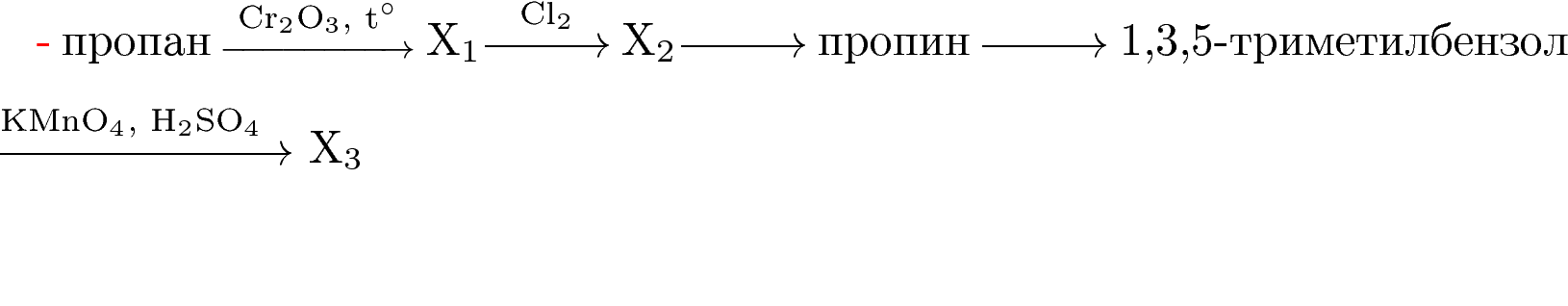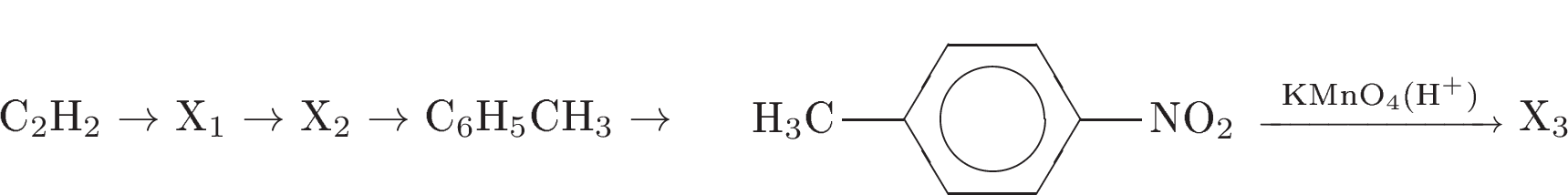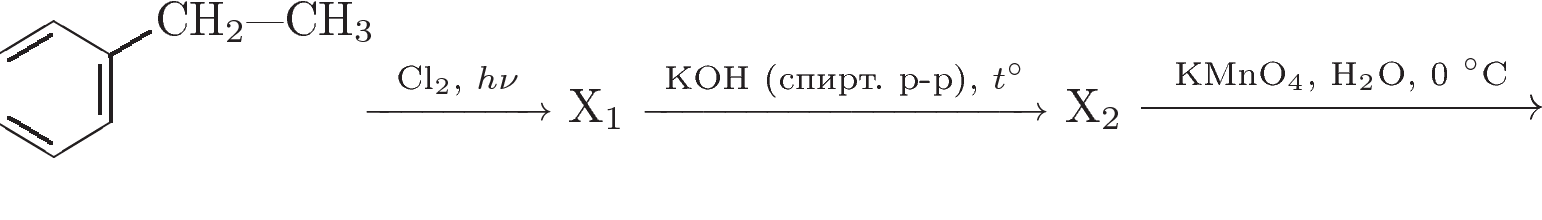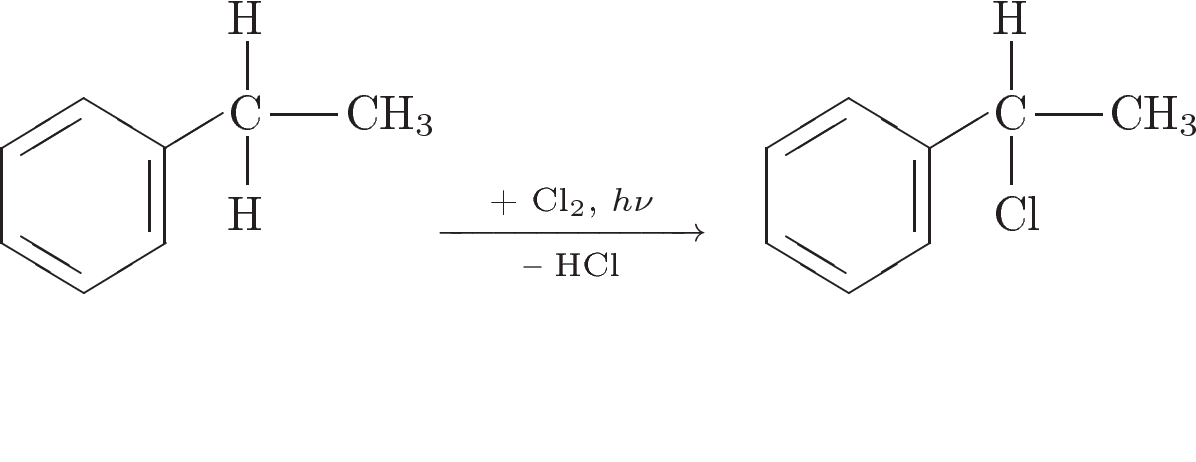Конспект урока по теме: «Сравнительная характеристика углеводородов» 10 класс (углубленный уровень)
I. Организационный момент
Здравствуйте, ребята! Сегодня мы проведем открытый урок по органической химии.
II. Основная часть урока
1. Активизация знаний учащихся. (5 минут)
Вам необходимо разделиться на группы. За 3 минуты вы должны решить задачу. В зависимости от ответа вы садитесь за столы с табличками: «Предельные углеводороды», «Непредельные углеводороды», «Арены».
1. Выведите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 84,21%. Плотность паров вещества по водороду равна 57. Ответ: С8Н18 - октан
2. Массовая доля углерода в углеводороде – 87,5 %, а относительная плотность углеводорода по воздуху равна 3,31. Определить формулу вещества. Ответ: C7H12 - гептин
3. Массовая доля углерода в углеводороде – 92,31 %, а относительная плотность углеводорода по водороду равна 39. Определить формулу вещества. Ответ: C6H6 – бензол
Молодцы! Сегодня нам предстоит сложная и плодотворная работа. И начнем мы наш урок с разминки «Химическая эстафета».На каждом этапе урока активно работающим учащимся будут выдаваться «колбочки». К концу урока у многих накопится их определённое количество, по которым легко можно оценить работу на уроке. Всем желаю успеха! Постарайтесь успеть все!
1. Это алифатические углеводороды. В строении молекул присутствуют все одинарные связи. Широко распространены в природе, содержатся в природном газе, угле, нефти. Многие углеводороды можно получить гидрированием углей. (Алканы)
2. Родоначальником этого класса органических соединений является этилен. Промышленным способом получения этих углеводородов является дегидрирование алканов на катализаторе, при температуре 560-620°С. (Алкены)
3. В строении молекул этого класса углеводородов присутствует тройная связь. Общим методом получения этих углеводородов является реакция спиртовых растворов щелочи с дигалогеналканами, содержащими два атома галогена при одном атоме углерода или двух соседних атомов углерода. (Алкины)
4. Важное практическое значение для этого класса имеет реакция полимеризация, при этом образуются каучуки. Представители этого класса –дивинил, изопрен. Методом получения дивинила, по С.В. Лебедеву, заключается в дегидрировании-дегидратации этилового спирта над катализатором МgO – ZnO при 450°С. (Алкадиены)
5. Эти углеводороды относятся к группе алициклических углеводородов. Они являются межклассовыми изомерами алкенов. Основной лабораторный способ получения малых представителей – внутримолекулярная реакция Вюрца. (Циклоалканы)
6. Гомологом этих углеводородов является толуол. Основной промышленный способ получения их – дегидрирование углеводородов нефти. Родоначальника гомологического ряда этих углеводородов получают тримеризацией ацетилена. (Арены)
2. Постановка цели. Ребята, исходя из вопросов, как вы думаете, какая тема сегодняшнего урока?
«Сравнительная характеристика углеводородов»
Что же именно мы сегодня должны повторить? (учащиеся ставят задачи урока)
Правильно! Сегодня на уроке мы обобщим, повторим знания по строению, свойствам углеводородов. Нас ожидает интересная и плодотворная работа.
Мы будем работать по одному, в парах и группах.
Мы будем доказывать свою точку зрения.
Но мы не будем забывать, что могут быть и другие точки зрения.
Мы будем помнить, что “терпение – это ключ, открывающий все двери”.
3. Проверка знаний учащихся.
Работа по карточкам (10 минут)
На доске представлены названия всех изученных классов углеводородов. 3 учащихся получают карточки с заданиями и выполняют их на доске, заполняя сведения по классам углеводородов (строение, номенклатура и изомерия)
|
| Алканы | Арены | Алкены | Циклоалканы | Алкины | Алкадиены |
| Общая формула | СnH2n+2 | CnH2n-6 | C2H2n | CnH2n | CnH2n-2 | CnH2n-2 |
| Тип связи | все связи одинарные, σ | σ связи и единое 6-ти электронное π облако – бензольное кольцо | = одна двойная (σ+ π), остальные одинарные | все связи одинарные, σ | ≡ тройная, (σ + две π ) , остальные одинарные | две двойные (σ + π), остальные одинарные |
| Тип гибрицизации | sp3 | sp2 | sp2 | sp3 | sp1 | sp2 |
| Строение молекулы | Пространственное - тетраэдр | Плоский треугольник | Плоский треугольник | Строение зависит от цикла | линейное | Плоский треугольник |
| Валентный угол | 109,5 | 120 | 120 | Зависит от цикла | 180 | 120 |
| Тип изомерии | Изомерия цепи | Изомерия цепи | Изомерия цепи; изомерия положения связи; пространственная изомерия; межклассовая | Изомерия цепи; пространственная; межклассовая | Изомерия цепи; изомерия положения связи; пространственная изомерия; межклассовая | Изомерия цепи; изомерия положения связи; межклассовая |
Карточка № 1 Дайте характеристику Алканам и Аренам по следующему плану:
Общая формула
Тип связи
Тип гибрицизации
Строение молекулы
Валентный угол
Тип изомерии
Карточка № 2 Дайте характеристику Алкенам и Циклоалканам по следующему плану:
Общая формула
Тип связи
Тип гибрицизации
Строение молекулы
Валентный угол
Тип изомерии
Карточка № 3 Дайте характеристику Алкинам и Алкадиенам по следующему плану:
Общая формула
Тип связи
Тип гибрицизации
Строение молекулы
Валентный угол
Тип изомерии
Пока учащиеся работают индивидуально у доски, весь класс повторяет химические свойства классов углеводородов
|
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Арены |
| Химические свойства | горение; замещение (реакции с галогенами и азотной кислотой) | горение; замещение (реакции с галогенами); присоединение (гидрирование); дегидрирование | горение; окисление (KMnO4); присоединение (галогены, Н2, галогеноводороды; H2O); полимеризация замещение | горение; окисление (KMnO4); присоединение (галогены, Н2,); полимеризация | горение; окисление (KMnO4); присоединение (галогены, Н2, галогеноводороды; H2O); полимеризация | горение; окисление (KMnO4) гомологов бензола; присоединение (H2, Cl2 кат - свет); замещение (Br2 кат – FeCl3 ; НNO3 кат – H2SO4 ) |
| Качественные реакции |
|
| Обесцвечивание раствора KMnO4; обесцвечивание бромной воды (Вr2) – качественные реакции на непредельность) | Бензол: взаимодествие с азотной кислотой (образование желтой жидкости с запахом миндаля Гомологи: обесцвечивание раствора КМnO4 |
4. Проведем лабораторные опыты «Качественны реакции на углеводороды». (15 минут)
Работать вы будете по группам. Первая группа получает метан и доказывает, что предельные углеволороды не дают качественных реакций характерных для непредельных углеводородов. Вторая группа получает этилен и проводит качественные реакции на алкены. Третья группа получает ацетилен и проводит качественны реакции на алкины. Как только группа выполняет свои опыты, на доске вы подтверждаете проведенные эксперименты уравнениями реакций.
Прежде, чем приступим к практической работе, давайте с вами вспомним правила техники безопасности с нагревательными приборами:
При работе со спиртовкой:
Не переносите горящую спиртовку с места на место.
Гасите спиртовку только при помощи колпачка.
При нагревании:
Не забудьте прогреть сначала всю пробирку.
Дно пробирки должно находиться в верхней части пламени.
Следите, чтобы пробирка не касалась фитиля.
При работе с веществами:
Будьте аккуратны.
Если раствор пролили, обратитесь немедленно к учителю.
Не допускайте попадания раствора кислоты на кожу глаза.
Группа 1. Получение этилена и изучение его свойств
1. В пробирку налито 1 мл этилового спирта, 6—9 мл концентрированной серной кислоты и немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении). Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки (рис. 53). Что вы наблюдаете? Напишите уравнение реакции

2. В другую пробирку налейте 2—3 мл бромной воды, опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете? Составьте уравнение реакции
3. В третью пробирку налейте 2—3 мл разбавленного раствора перманганата калия, и пропустите через него газ. Запишите уравнение проделанной реакции, поставьте коэффициенты методом электронного баланса
Группа 2. Получение ацетилена и изучение его свойств.
1. В пробирку налейте около 1 мл воды и поместите в нее кусочек карбида кальция величиной со спичечную головку. Быстро закройте пробирку пробкой с газоотводной трубкой. Что наблюдаете? Составьте уравнение химической реакции.
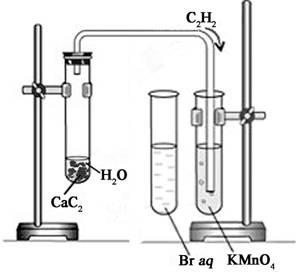
2. В другую пробирку налейте 2—3 мл бромной воды, опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете? Составьте уравнение реакции
3. В третью пробирку налейте 2—3 мл разбавленного раствора перманганата калия, и пропустите через него газ. Запишите уравнение проделанной реакции, поставьте коэффициенты методом электронного баланса
Группа 3. Получение метана и изучение его свойств.
1. В сухую пробирку, снабжённую пробкой с газоотводной трубкой, помещают смесь из обезвоженной натриевой соли этановой кислоты и натронной извести (1:2, высота слоя 6-10 мм). Затем укрепляют пробирку горизонтально и нагревают смесь в пламени горелки. К газоотводной трубке подставляем пробирку с водой. Что наблюдаем? Напишите уравнение химической реакции.
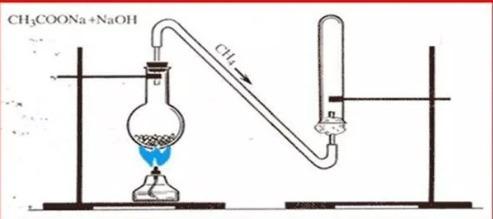
2. Во вторую пробирку помещают 5 капель раствора перманганата калия, а в третью пробирку 3-5 капель бромной воды. Не прекращая нагревания смеси в первой пробирке, вводят поочерёдно конец газоотводной трубки во вторую и третью пробирки. Что наблюдаем? Почему не произошло обесцвечивания бромной воды и перманганата калия?
5. Физминутка.
Мы с вами немного устали, давайте отдохнем и проведем физминутку: «Стрельба глазами».
В периодической системе найдите самый распространенный элемент в земной коре, необходимый для всего живого, без него жизнь не могла возникнуть и существовать. ( О)
Переведите свой взгляд вправо и вниз на «зловонный элемент», который образует единственное простое вещество среди неметаллов в виде жидкости красного цвета (Br)
Переведите взгляд левее и вверх на «безжизненный элемент», хотя это не мешает входить в состав аминокислот и белков.(N)
Переведите взгляд вниз и вправо, на элемент, образующий вещество-сероводород, источник которого имеется в нашем районе. Также этот элемент в больших количествах содержится в белковых веществах волос и ногтей. ( S)
Переведите взгляд влево, на элемент, который образует металл, содержащийся в эритроцитах крови, пищеварительном соке, играет важную роль в водном - солевом обмене. ( Na)
Переведите взгляд вправо, на элемент с относительной атомной массой 35,5. (Cl)
Переведите взгляд вверх и влево, на элемент, который является основой всего живого на Земле. Он главный элемент органических веществ (С)
Переведите свой взгляд вниз и правее, этот неметалл является необходимой составной частью костной, мозговой и нервной ткани. Используется для производства спичек, в военном деле и металлургии. (S)
Все эти элементы могут входить в состав органических веществ.
6. Составление цепочек (10 минут)
– Между гомологическими рядами существует генетическая взаимосвязь, которая прослеживается при взаимном превращении веществ. Таким образом, все классы углеводородов связаны между собой взаимными переходами или находятся в генетическом родстве.
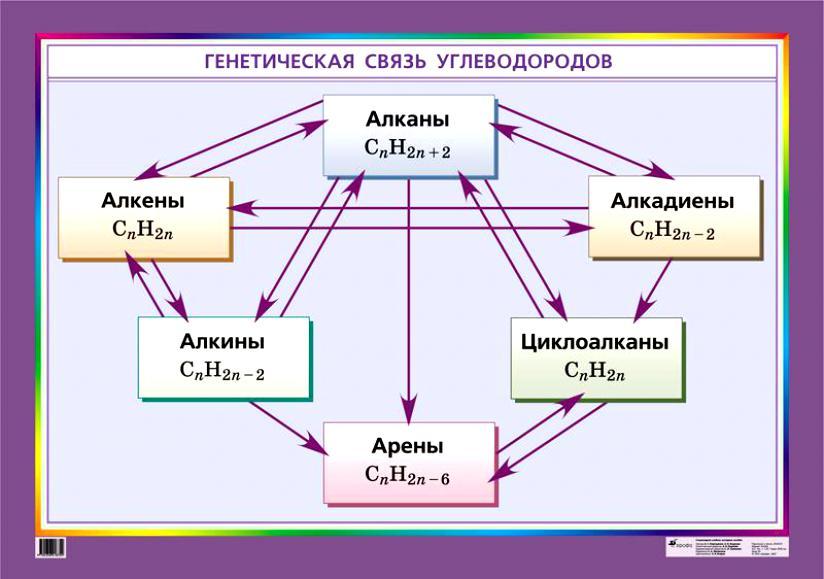
Учащиеся работают в группах. Представитель от каждой группы вновь подходит к центральному столу, берет конверт, в котором представлена цепочка. В течение 10 минут группа решает данную цепочку, подтверждая превращения уравнениями химических реакций. Один из учащихся предоставляет решение цепочки на доске через документ камеру, называя типы проводимых реакций. На представление решения каждой группе отводится по 2 мин. После того, как все группа представит свое решение, учащимся предлагаются решения на слайдах
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
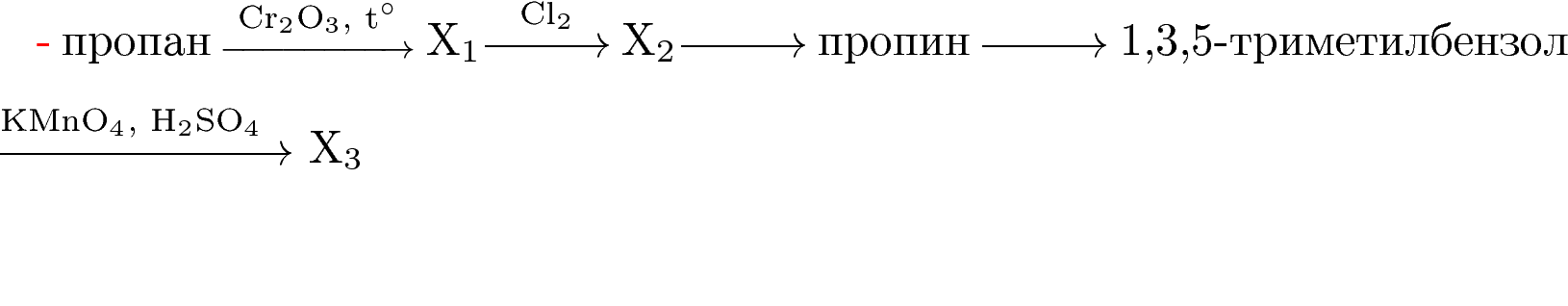
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение:
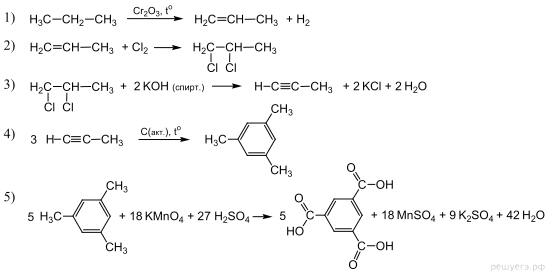
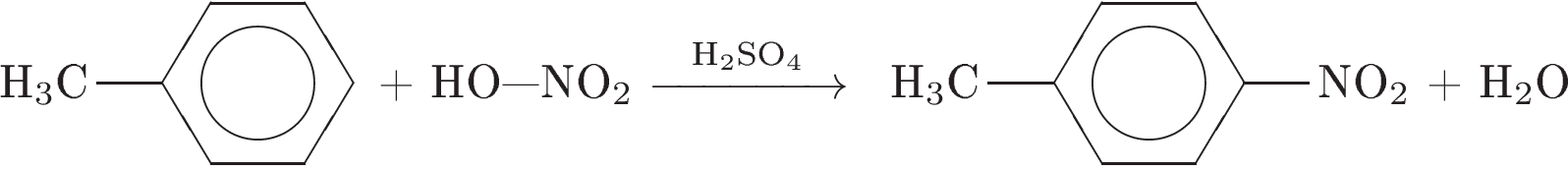
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
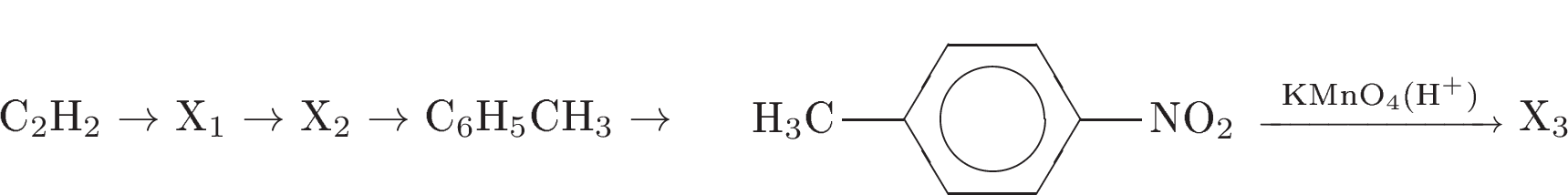
При написании уравнений реакции используйте структурные формулы органических веществ.
Решение:
1) 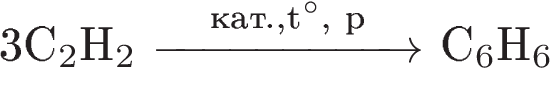
2) 
3) 
4) 
5) 
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
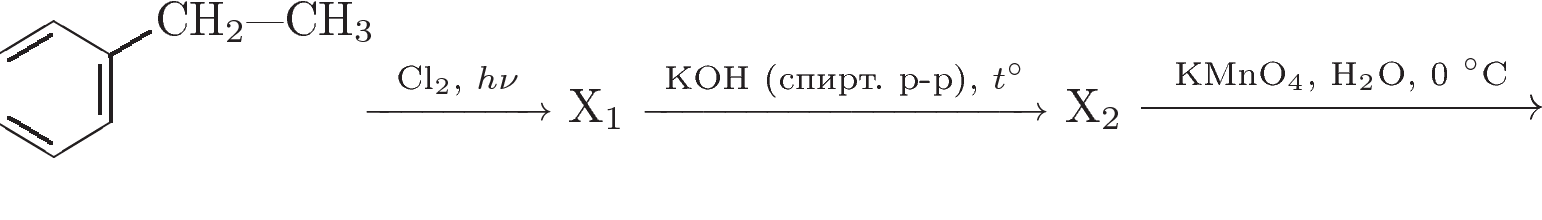

При написании уравнений реакций используйте структурные формулы органических веществ.
Решение:
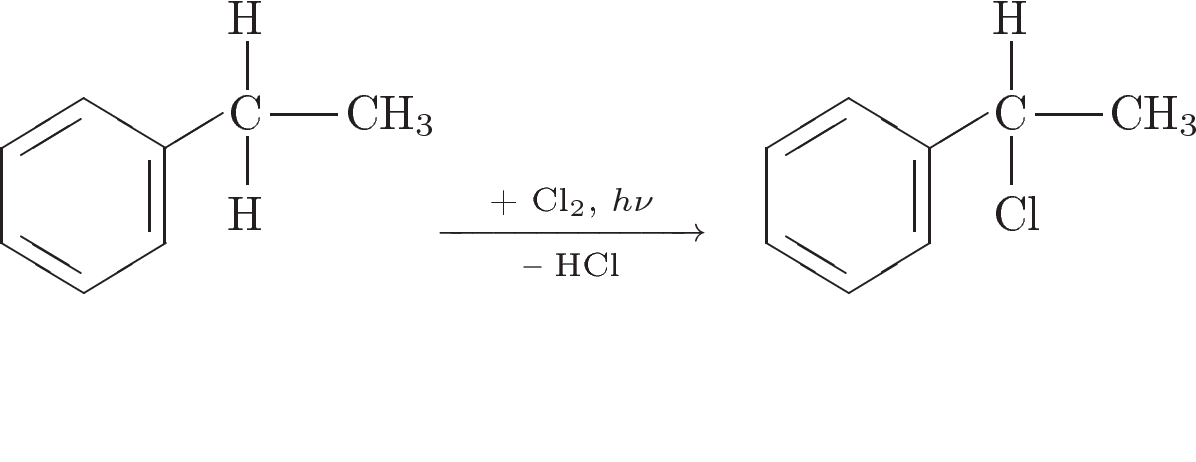
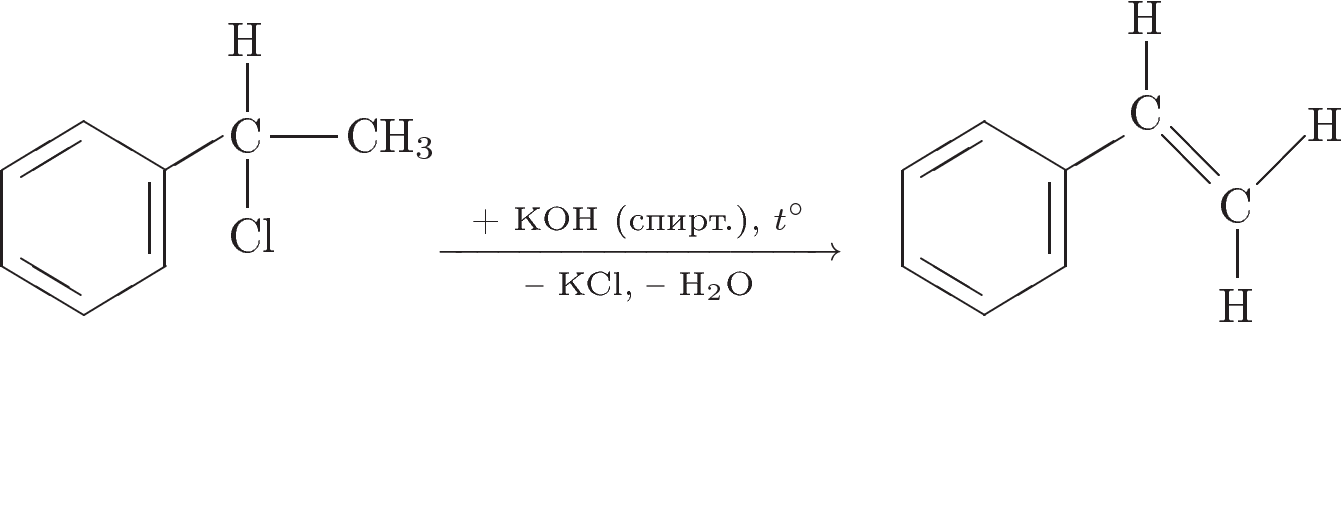


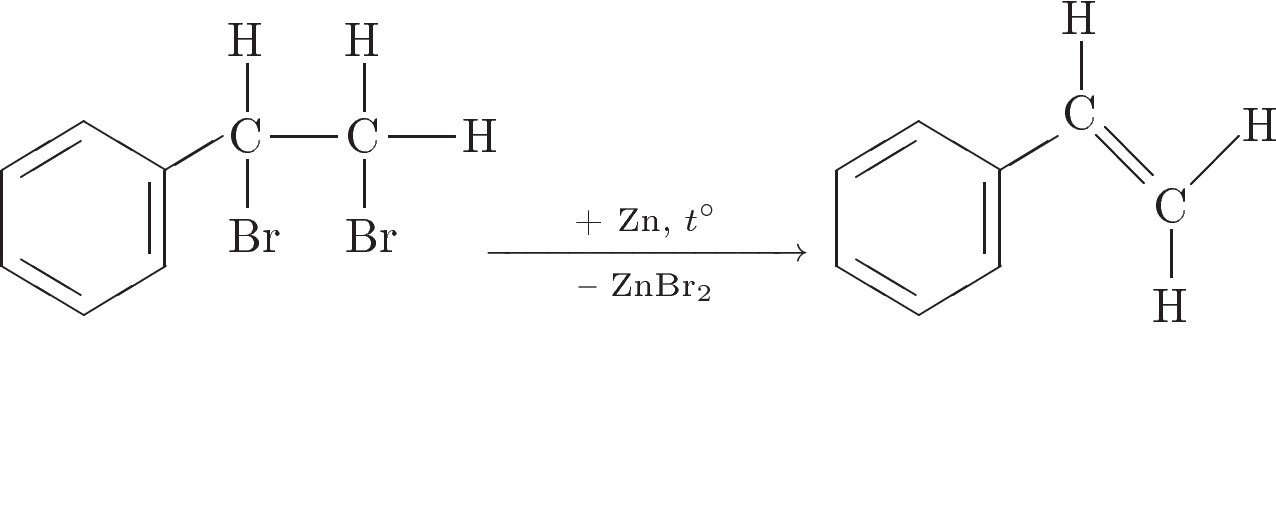
IV. Рефлексия:
Дорогие ученики! Вспомните, пожалуйста, цель нашего урока... Как вы думаете мы достигли её или нет?
Какие задания вызывали затруднения? Легко ли было работать в группах? Как вы считаете, достаточно ли подготовлены к контрольной работе?
Ребята по очереди высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске:
было интересно…
было трудно…
я понял, что…
теперь я могу…
я почувствовал, что…
я научился…
я смог…
я попробую…
мне захотелось…
Спасибо за хорошую, плодотворную работу! Подсчитаем «колбочки» и выставим оценки. Давайте посмотрим у кого больше всего колбочек и поставим оценки за вашу работу в журнал
V. Домашнее задание: (у всех домашнее задание на карточках лежат на столах)
§10-24
Задача 1. Массовая доля углерода составляет 85,71%. Относительная плотность паров некоторого углеводорода по воздуху равна 1,931. Найдите его молекулярную формулу, укажите класс(ы) углеводородов, к которым он может относиться. Приведите структурные формулы 3-х изомеров.
Задача 2. 10,5г алкена присоединяют 5,6 л. бромоводорода (н.у.). Определите молекулярную формулу алкена, приведите структурные формулы 2-х гомологов.
Задача 3. Осуществить превращения. Составить уравнения химичских реакций в структурном виде. Определить тип реакции.
.