
Химические задачи
- Выведите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 84,21%. Плотность паров вещества по водороду равна 57.
- Массовая доля углерода в углеводороде – 87,5 %, а относительная плотность углеводорода по воздуху равна 3,31. Определить формулу вещества.
3. Массовая доля углерода в углеводороде – 92,31 %, а относительная плотность углеводорода по водороду равна 39. Определить формулу вещества.

Химическая эстафета
1. Это алифатические углеводороды. В строении молекул присутствуют все одинарные связи. Широко распространены в природе, содержатся в природном газе, угле, нефти. Многие углеводороды можно получить гидрированием углей.
2. Родоначальником этого класса органических соединений является этилен. Промышленным способом получения этих углеводородов является дегидрирование алканов на катализаторе, при температуре 560-620°С.
3. В строении молекул этого класса углеводородов присутствует тройная связь. Общим методом получения этих углеводородов является реакция спиртовых растворов щелочи с дигалогеналканами, содержащими два атома галогена при одном атоме углерода или двух соседних атомов углерода.

Хими
Химическая эстафета
4. Важное практическое значение для этого класса имеет реакция полимеризация, при этом образуются каучуки. Представители этого класса –дивинил, изопрен. Методом получения дивинила, по С.В. Лебедеву, заключается в дегидрировании-дегидратации этилового спирта над катализатором МgO – ZnO при 450°С.
5. Эти углеводороды относятся к группе алициклических углеводородов. Они являются межклассовыми изомерами алкенов. Основной лабораторный способ получения малых представителей – внутримолекулярная реакция Вюрца.
6. Гомологом этих углеводородов является толуол. Основной промышленный способ получения их – дегидрирование углеводородов нефти. Родоначальника гомологического ряда этих углеводородов получают тримеризацией ацетилена.

Сравнительная характеристика углеводородов
«Не в количестве знаний заключается образование, а в полном понимании
и искусном применении
всего того, что знаешь».
А.Дистервег.

Цели:
- Сравнить строение;
- Сравнить физические и химические свойства;
- Сравнить способы получения.
Мы будем работать по одному, в парах и группах.
Мы будем доказывать свою точку зрения
Но мы не будем забывать, что могут быть и другие точки зрения
Мы будем помнить, что «терпение – это ключ, открывающий все двери»
Сравнительная характеристика углеводородов
Алканы
Химические свойства
Циклоалканы
Качественные реакции
Алкены
Алкадиены
Алкины
Арены
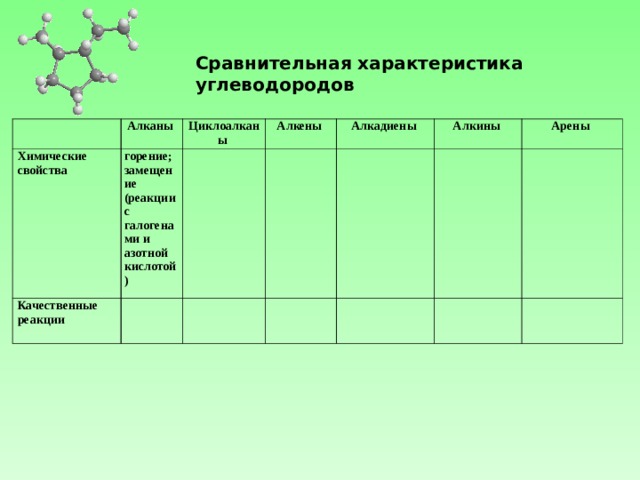
Сравнительная характеристика углеводородов
Алканы
Химические свойства
Циклоалканы
горение;
замещение (реакции с галогенами и азотной кислотой)
Качественные реакции
Алкены
Алкадиены
Алкины
Арены
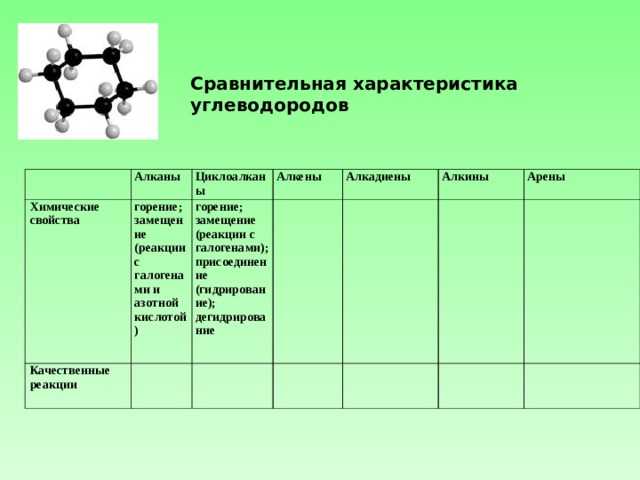
Сравнительная характеристика углеводородов
Алканы
Химические свойства
Циклоалканы
горение;
замещение (реакции с галогенами и азотной кислотой)
Качественные реакции
Алкены
горение;
замещение (реакции с галогенами);
присоединение (гидрирование);
дегидрирование
Алкадиены
Алкины
Арены
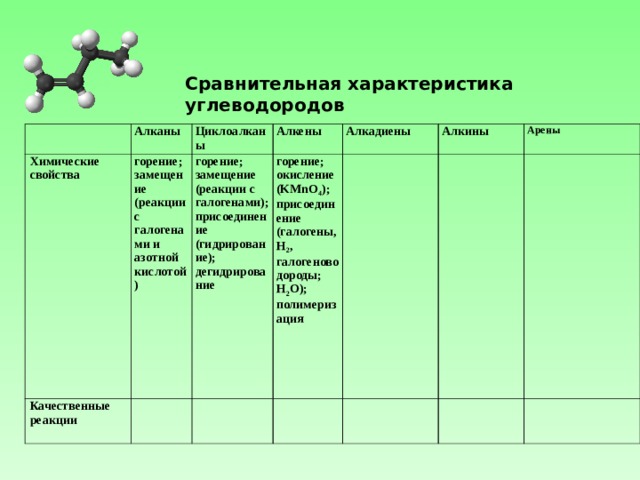
Сравнительная характеристика углеводородов
Алканы
Химические свойства
Циклоалканы
горение;
замещение (реакции с галогенами и азотной кислотой)
Качественные реакции
Алкены
горение;
замещение (реакции с галогенами);
присоединение (гидрирование);
дегидрирование
Алкадиены
горение;
окисление (KMnO 4 );
присоединение (галогены, Н 2 , галогеноводороды; H 2 O) ;
полимеризация
Алкины
Арены
Сравнительная характеристика углеводородов
Алканы
Химические свойства
Циклоалканы
горение;
замещение (реакции с галогенами и азотной кислотой)
Качественные реакции
Алкены
горение;
замещение (реакции с галогенами);
присоединение (гидрирование);
дегидрирование
Алкадиены
горение;
окисление (KMnO 4 );
присоединение (галогены, Н 2 , галогеноводороды; H 2 O) ;
полимеризация
Алкины
горение;
окисление (KMnO 4 );
присоединение (галогены, Н 2 , ) ;
полимеризация
Арены
Сравнительная характеристика углеводородов
Алканы
Химические свойства
Циклоалканы
горение;
замещение (реакции с галогенами и азотной кислотой)
Качественные реакции
Алкены
горение;
замещение (реакции с галогенами);
присоединение (гидрирование);
дегидрирование
Алкадиены
горение;
окисление (KMnO 4 );
присоединение (галогены, Н 2 , галогеноводороды; H 2 O) ;
полимеризация
Обесцвечивание раствора KMnO 4 ; обесцвечивание бромной воды (В r 2 ) – качественные реакции на непредельность)
Алкины
горение;
окисление (KMnO 4 );
присоединение (галогены, Н 2 , ) ;
полимеризация
Арены
горение;
окисление (KMnO 4 );
присоединение (галогены, Н 2 , галогеноводороды; H 2 O) ;
полимеризация
Сравнительная характеристика свойств углеводородов
Алканы
Химические свойства
горение;
замещение (реакции с галогенами и азотной кислотой)
Циклоалканы
Качественные реакции
Алкены
горение;
замещение (реакции с галогенами);
присоединение (гидрирование);
дегидрирование
Алкадиены
горение;
окисление (KMnO 4 );
присоединение (галогены, Н 2 , галогеноводороды; H 2 O) ;
полимеризация
Алкины
Обесцвечивание раствора KMnO 4 ; обесцвечивание бромной воды (В r 2 ) – качественные реакции на непредельность)
горение;
окисление (KMnO 4 );
присоединение (галогены, Н 2 , ) ;
полимеризация
Арены
горение;
окисление (KMnO 4 );
присоединение (галогены, Н 2 , галогеноводороды; H 2 O) ;
полимеризация
горение;
окисление (KMnO 4 ) гомологов бензола; присоединение ( H 2 , Cl 2 кат - свет ) ;
замещение ( Br 2 кат – FeCl 3 ; Н NO 3 кат – H 2 SO 4 )
Гомологи - обесцвечивание раствора KMnO 4
Бензол – нитрование с образованием желтой жидкости с запахом миндаля
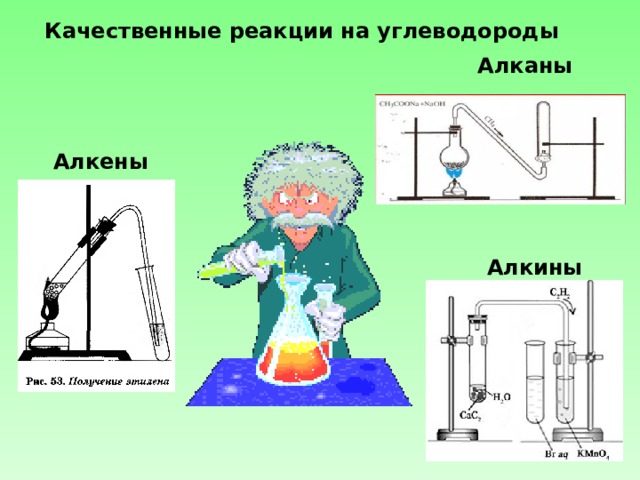
Качественные реакции на углеводороды
Алканы
Алкены
Алкины
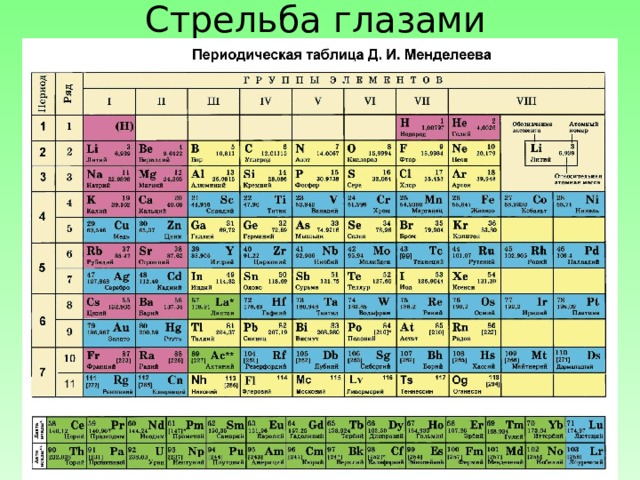
Стрельба глазами

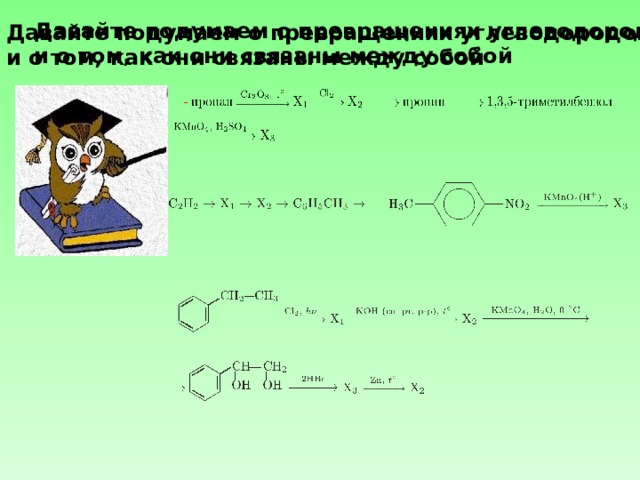
Давайте подумаем о превращениях углеводородов
и о том, как они связаны между собой
Давайте подумаем о превращениях углеводородов
и о том, как они связаны между собой

Время представить свое решение… . Кто первый?
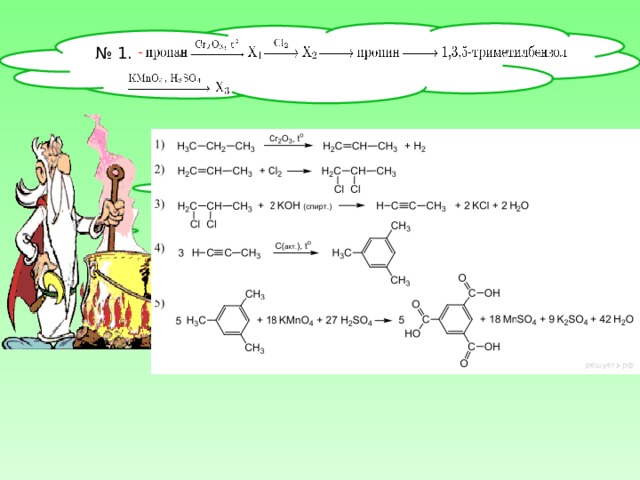
№ 1.
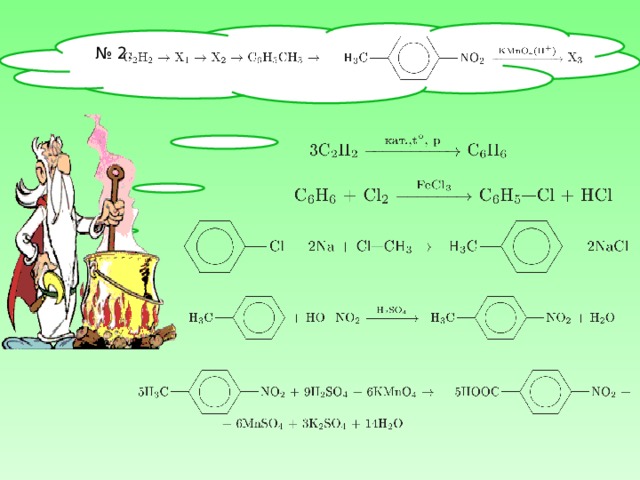
№ 2 .
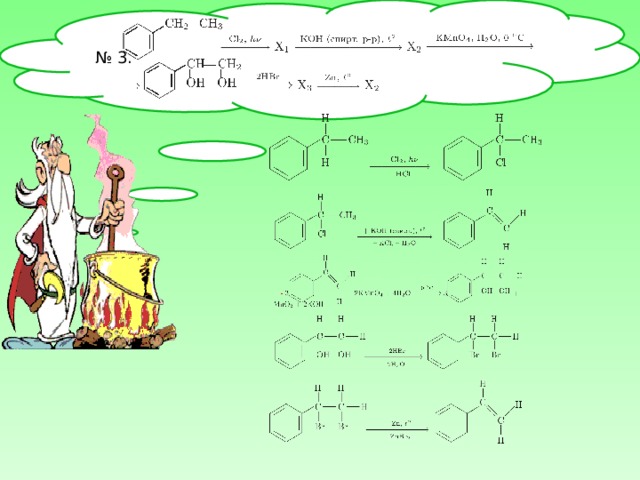
№ 3 .

Цели:
- Сравнить строение;
- Сравнить физические и химические свойства;
- Сравнить способы получения.

И напоследок …
было интересно…
было трудно…
я понял, что…
теперь я могу…
я почувствовал, что…
я научился…
я смог…
я попробую…
мне захотелось…

- §10-24
- Задача 1. Массовая доля углерода составляет 85,71%. Относительная плотность паров некоторого углеводорода по воздуху равна 1,931. Найдите его молекулярную формулу, укажите класс(ы) углеводородов, к которым он может относиться. Приведите структурные формулы 3-х изомеров.
- Задача 2. 10,5г алкена присоединяют 5,6 л. бромоводорода (н.у.). Определите молекулярную формулу алкена, приведите структурные формулы 2-х гомологов.
- Задача 3. Осуществить превращения. Составить уравнения химичских реакций в структурном виде. Определить тип реакции.

















































