
урок- исследования
«Газовые законы»

Основополагающий вопрос
Установить зависимость между тремя макроскопическими параметрами ( Р, V , Т), если один из них постоянный и объяснить эту зависимость с точки зрения молекулярно- кинетической теории.

Цели исследования
- Исследовать: а) зависимость давления данной массы газа от объёма при постоянной температуре.
- б) зависимость объёма данной массы газа от температуры при постоянном давлении.
- в) зависимость давления данной массы газа от температуры при постоянном давлении.

Этапы работы
- Определение процесса.
- Формула и формулировка закона.
- История открытия закона.
- Экспериментальное исследование закона.
- Графическое исследование закона.
- Молекулярно- кинетическое объяснение установленной зависимости.
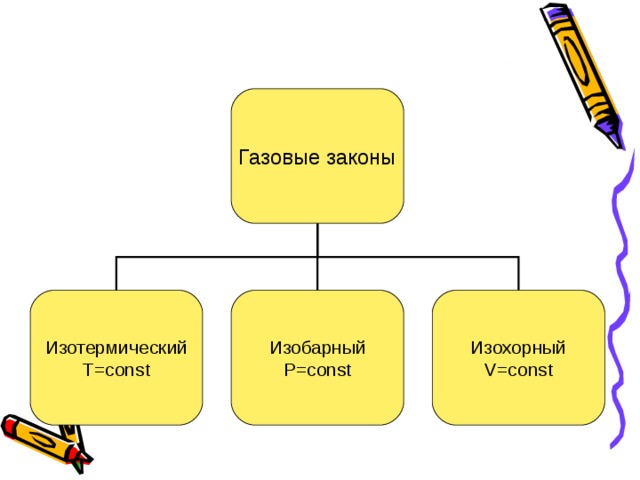
Газовые законы
Изотермический
Т= const
Изобарный
Р= const
Изохорный
V = const
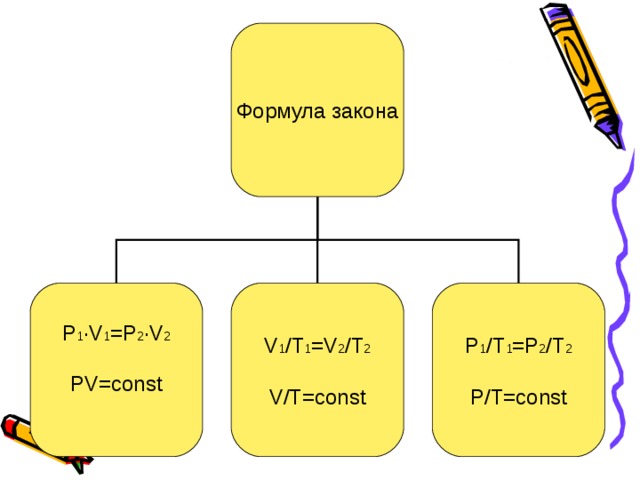
Формула закона
Р 1 · V 1 =Р 2 · V 2
Р V = const
V 1 / Т 1 = V 2 / Т 2
V/ Т= const
Р 1 / Т 1 =Р 2 / Т 2
Р / Т= const

История открытия закона Бойля - Мариотта
- Закон установлен экспериментально до создания молекулярно – кинетической теории газов английским физиком Робертом Бойлем в1662 году. Работа называлась « Новые эксперименты, касающиеся воздушной пружины». Бойль изучал изменение давления газа в зависимости от объёма при постоянной температуре
- Независимо от Бойля несколько позднее французский физик Эдмон Мариотт пришёл к тому же выводу в 1676 году. Поэтому закон получил название Бойля – Мариотта

История открытия закона Гей - Люссака
Закон установлен в 1802 году французским физиком Гей – Люссаком , который определяет объём газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально.

История открытия закона Шарля
В 1787 французский учёный Жак Шарль измерил давление различных газов при нагревании при постоянном объёме и установил линейную зависимость давления от температуры, но не опубликовал исследования.
Через 15 лет к таким же результатам пришел Гей-Люссак и, будучи на редкость благородным настоял, чтобы закон был назван в честь его первооткрывателя- Жака Шарля.

Экспериментальное исследование закона Бойля - Мариотта
Что делали:
Вставили воронку в горлышко бутылки и укрепили её пластилином так, чтобы не проходил воздух. Быстро влили в воронку полчашки воды. Вода не выльется в бутылку. Опустили сквозь воронку в бутылку длинную соломинку и выпустили воздух из бутылки. Теперь вся вода, которая держалась в воронке, вылилась в бутылку, заняв место воздуха.

Экспериментальное исследование закона Гей - Люссака
Что делали :
Налили в плоскую тарелку немного воды. Взяли стакан, нагрели воздух внутри стакана с помощью зажженной бумаги и опрокинули стакан на тарелку. Вода входила в стакан.

Экспериментальное исследование закона Шарля
Что делали:
Брали пробирку и плотно закрывали пробкой с изогнутой трубкой малого диаметра, в которую наливали небольшое количество подкрашенной жидкости. Опускали пробирку в стакан с теплой водой. Следили за изменением давления по манометрической трубке.
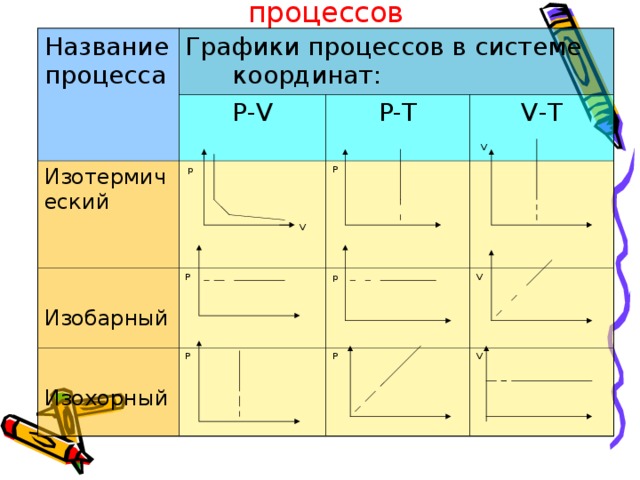
Графическое изображение процессов
Название процесса
Графики процессов в системе координат:
Р- V
Изотермический
Изобарный
Р-Т
р
V -Т
Изохорный
Р
Р
Р
р
V
Р
V
V
V
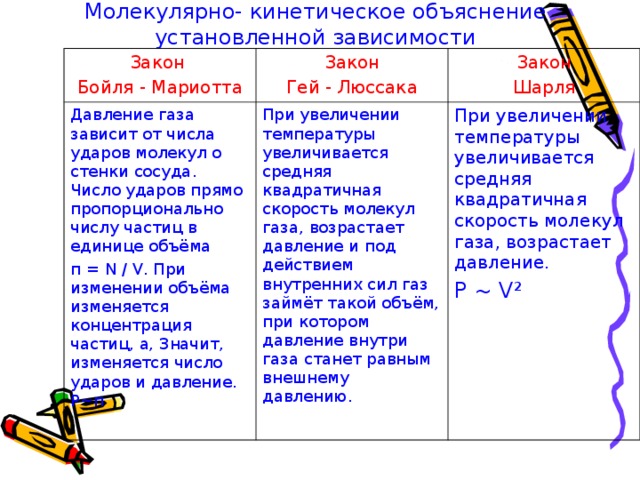
Молекулярно- кинетическое объяснение установленной зависимости
Закон
Бойля - Мариотта
Закон
Гей - Люссака
Давление газа зависит от числа ударов молекул о стенки сосуда. Число ударов прямо пропорционально числу частиц в единице объёма
п = N / V . При изменении объёма изменяется концентрация частиц, а, Значит, изменяется число ударов и давление. Р ~ п
Закон
Шарля
При увеличении температуры увеличивается средняя квадратичная скорость молекул газа, возрастает давление и под действием внутренних сил газ займёт такой объём, при котором давление внутри газа станет равным внешнему давлению.
При увеличении температуры увеличивается средняя квадратичная скорость молекул газа, возрастает давление.
Р ~ V ²

Практическое применение газовых законов
1. На основе изохорного закона функционируют кондиционеры.
2. В основании фильтрации воды в бассейнах лежит также изохорический процесс.
1. В строительстве ,
2. При дыхании межрёберной мышцы и диафрагмы периодически изменяется объём грудной клетки. Когда грудная клетка расширяется, давление воздуха в лёгких падает ниже атмосферного, то есть срабатывает изотермический закон ( Р 0 V 0 = Р 1 V 1 ) и вследствие образовавшегося перепада давления происходит вдох. У курящего человека объём лёгких намного меньше чем у не курящих.

Вывод
- Для газа данной массы отношение объёма к температуре постоянно, если давление газа не меняется.
- Для газа данной массы произведение давления газа на его объём постоянно, если температура газа не меняется.
- Для газа данной массы отношение давления к температуре постоянно, если объём не меняется.

Информационные ресурсы.
- Г. Я. Мякишев и др « Физика 10 »
- http : www . physics . ru
- http :// marklv . narod . ru / mkt /









































