Просмотр содержимого документа
«"Мгновенная кристаллизация"»

Мгновенная кристаллизация
Педагог дополнительного образования
ГБУ ДО БелОЦД(Ю)ТТ
Севастьянова Т.Ю.

Физические характеристики, которые изменяются при нагревании и охлаждении
- Объем;
- Плотность,
- Давление
- Яркость,
- Излучение
- Пример: металлы при изменении температуры изменяются в объеме,
- Вязкость воды при нагревании уменьшается в 4 раза, а глицерина в 120 раз.

Температура
- Физическая характеристика тел, которая у двух или более тел становиться равной при наступлении теплового равновесия.
(Это термодинамическое определение)
- Существует 4 определения понятия ТЕМПЕРАТУРА.
- 1. эмпирическое,
- 2. термодинамическое,
- 3. молекулярно-кинетическое
- 4. статистическое.
- Они подчеркивают разные аспекты понятия ТЕМПЕРАТУРА.
- Характеристика скоростей движения частиц (молекул, атомов, ионов) веществ.
- (молекулярно-кинетическое)
- Долгое время эти две теории развивались параллельно: термодинамическая и молекулярно –кинетическая.

Температура
- В термодинамике согласно закону Бойля-Мариотта:
- Температура - это величина пропорциональная объему газа при постоянном давлении.
- Больцман и Максвелл доказали математически, что температура и кинетическая энергия движения молекул это одно и тоже.
- Чем выше скорость движения молекул, тем выше температура!!!!
- Кинетическая энергия-энергия движения. Это физическая величина, характеризующая движущееся тело.
- С ростом температуры доля быстрых молекул увеличивается, а медленных- уменьшается
- Примеры:
- Средняя скорость молекул азота в атмосфере 474 м/с;
- Гелий( более легкий газ) -1202 м/с;
- Бензин (пары более тяжелые) -272 м/с.
- При понижении температуры кинетические энергии молекул газа уменьшаются и силы взаимодействия между ними начинают оказывать более значительное влияние!!!

Пример конденсации
- При некоторой температуре скорости большинства молекул станут недостаточными для того , чтобы кинетической энергии хватило преодолеть притяжение своих соседей
- Молекулы газа начнут собираться вместе и конденсироваться в жидкость.
- Молекулам уже сложно покинуть каплю (объем) жидкости, но легко путешествовать внутри нее.
- Интенсивность перескоков молекул воды, например, при норм. усл. -10 9 раз в секунду.
- При дальнейшем охлаждении энергии молекул может перестать хватать даже для того, чтобы перескакивать.
- А если нет перемещений, то форма не меняется.
- Такие застывшие жидкости называются аморфными или стеклообразными .
- Большинство твердых тел упорядочиваются при охлаждении образуя КРИСТАЛЛ

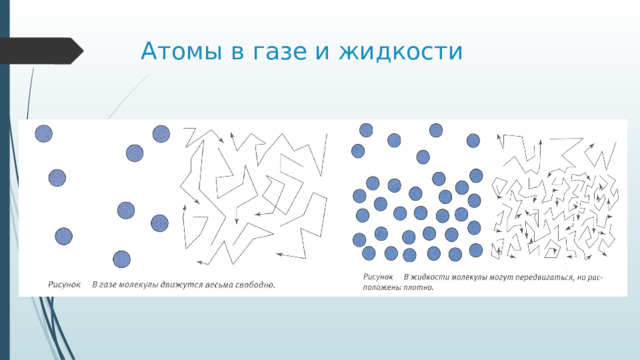
Атомы в газе и жидкости

Кристаллическое состояние
- Кристаллы – это твёрдые тела, в которых составляющие в них атомы (ионы, молекулы) расположены строго закономерно, образуя правильную, состоящую из повторяющихся элементов пространственную решетку.
- Монокристалл вырастить сложно!
- Создать подходящие условия роста кристаллов даже небольших, чтобы они были идеальными монокристаллами очень сложно!!!!
- Узлы кристаллической решетки – это равновесные положения, возле которых атомы (ионы или молекулы) колеблются.

Кристаллизация и расплавления
- Чем выше температура, тем больше энергии колебательного движения, и при приближении к температуре плавления все большее число молекул или атомов могут покинуть насиженные места.
- Все твердые тела испаряются, за исключением полимеров – их молекулы слишком большие.
Кристаллизация
Расплавление
Силы притяжения слабее, чем в объеме

Дальний и ближний порядок. Фазовый переход.
- Присоединяясь к атомам растущей грани, новые атомы повторяют симметрию, которая определяется взаимодействием как с ближними соседями, так и с дальними.
- Переход между агрегатными состояниями:
- Твердым и жидким- это фазовый переход 1 рода, который происходит при определенных температуре и давлении.. Соответствующая температура называется температурой плавления или кристаллизации.
- Любому кристаллу присуща упорядоченность и дальний порядок.
- Дальний порядок – мы можем предсказать как расположены атомы вещества на расстояниях, огромных по сравнению с размерами межатомных расстояний.
- Ближний порядок в веществе присутствует в том случае, когда для каждого атома можно с надежностью предсказать количество его ближайших соседей.
- Ближний порядок в кристаллах, в аморфных телах и жидкостях. Его нет в газах!!!

Задача
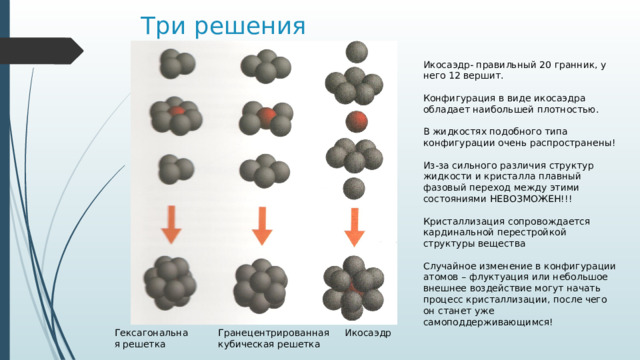
- Сколькими способами можно расположить 12 сфер вокруг 13-й, считая разными расположениями те, которые нельзя превратить друг в друга, не разрывая контактов сфер?????
Три решения
Икосаэдр- правильный 20 гранник, у него 12 вершит.
Конфигурация в виде икосаэдра обладает наибольшей плотностью.
В жидкостях подобного типа конфигурации очень распространены!
Из-за сильного различия структур жидкости и кристалла плавный фазовый переход между этими состояниями НЕВОЗМОЖЕН!!!
Кристаллизация сопровождается кардинальной перестройкой структуры вещества
Случайное изменение в конфигурации атомов – флуктуация или небольшое внешнее воздействие могут начать процесс кристаллизации, после чего он станет уже самоподдерживающимся!
Гранецентрированная кубическая решетка
Гексагональная решетка
Икосаэдр

Переохлаждение и устойчивость
- Процесс кристаллизации из растворов или расплавов сильно зависят от примесей.
- 1. примеси могут сами по себе центром кристаллизации, при условии, если имеют схожую с веществом кристаллическую структуру.
- 2. если происходит сорбция на их поверхности исходного вещества.
- 3. наличие соприкосновений с твердыми поверхностями.
- Превращение происходит на границе зерен, либо на дислокациях или в пустотах.
- «Если только несколько десятков атомов заняли положение, соответствующее новому порядку, то дальше происходит ориентированный рос зародыша, к которому один за другим начинают переходить атомы от старого, менее удобного порядка или от беспорядка.»
- Внесенный кристаллик в насыщенный раствор всегда запускает и ускоряет кристаллизацию.
- Переохлажденное состояние.
- Хорош отчищенные от примесей вещества, могут оставаться в жидком состоянии при температурах на 10-25% ниже температуры их плавления (метастабильное состояние).

Центры кристаллизации
- Когда жидкость переохлаждена , она готова к фазовому переходу в твердое состояние. Он начнется, когда возникнет центр кристаллизации.
- Центры кристаллизации в чистом веществе появляются спонтанно при многочастичном столкновении атомов.
- Они слабее частиц жидкости и разрушаются притяжением молекул жидкости, но некоторые из них могут преодолеть это ограничение, и становятся нанокристаллами, затем микрокристаллами и потом способны запустить волну кристаллизации.
- При понижении температуры на переохлаждённую жидкость влияют два основных фактора:
1. степень переохлаждения, которая увеличивает склонность жидкости к кристаллизации.
2. увеличение вязкости, которая в свою очередь уменьшает шанс кристаллизации.
Удельная частота образования критических зародышей - это сколько в среднем в данном веществе в единице объема при заданной температуре образуется в секунду зародышей кристаллов






































