Просмотр содержимого документа
«Атом- сложная частица»

Атом –
сложная частица

«Всё окружающее
нас состоит из
неделимых частиц
или атомов»
Демокрит
(около 460 до н. э. —
около 360 до н. э.)

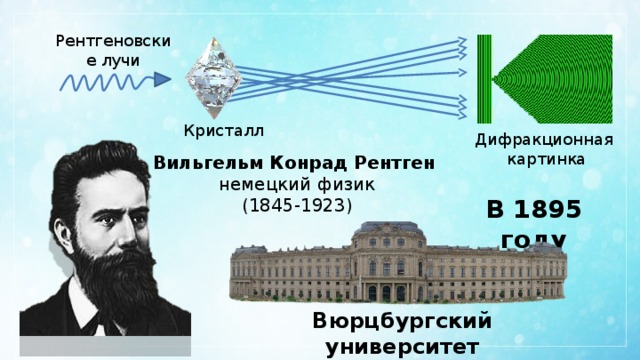
Рентгеновские лучи
Кристалл
Дифракционная
картинка
Вильгельм Конрад Рентген
немецкий физик
(1845-1923)
В 1895 году
Вюрцбургский университет
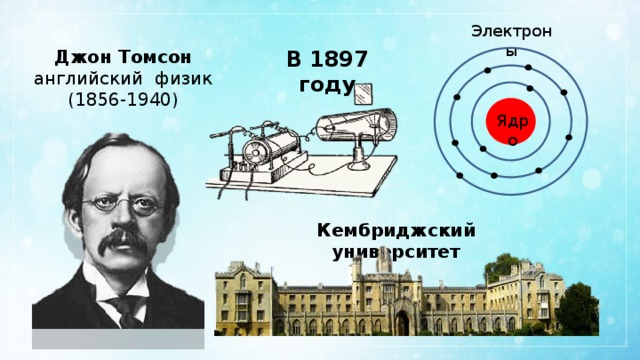
Электроны
В 1897 году
Джон Томсон
английский физик
(1856-1940)
Ядро
Кембриджский университет
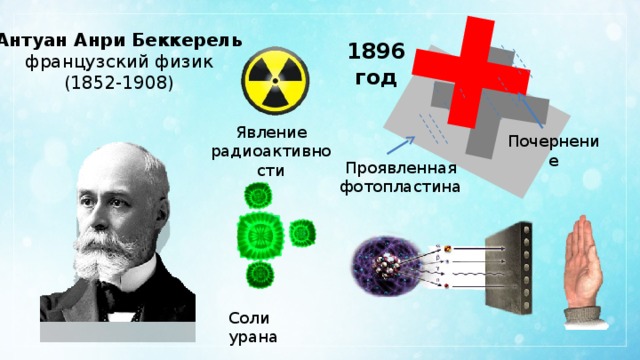
Антуан Анри Беккерель
французский физик
(1852-1908)
1896 год
Явление радиоактивности
Почернение
Проявленная
фотопластина
Соли урана

Мария Склодовская-Кюри
Пьер Кюри
польская физик-химик
французский физик-химик
(1867-1934)
(1859-1906)
В 1903 году
Открытие радия
Открытие
полония

«Пудинговая модель»
Джон Томсон
английский физик
(1856-1940)
В 1904 году
Электроны совершают колебательные движения, благодаря которым атом испускает электромагнитную энергию, а сам атом – электронейтрален.

?
Эрнест Резерфорд
английский физик
(1871-1937)
Рассеяние α-частицы
в атомах
В 1907 году
«Планетарная модель»

Квантовая теория
Нильс Бор
датский физик
(1885-1962)
Электроны передвигаются по замкнутым орбитам в соответствии значения своей энергии, которая не выделяется и не поглощается при этом.
В 1913 году
Электрон может переходить из одного в другое разрешённое энергетическое состояние, испуская или поглощая при этом энергию.

Дмитрий Дмитриевич
Вернер Карл
Иваненко
Гейзенберг
русский физик
немецкий физик-теоретик
(1904–1994)
(1901–1976)
В 1932 году
Нуклоны = Протоны (Z) + Нейтроны (N)
Протонно - нейтронная
теория
р⁺
(Z)
n°
(N)
Ядро
А – массовое число атома
А
= Z + N
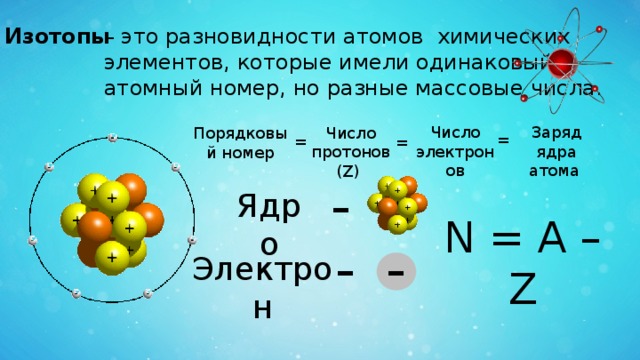
– это разновидности атомов химических
Изотопы
элементов, которые имели одинаковый
атомный номер, но разные массовые числа.
Число электронов
Заряд ядра
атома
Число протонов (Z)
Порядковый номер
=
=
=
-
Ядро
N = А – Z
-
-
Электрон
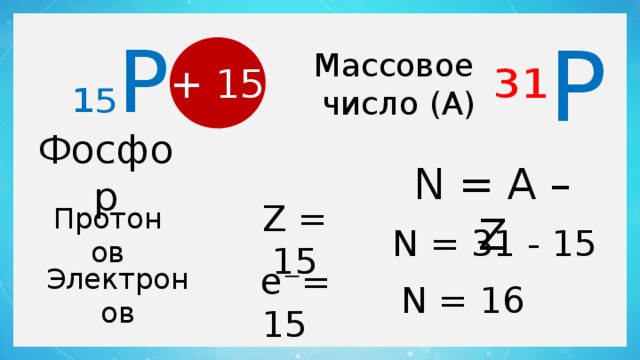
³¹ P
₁₅ P
Массовое
число (А)
+ 15
Фосфор
N = А – Z
Z = 15
Протонов
N = 31 - 15
е⁻= 15
Электронов
N = 16
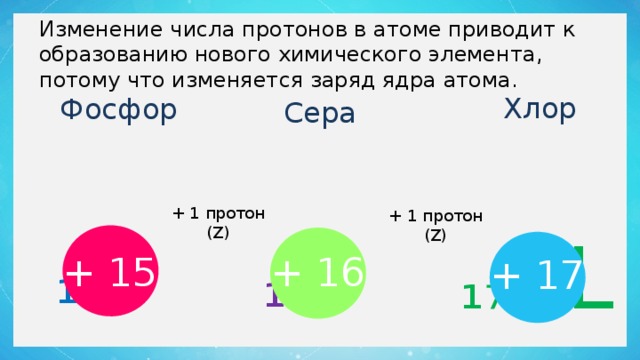
Изменение числа протонов в атоме приводит к образованию нового химического элемента, потому что изменяется заряд ядра атома.
Хлор
Фосфор
Сера
₁₅ P
₁₆ S
₁₇ CL
+ 1 протон (Z)
+ 1 протон (Z)
+ 15
+ 16
+ 17

Изменение числа нейтронов в атоме приводит к изменению атомной массы элемента.
?
-1 n°
Изотоп
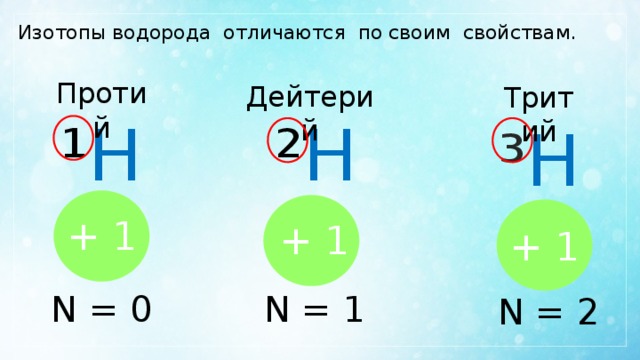
Изотопы водорода отличаются по своим свойствам.
Протий
Дейтерий
Тритий
² Н
¹ Н
³ Н
+ 1
+ 1
+ 1
N = 0
N = 1
N = 2
Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Азот
Кислород
Фтор
₈ О
₇ N
₉ F
+ 8
+ 7
+ 9
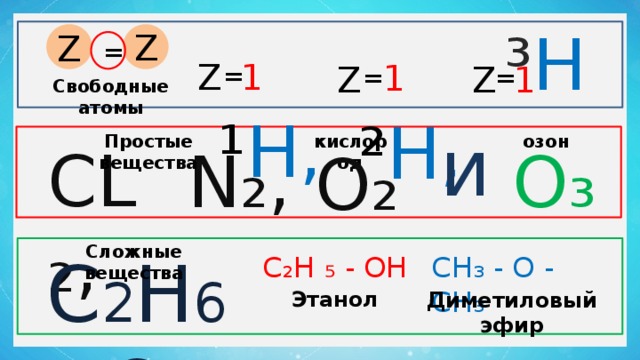
¹ Н,
² Н,
³ Н
Z
Z
=
Z
1
1
1
Z
Z
=
=
=
Свободные атомы
и
Простые вещества
кислород
озон
СL₂,
О₃
N₂,
О₂
Сложные вещества
C 2 Н 6 О
СН₃ - О - СН₃
С₂Н ₅ - ОН
Этанол
Диметиловый эфир

Узнали о вкладе ученых всего мира в развитие теории строения атома;
Объяснили существование изотопов на примере водорода;
Рассмотрели элементарный состав атома на примере фосфора.












































