Просмотр содержимого документа
«Атом - сложная частица. Состояние электронов в атоме.»

Атом - сложная частица
Состояние электронов в атоме
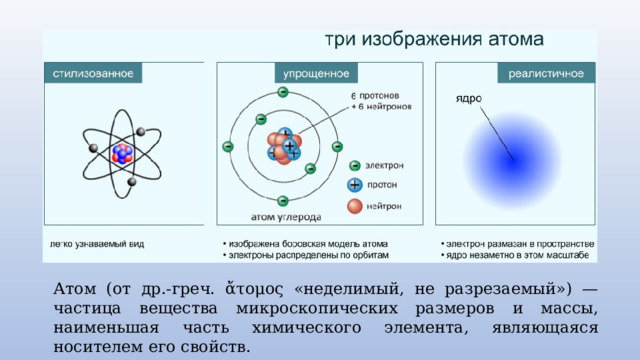
Атом (от др.-греч. ἄτομος «неделимый, не разрезаемый») — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
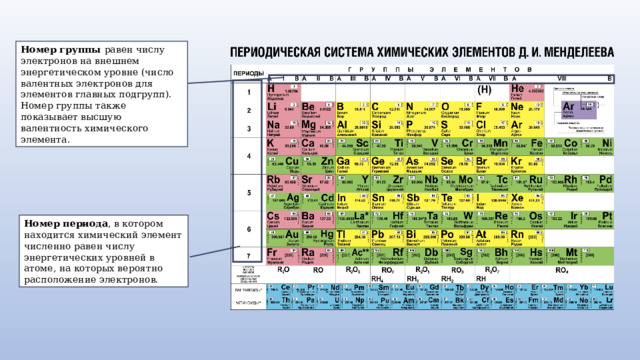
Номер группы равен числу электронов на внешнем энергетическом уровне (число валентных электронов для элементов главных подгрупп). Номер группы также показывает высшую валентность химического элемента.
Номер периода , в котором находится химический элемент численно равен числу энергетических уровней в атоме, на которых вероятно расположение электронов.
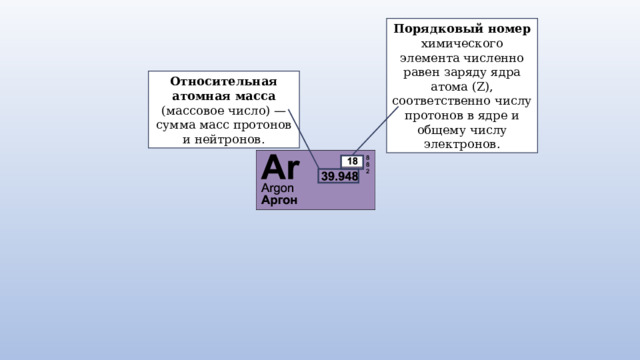
Порядковый номер химического элемента численно равен заряду ядра атома (Z), соответственно числу протонов в ядре и общему числу электронов.
Относительная атомная масса (массовое число) — сумма масс протонов и нейтронов.


Как известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
N = A - Z
52 – 24 = 28

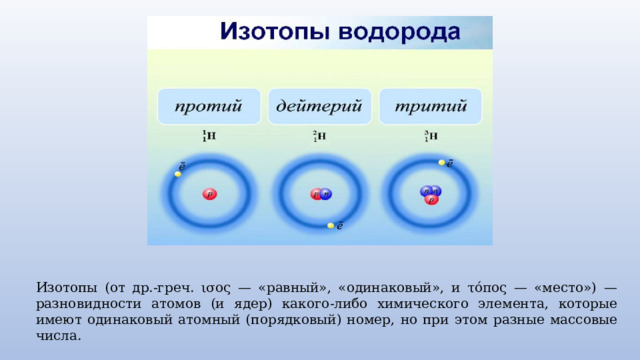
Изотопы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный (порядковый) номер, но при этом разные массовые числа.
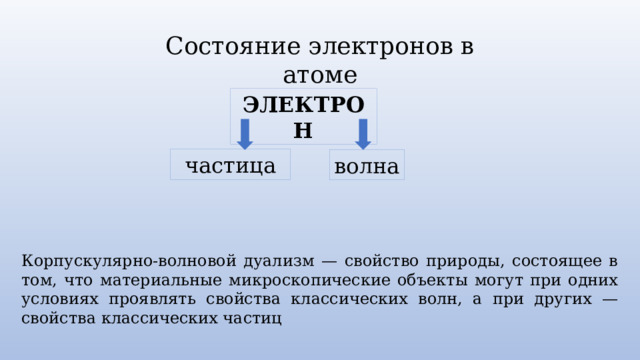
Состояние электронов в атоме
ЭЛЕКТРОН
частица
волна
Корпускулярно-волновой дуализм — свойство природы, состоящее в том, что материальные микроскопические объекты могут при одних условиях проявлять свойства классических волн, а при других — свойства классических частиц
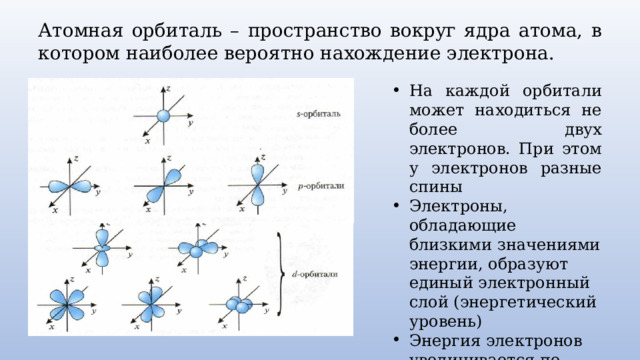
Атомная орбиталь – пространство вокруг ядра атома, в котором наиболее вероятно нахождение электрона.
- На каждой орбитали может находиться не более двух электронов. При этом у электронов разные спины
- Электроны, обладающие близкими значениями энергии, образуют единый электронный слой (энергетический уровень)
- Энергия электронов увеличивается по мере удаления их от ядра атома

Максимальное число электронов на:
орбитали = 2
s-подуровне = 2
р-подуровне = 6
d-подуровне = 10
электронном слое вычисляется по формуле:
№ слоя






































