Школьный этап всероссийской олимпиады по химии 2019-2020 учебный год
11 класс
Всего 45 баллов
Тестовые задания- 10 баллов
1. Укажите соединения с ковалентной полярной и ионной связью.
А) хлор и фторид лития
Б) вода и хлорид магния
В) оксид серы и вода
Г) литий и оксид калия
2. Для какого вещества характерна водородная связь?
А) этана
Б) этанола
В) диметилового эфира
Г) метилацетата
3. Как проявляется кислотный характер в ряду соединений
SiО2, Р2О5, SО3, Сl2О7?
А) усиливается
Б) ослабевает
В) не изменяется
Г) сначала ослабевает, а затем усиливается
4. Укажите тип реакции: синтез аммиака из азота и водорода.
А) обмена
Б) замещения
В) соединения
Г) изомеризации
5. Между растворами каких веществ протекает реакция ионного обмена с выпадением осадка?
А) гидроксид натрия и хлорид бария
Б) сульфат хрома (III) и гидроксид калия
В) нитрат кальция и бромид натрия
Г) хлорид аммония и нитрат алюминия
6. Укажите соединения с ковалентной полярной и ковалентной неполярной связью.
А) вода и сероводород
Б) бромид калия и азот
В) аммиак и водород
Г) кислород и метан
7. В какой молекуле наиболее прочная химическая связь?
А) фтора
Б) хлора
В) кислорода
Г) азота
8. Как проявляется кислотный характер в ряду соединений
Н2О, H2S, H2Se, Н2Те?
А) усиливается
Б) ослабевает
В) не изменяется
Г) сначала усиливается, а затем ослабевает
9. Укажите тип реакции: КОН + CuSO4 →
А) соединения
Б) обмена
В) полимеризации
Г) разложения
10. Между растворами каких веществ протекает реакция ионного обмена с выделением газа?
А) гидроксид бария и сульфат цинка
Б) сульфид натрия и серная кислота
В) нитрат серебра и хлорид натрия
Г) гидроксид натрия и серная кислота
Открытые вопросы
Вопрос 1
Напишите графические формулы углеводородов состава С8H14 образующих при дегидрировании 2,2–диметилгексана. Назовите эти углеводороды. 10 баллов
Вопрос 2
Восстановите левые части уравнений химических реакций. 10 баллов
… + … → KI + N2↑ + 2H2O
… + … + … = 2MnO2 +3KNO3 + 2KOH
… + … + … = 2K2FeO4 + 6KBr + 8H2O
… + … + … = 2Na2CrO4 + 3Na2SO4 + 8H2O
… + … = 8MnO2 + 3K2SiO3 + 2KOH + 5H2O
Вопрос 3
Памятник Петру Великому в Санкт Петербурге («Медный всадник») установлен на Гром-камне, монолите весом 1600 т. Открытие памятника состоялось 7 августа 1782 года при участии императрицы Екатерины II. Монумент уникален тем, что имеет всего три точки опоры: задние ноги коня и извивающийся хвост змеи. Для того чтобы скульптура приобрела устойчивость, мастерам пришлось облегчать её переднюю часть, поэтому толщина бронзовых стенок передней части намного тоньше задних стенок, что значительно усложнило отливку монумента.

В лабораторию для анализа состава сплава, из которого был отлит памятник, поступило 10,00 г образца. Лаборант аккуратно растворил образец в концентрированной азотной кислоте, при этом наблюдалось выделение газа бурого цвета, а на дне колбы образовался осадок. После того, как осадок был отфильтрован, к фильтрату добавили избыток щёлочи, после чего выпал осадок голубого цвета, который отделили и прокалили, при этом образовалось 10,00 г чёрного остатка. Осадок, оставшийся после растворения сплава в концентрированной азотной кислоте, прокалили, при этом образовался оксид массой 2,54 г, в котором массовая доля неизвестного элемента составляет 78,8 %.
Определите качественный и количественный (ω, %) состав сплава. Ответ подтвердите расчётами.
Запишите уравнения всех реакций, упомянутых в тексте.
10 баллов
Вопрос 4
Запах, который люди чувствуют при утечке бытового газа на кухне, связан с присутствием газа Х, который используется в качестве одоранта. Газ Х обладает резким неприятным запахом. Согласно данным элементного анализа Х имеет следующий состав: 38,71 %(масс.) углерода, 9,68 % водорода, а также некоторый элемент Y. Определите элемент Y и структуру газа X. Ответ подтвердите расчётом. При сжигании газа Х на воздухе образовавшуюся газовую смесь пропустили через баритовую воду. Затем аналогичную газовую смесь пропустили через раствор перманганата калия. Запишите уравнения происходящих химических реакций и укажите наблюдаемые признаки реакций. 10 баллов
Критерии оценивания и ответы
Ответы на тесты
| Тестовое задание | № 1 | № 2 | № 3 | № 4 | № 5 |
| Ответ | Б | Б | А | В | Б |
| Тестовое задание | № 6 | № 7 | № 8 | № 9 | № 10 |
| Ответ | В | Г | А | Б | Б |
Итого 10 баллов
Ответы на открытые вопросы
Ответ на вопрос 1:
2,2 – диметилгексин – 3
5,5 – диметилгексин – 1
5,5 – диметилгексин – 2
5,5 – диметилгексин – 1,3
5,5 – диметилгексин – 2,3
5,5 – диметилгексин – 1,2
Критерии оценивания:
Формула каждого вещества и его название – 2 балла
Итого 10 баллов
Ответ на вопрос 2:
KNO2 + NH4I → KI + N2↑ + 2H2O
3KNO2 + 2KMnO4 + H2O = 2MnO2 +3KNO3 + 2KOH
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 3Na2SO4 + 8H2O
3SiH4 + 8KMnO4 = 8MnO2 + 3K2SiO3 + 2KOH + 5H2O
Критерии оценивания:
каждое уравнение – 2 балла
(если правильные реагенты, но не уравнено – 1 балл)
Итого 10 баллов
Ответ на вопрос 3:
1) Определим формулу неизвестного оксида, образовавшегося при прокаливании осадка. Пусть формула оксида X2Оn, тогда
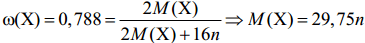
при n = 4, M(X) = 119 г/моль, что соответствует Sn – олово, тогда формула оксида – SnO2.
2 балла
m(SnO2) = 2,54 г, найдём массу олова в сплаве:
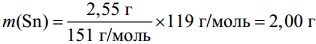
тогда масса второго компонента сплава равна 8,00 г.
Логично предположить, что остаток чёрного цвета – это оксид, так как получен при разложении гидроксида, образовавшегося при взаимодействии фильтрата с гидроксидом натрия. Для оксида состава Y2On имеем:

при n = 2, M(Y) = 64 г/моль, что соответствует Cu – медь, тогда формула оксида – CuO.
2 балла
(без расчётов и доказательств – 0 баллов, если в качестве доказательства указаны цветовые переходы – 1 балл)
Состав сплава – 80% (масс.) Cu и 20% Sn. 1 балл
2) Уравнения реакций:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Sn + 4HNO3 → SnO2×xH2O + 4NO2 + (2–x) H2O
SnO2·xH2O → SnO2 + xH2O
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
Cu(OH)2 → CuO + H2O
За каждое уравнение 1 балл, всего – 5 баллов(за уравнение с неправильными коэффициентами – 0,5 балла)
Итого 10 баллов
Ответ на вопрос 4:
1. ω(Y) = 51,61%. 1 балл
Пусть формула X – CkHmYn, тогда можно составить пропорцию:
m(C) = 12k – 38,71%
m(Y) = n×M(Y) – 51,61%
откуда M(Y) = 16(k/n)
Рассмотрим возможные случаи:
| | k = 1 | k = 2 |
| n = 1 | M(Y) = 16 (О) ⇒ СH3O | M(Y) = 32 (S) ⇒ С2H6S |
| n = 2 | M(Y) = 8 (×) | M(Y) = 16 (O) ⇒ С2H6O2 |
Состав СН3О невозможен, остаётся два варианта – С2H6S и С2H6O2. Так как Х – обладает резким неприятным запахом, это указывает на присутствие серы.
Следовательно,
Y – S 1 балл
X – C2H5SH – этантиол
(принимается также (CH3)2S – диметилсульфид) 2 балла
2. Уравнение реакции горения:
2C2H5SH + 9O2 → 2SO2 + 4CO2 + 6H2O 1 балл
(если Х определён неправильно, но уравнение верное – 1 балл)
SO2 + Ba(OH)2 → BaSO3 + H2O 1 балл
CO2 + Ba(OH)2 → BaCO3 + H2O 1 балл
Признак: помутнение раствора или выпадение белого осадка 0,5 балла
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4 2 балла
Признак: обесцвечивание раствора 0,5 балла
(если написаны неправильные коэффициенты – за уравнение ставить половину от максимума)
Итого 10 баллов


























