Химический праздник «Посвящение в химики».
Цель: формирование и развитие познавательного интереса учащихся к химии, расширение кругозора школьников, активизация мыслительной деятельности учащихся.
Оборудование и материалы: описаны в опытах.
План проведения:
1.Подготовка.
2.Вступительное слово учителя.
3.Демонстрация опытов.
4.Состязания.
5.Подведение итогов и награждение.
6.Салют в честь химиков.
Подготовка.
Заранее выбрать 3 команды из 8-х классов по 5–6 человек и дать домашнее задание:
• придумать название и девиз команды;
• нарисовать газету на химическую тему.
*(количество команд можно увеличить, тогда надо будет придумать для них интересный опыт для проведения в 8 этапе)Вступительное слово ведущего.
Сколько мы с вами читали книг и сказок, в которых добрые феи и могущественные волшебники совершают удивительные чудеса! Но вот мы дочитали сказку до конца, закрыли книгу, и в тот же миг, словно в тумане, исчезли волшебники, а от чудес осталось лишь смутное воспоминание. Да и как иначе? Ведь в жизни никто еще не встречал волшебников, не ходил с ними по улицам, не разговаривал.
Но значит ли это, что чудес в жизни не бывает? Отнюдь нет! Люди ведь сами творят чудеса. Но они так к ним привыкают, что перестают видеть что-либо чудесное.
Наука – вот истинная волшебница наших дней. И если уж говорить о чудесах, то среди всех прочих наук особенно выделяется химия. Недаром ее называют доброй волшебницей. Она позволяет человеку добывать металлы из руд и минералов, извлекать из природного сырья вещества, одно чудесней и удивительней другого. Она рождает сотни тысяч веществ, даже не встречающихся в природе, со свойствами полезными и важными. Она превращает нефть в каучук и бензин, газ – в ткань, уголь – в духи, красители и лекарственные вещества. Перечень добрых дел, которые творит химия, поистине неисчерпаем. Химия нас кормит, одевает и обувает. Каждый человек, сам того не подозревая, ежедневно осуществляет химические реакции, даже не выходя из дома: намыливая руки, зажигая спички и газ, приготавливая пищу. Да и сам человеческий организм – большая химическая фабрика, в которой происходит множество химических реакций.
1-й ученик.
Железо у меня в крови
Кальций у меня внутри
Магний ем я на обед
Из цинка получаю свет
Фосфор нужен голове
Калий бродит по еде
Углеродом я пишу
Кислородом я дышу
Натрий солим мы в еду
Золото исполняет мечту
И без химии вообще
Мы не можем жить нигде!! !
2-й ученик.
Когда у вас с утра нарушен кислотно-щелочной баланс,
Не надо бить, друзья, баклуши или впадать от горя в транс,
У вас проблемы с волосами? Вы пролили на скатерть жир?
Вы убедитесь скоро сами – без химии, друзья, не жить.
Чтоб жить спокойно и без стрессов, чтоб фтор от хлора отличить,
Мы не отстанем от прогресса и будем химию учить.
1-й ученик.
Очень химия полезна,
Это знаем мы железно,
Всем нам химия поможет,
Даже волосы уложит.
Все помоет, постирает,
Тщательно поубирает,
Нарисует и напишет,
И преступника разыщет.
2-й ученик.
О, химия, ты свыше нам дана,
Наукой жизни названа,
Тебя мы где-нибудь да встретим,
В вещах каких-нибудь приметим.
Нам химия всем верный друг
И помогает как-то вдруг,
Ты неразрывно с нею связан
И многим только ей обязан.
И вот готовы мы всегда
Кричать: «О, химия, ура! »
1-й ученик.
Химия – это наука о веществах и их превращениях, настолько необыкновенных, что для непосвященных они кажутся чудесами.
2-й ученик.
Сегодня – праздник посвящения в химики. Прежде чем получить это почетное звание, вам придется пройти испытания на профессиональную пригодность. Ваши знания и умения оценят мастера – ребята старших классов.
1-й ученик.
Представляю вам наше уважаемое жюри.
Жюри. Ученики старших классов.
Состязания.
1 этап.
Визитная карточка команды.
Разминка.
Вопросы по химии (Слабое звено)
Назовите металл, болеющий «чумой».(олово)
Формула воды? (Н2О)
Создатель Периодического закона и Периодической системы химических элементов? (Д.И. Менделеев)
Сплав меди с цинком – это латунь или бронза? (латунь)
Сложные вещества, состоящие из двух элементов, один из которых – кислород. (оксиды)
Из атомов кремния или углерода состоит алмаз? (углерод)
Воздух – это сложное вещество или смесь? (смесь)
Составная часть атома, в которой сосредоточена основная его масса и положительный электрический заряд. (ядро)
Вещество, образующееся в воздухе после грозы. (озон)
Химический элемент, содержащийся в гормоне щитовидной железы? (иод)
Корнеплод – сырье для получения сахара. (свёкла)
Сложные вещества, состоящие из атомов металла и кислотных остатков (соли).
Определенная температура, при которой вещества из твердого состояния переходят в жидкое (плавления)
Это и химический мерный сосуд, и геометрическое тело, и мужская шляпа, и часть поршневой машины (цилиндр)
Химические реакции, в результате которых из нескольких веществ образуется одно более сложное (соединения)
Реакции, в ходе которых из одного сложного вещества образуется несколько простых или менее сложных (разложения)
Вещества, в которых лакмус краснеет – это кислоты или основания?
Как называется условная запись химической реакции с помощью химических формул и математических знаков? (химическое уравнение)
Какая кислота образует соли карбонаты (угольная)
Название какой лабораторной посуды произошло от слова ПРОБА (пробирка)
Как называются вещества, обладающие тепло- и электропроводностью, ковкостью и пластичностью? (металлы)
Реакции, при которых несколько простых или сложных веществ образуют одно более сложное (соединения)
Перегонка – это физическое или химическое явление?
Масса веществ вступивших в реакцию, равна, больше или меньше массы веществ, образовавшихся в результате реакции?
Химическая реакция, протекающая с выделением тепла и света (горение)
Признак химической реакции – это выделение газа или изменение агрегатного состояния?
Что общего между алмазом и графитом? (состоят из атомов углерода)
Это и сложное вещество, состоящее из атомов металла и кислотных остатков, и название ноты (соль)
Это и химический мерный сосуд, и геометрическое тело, и мужская шляпа (цилиндр)
Какая часть пламени имеет наибольшую температуру? (верхняя)
Как называются растворимые основания? (щелочи)
Н2SО4 – какой кислоте соответствует эта формула (серной кислоте)
Соли кремниевой кислоты (силикаты)
Реакции, протекающие с поглощением теплоты – эндо- или экзотермические?
Почему загоревшиеся нефтепродукты нельзя тушить водой? (Плотность нефти меньше, она будет на поверхности воды)
Форму имеет вещество или тело?
Масса какого химического элемента при вычислении относительной атомной массы была принята за единицу? (водород)
Сульфиды - это соединения элементов с … (серой)
Как правильно затушить горящую спиртовку ( накрыть колпачком)
Перед вторым этапом команды получают листы с заданием для выполнения опыта.
2 этап:
Переведите с химического языка на общепринятый следующие фразы:
1. Не все то аурум, что блестит.
2. Белый, как карбонат кальция.
3. Недонатрий хлористый на столе, перенатрий хлористый на голове.
4. Феррумный характер.
5. Слово – аргентум, а молчание аурум.
6. Уходит, как аш-два-о в оксид кремния.
7. Аллотропная модификация углерода чистой аш-два-о.
8. За купрумный грош удавился.
9. Много оксида водорода утекло с тех пор.
10. Прозрачен, как сплав оксидов свинца и кремния с карбонатом натрия.
3 этап:
Распознай вещество:
Даны бесцветные растворы в пронумерованных стаканах: вода, уксусная кислота, щелочь, соляная кислота, сода. Распознать вещества, имея в распоряжении (лакмус, фенолфталеин, пробирки).
(После выполнения задания команды получают реактив №1.)
4 этап:
Эрудиты. (на слайде)
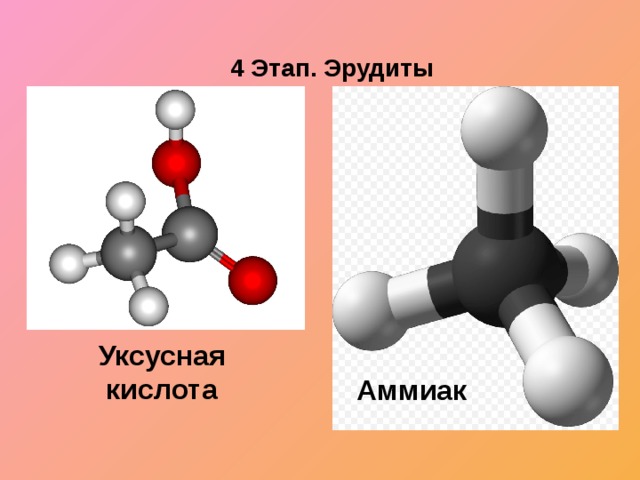
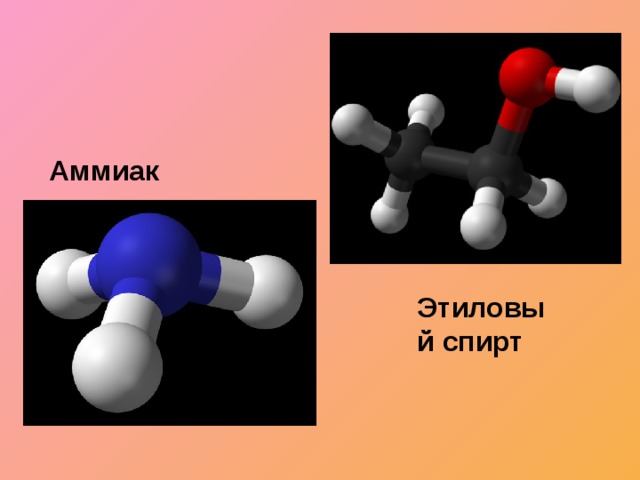
Соберите шаростержневую модель молекул:
- метан, уксусная кислота
- аммиак, этиловый спирт
(после выполнения команды получают реактив №2)
5 этап:
«Тёмная лошадка».
«Тёмная лошадка» - зашифрованный химический элемент. Командам задаются вопросы об этом элементе, на основе которых они должны его отгадать. Ответ после первой подсказки: 5 баллов; после второй- «4» и т.д. За неправильный ответ (-1балл).
В организме человека его содержится 3 г, из них примерно 2 г в крови.
По распространённости в земной коре он уступает лишь кислороду, кремнию и алюминию.
Первоначально единственным его источником были упавшие на землю метеориты, содержащие его в чистом виде.
Первобытный человек стал использовать орудия труда из него за несколько тысячелетий до н.э.
В честь него назван век.
( Железо).
Этот металл известен человеку с глубокой древности.
Его содержание в водах Мирового океана составляет примерно 8 млрд тонн.
Самый большой самородок этого металла весил 112 кг.
Из этого металла делают украшения, монеты.
Этот металл – символ Солнца.
( Золото).
За 350 лет до н.э. Аристотель в своих трудах упоминает об этом элементе.
Алхимики часто называли этот элемент Меркурием.
Этот металл хорошо растворяет другие металлы, образуя амальгамы.
Пары металла ядовиты.
Находится внутри градусника.
( Ртуть).
Его называют безжизненным газом.
Это довольно инертный газ.
Он легче воздуха.
Он входит в состав воздуха.
Его химическая формула – N2.
(Азот).
Элемент был открыт в 1669 году гамбургским химиком Геннингом Брандтом, который подумал, что нашел философский камень.
Этот элемент влияет на мышление
Его используют в производстве спичек
В природе Бывает белый, черный красный
В переводе с греческого название означает «несущий свет», светится в темноте голубоватым светом.
(фосфор)
6 этап.
Проверка зрительной памяти. Презентация. (Реактив для опыта №3)
7 Этап.
Ребусы. (на слайде) За отведенное время ребята вписывают правильные ответы в листочки
8 этап:
Команда выходит из зала и представитель проводит химический эксперимент с комментариями.
Пока судьи ведут подсчет , игра с залом – загадки.
Загадки. Отвечают- кто вперед:
1. Ничего не могу я поделать с собой:
Как едкая щёлочь - от страха синею,
А с кислотой совершенно другой
От пылкой любви мгновенно краснею.
(лакмус)
2. Как на прогулке от мороза,
От кислоты я стану розов
А в щелочи мой вид смешон
Я сразу желтый как лимон
(метилоранж).
3. Меня найдешь ты в старой сказке
Я стойко на посту стоял,
И за любовь к деве прекрасной
Невзгод не мало испытал.
Ну а теперь - служу я в банке.
Не в том, где прячут миллион,
А в той, которая вам кстати,
Чтоб не испортился бульон.
И нет во мне - ни капли яда,
Готово помогать во всем!
Но не морозь меня, не надо -
Рассыплюсь серым порошком…
4. Вы, ребята, мне поверьте -
Этот газ вполне инертен
Он спокойный и ленивый,
В трубках светится красиво.
Для рекламы нужен он,
Незаметный газ ...
(ноен)
5. А ну, скорей снимите шляпу!
Я дочь космического папы.
И вездесуща и легка,-
Я лед, я пот, я – облака.
Я иней, чай, бульон, туман,
Река, ручей и океан.
Когда я злюсь, то закипаю;
Когда мороз – я застываю.
Подведение итогов и награждение.
1-й ученик.
Итак, ребята, вы прошли посвящение. Но вы еще должны дать клятву перед, Я, юный химик, торжественно клянусь:
Любить уроки химии и всегда их посещать.
Знать все 110 элементов Периодической системы наизусть.
Соблюдать правила ТБ.
Помнить химические свойства любого вещества на Земле.
Не тратить зря химические реактивы.
Клянусь!
2-й ученик.
Мы поздравляем вас с тем, что с сегодняшнего дня вы можете считать себя настоящими химиками. А закончить мероприятие мы хотим гимном химиков:
«Нам суждено пролить все то, что льется,
Просыпать то, чего нельзя пролить!
Наш кабинет химическим зовется!
Мы рождены, чтоб химию любить!
Все выше, и выше, и выше
Летит рыжий бром к небесам.
И кто этим бромом подышит,
Тот рыжим становится сам!»





 e(OH)
e(OH) aO + HNO
aO + HNO