
Классы неорганических соединений 11 класс
Составила: Протодьяконова Л.И. учитель химии
МБОУ “Бестяхская СОШ им. И.И.Козлова”

Цель урока:
Обобщить и систематизировать знания об основных классах неорганических веществ.
Задачи:
• Закрепить и обобщить знания о классификации, свойствах оксидов, кислот, оснований и солей ;
• Охарактеризовать взаимосвязь между основными классами веществ в неорганической химии ;
• Показать значение неорганических веществ в повседневной жизни.
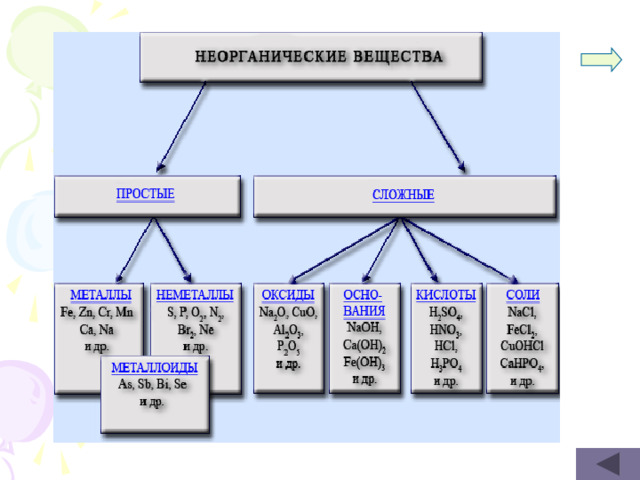
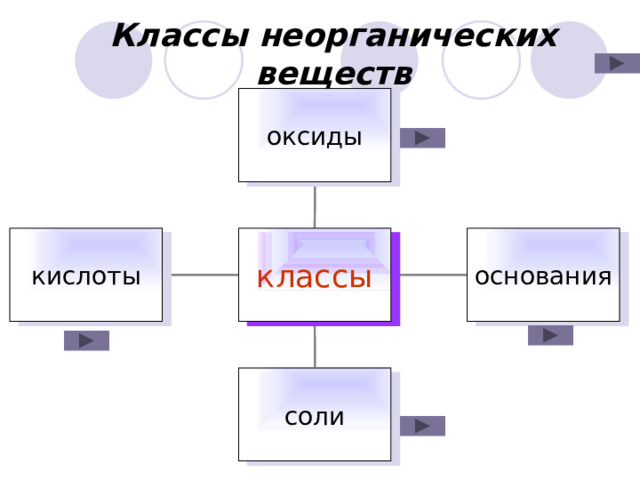
Классы неорганических веществ
оксиды
основания
кислоты
классы
соли
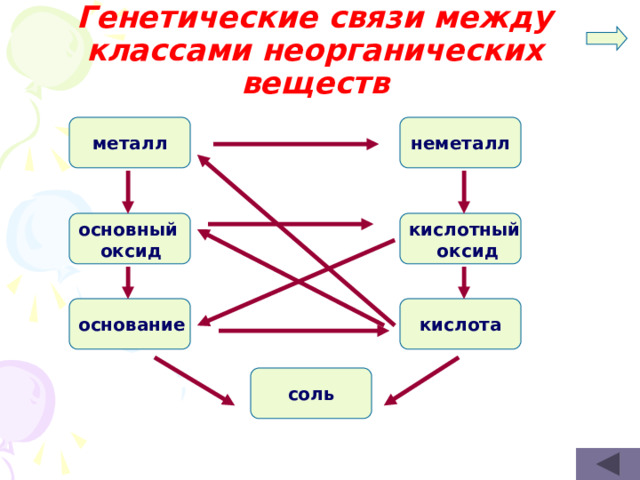
Генетические связи между классами неорганических веществ
неметалл
металл
кислотный
основный
оксид
оксид
кислота
основание
соль

Оксиды
- Состав
- Классификация
- Физические свойства
- Химические свойства
- Получение
- Применение

Основания
- Состав
- Классификация
- Физические свойства
- Химические свойства
- Получение
- Применение

Кислоты
- Состав
- Классификация
- Физические свойства
- Химические свойства
- Получение
- Применение

Соли
- Состав
- Классификация
- Физические свойства
- Химические свойства
- Получение
- Применение
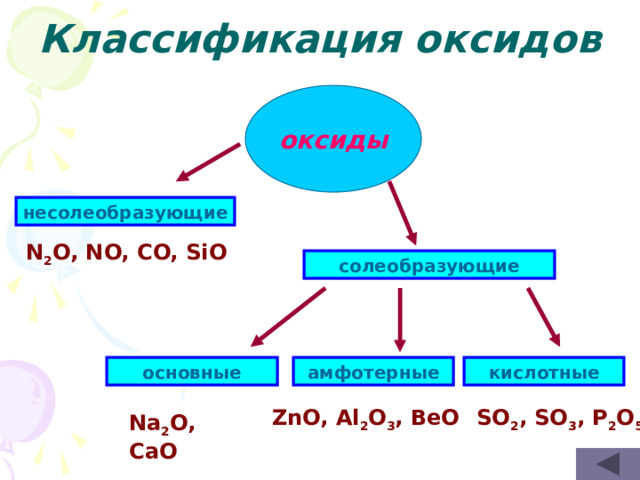
Классификация оксидов
оксиды
несолеобразующие
N 2 O, NO, CO, SiO
солеобразующие
кислотные
основные
амфотерные
ZnO, Al 2 O 3 , BeO
SO 2 , SO 3 , P 2 O 5
Na 2 O, CaO

Классификация оснований
Основания (по растворимости)
растворимые нерастворимые
(щелочи) основания
K OH , Na OH Fe (OH) 2 , Pb (OH) 2
Основания (по кислотности)
Однокислотные Двухкислотные
K OH , Na OH Fe (OH) 2 , Pb (OH) 2
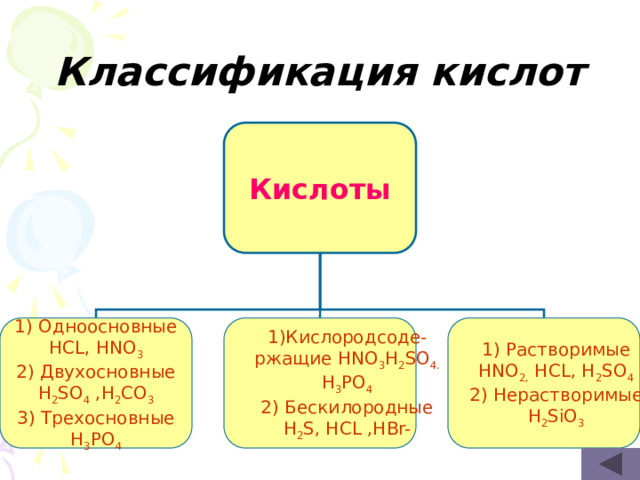
Классификация кислот
Кислоты
1)Кислородсоде-
ржащие HNO 3 H 2 SO 4.
HCL, HNO 3
HNO 2, HCL, H 2 SO 4
H 3 PO 4
H 2 SiO 3
2) Бескилородные
H 2 SO 4 ,H 2 CO 3
H 2 S, HCL ,HBr-
H 3 PO 4
![Классификация солей соли Средние Кислые Двойные Основные ZnOHCl KHSO 4 KNaSO 4 KCl Комплексные K 3 [Fe(CN) 6 ]](https://fsd.multiurok.ru/html/2021/10/11/s_61643fe34aec4/img12.jpg)
Классификация солей
соли
Средние
Кислые
Двойные
Основные
ZnOHCl
KHSO 4
KNaSO 4
KCl
Комплексные
K 3 [Fe(CN) 6 ]

Оксиды
- Сложные вещества, состоящие из двух химических элементов, один из которых – кислород в степени окисления -2.
H 2 O; AI 2 O 3 ; CaO; P 2 O 5
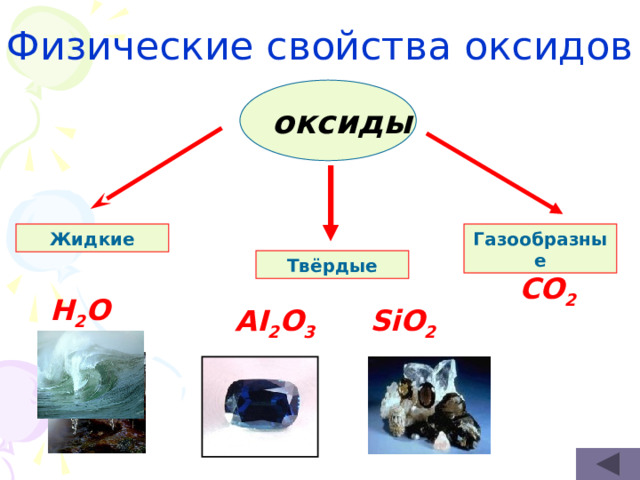
Физические свойства оксидов
оксиды
Жидкие
Газообразные
Твёрдые
CO 2
H 2 O
SiO 2
AI 2 O 3
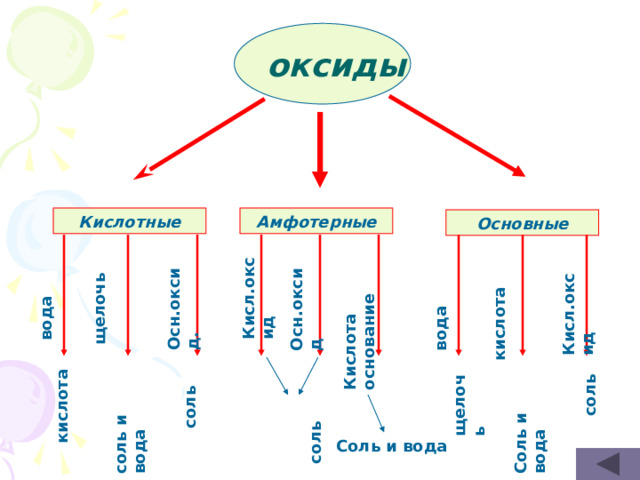
вода
щелочь
Осн.оксид.
кислота
соль и вода
соль
Кисл.оксид
Осн.оксид
Кислота основание
соль
вода
щелочь
кислота
Соль и вода
Кисл.оксид
соль
оксиды
Амфотерные
Кислотные
Основные
Соль и вода

Получение оксидов
- Окисление кислородом простых веществ
2MgO +O 2 =2MgO
- Окисление кислородом cложных веществ 2H 2 S+3O 2 =2H 2 O+2SO 2
- Разложение нагреванием солей СaCO 3 =CaO+CO 2
- Нагреванием оснований Cu (OH) 2 =CuO+H 2 0
- Нагреванием кислородсодержащих кислот H 2 SO 3 =H 2 O+SO 2
- Нагреванием высших оксидов 4CrO 3 =Cr 2 O 3 +3O 2
- Вытеснение летучего оксида менее летучим Na 2 CO 3 +SiO 2 =Na 2 SiO 3 +CO 2

Применение оксидов
- Оксид цинка ZnO – вещество белого цвета, используется для приготовления белой масляной краски (цинковые белила).
Оксид хрома(III) – Cr 2 O 3 –кристаллы зеленого цвета, нерастворимые в воде.
Cr 2 O 3 используют как пигмент при изготовлении декоративного зеленого стекла и керамики.

Оксид кремния (IV) SiO 2
- Кварц, кремень, горный хрусталь, аметист, яшма, опал — вс е это оксид кремния (IV).

Основания
- Сложные вещества, состоящие из атомов металлов и соединённых с ним одной или нескольких гидроксидных групп.
Ме n+ (ОН) n

Физические свойства оснований
- Твердые кристаллические вещества.
- В воде растворимы щелочи:LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH) 2 , Sr(OH) 2 ,Ba(OH) 2
- Другие-малорастворимы

- Щелочи - едкие вещества. Они разъедают кожу и ткани. Поэтому технические названия некоторых из них указывают на это свойство. Например: NаОН - едкий натр, КОН- едкий кали . Обращаться со щелочами нужно очень осторожно.

Химические свойства оснований
Щелочи
- Реагируют с кислотой с образованием соли и воды
Нерастворимые основания
2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O
- Реагируют с кислотным оксидом с образованием соли и воды
2NaOH + SO 3 = Na 2 SO 4 + H 2 O
- Реагируют с солью с образова-нием новой соли и нового осно-вания при условии, что выпадает осадок
4. Окрашивают индикаторы
при условии, что соль растворима
2NaOH + FeSO 4 = Na 2 SO 4 + Fe(OH) 2
Fe(OH) 2 + H 2 SO 4 = FeSO 4 + 2H 2 O
- Разлагаются при нагревании
лакмус
t 0
метил-оранж
синий
Fe(OH) 2 = FeO + H 2 O
фенол-фталеин
желтый
малиновый

Получение оснований
- Щелочи получают:
- а) взаимодействием активных металлов с водой
- 2Na + 2H 2 O = 2NaOH + H 2
- б) взаимодействием основных оксидов с водой
- Нерастворимые основания получают
- взаимодействием солей со щелочами
- FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4

Применение оснований
Гидроксид натрия NaOH (едкий натр, каустическая сода),применяется в производстве бумаги, мыла, волокон, очистке нефтепродуктов
Гидроксид кальция Ca(OH) 2 (гашеная известь),применяется в строительстве

Кислоты
- Кислотами называются сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка.
H 2 SO 4 HCl

Физические свойства
- Большинство кислот не имеют цвета и запаха , кислые на вкус, хорошо растворяются в воде (кроме H 2 SiO 3 )
- При обычных условиях кислоты могут быть
Твердыми: H 2 SiO 3 ;H 3 PO 4
Жидкими: HClO 4 ;H 2 SO 4
- Сильные кислоты очень едкие. Это означает, что они могут выжигать кожу или другую поверхность .

Химические свойства кислот
- Кислота + основание = соль + вода
- H 2 SO 4 +2 NaOH = Na 2 SO 4 + 2H 2 O
-
- Кислота + оксид металла = соль + вода
- CuO + 2 HCL = CuCL 2 + H 2 O
- Кислота + металл = водород + соль
- 2HCL +Zn = ZnCL 2 + H 2
- Условия: - в ряду напряжений металл должен стоять до водорода
- - в результате реакции должна получиться растворимая соль
- Кислота + соль = новая кислота + новая соль
- Условия: - в результате реакции должны получиться газ, осадок
- BaCL 2 + H 2 SO 4 = BaSO 4 + 2HCL

Получение кислот
1.Кислотный оксид+вода
SO 3 +H 2 O=H 2 SO 4
2.Металл+сильный окислитель 3P+5HNO 3 +2H 2 O=3H 3 PO 4 +5NO
3.Cоль+менее летучая кислота NaNO 3 +H 2 SO 4 =HNO 3 +NaHSO 4
1.Водород+неметалл
H 2 +Cl 2 =2HCl
2.Cоль+менее летучая кислота NaCl+H 2 SO 4 =2HCl+NaHSO 4

Применение кислот
1- производство кислот, 2-взрывчатых веществ, 3-минеральных удобрений, 4- электролитической меди, 5-эмали, 6-солей, 7- искусственного шелка, 8- лекарств

Соли
- Солями называются сложные вещества, представляющие собой продукты полного или частичного замещения водорода в кислоте на металл или гидроксильной группы в основании на кислотный остаток
K 2 SO 4 ; КHSO 4 ; ZnOHCl

ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
- Соли-твердые кристаллические вещества. Многие из них имеют высокие температуры плавления и кипения. По растворимости делятся на:
- Растворимые NaCI; K 2 SO 4
- Нерастворимые CaCO 3 ; BaSO 4

ХИМИЧЕСКИЕ СВОЙСТВА CОЛЕЙ
- Разложение при прокаливании
CaCO 3 = CaO + CO 2
Cu + Hg(NO 3 ) 2 = Hg+ Cu(NO 3 ) 2
CaCl 2 + Na 2 SiO 3 = CaSiO 3 + 2NaCl
Fe(NO 3 ) 3 + 3NaOH = Fe(OH) 3 + 3NaNO 3
AgNO 3 + HCl = AgCl + HNO 3

Получение солей
- металл+неметалл 2Mg+Cl 2 =MgCl 2
- металл+кислота Zn+2HCl=ZnCI 2 +H 2
- металл+соль Hg(NO 3 ) 2 +Cu=Hg+Cu(NO 3 ) 2
- основной оксид+кислота CaO+2HCl=CaCl 2 +H 2 O
- кислотный оксид+основание CO 2 +Ca(OH) 2 =CaCO 3 +H 2 O
- кислотный+основной оксиды CaO+CO 2 =CaCO 3
- основной+амфотерный оксиды Al 2 O 3 +CaO=Ca(AlO 2 ) 2
- кислота+основание H 2 SO 4 +2NaOH=Na 2 SO 4 +2H 2 O
- соль+соль AgNO 3 +NaCl=AgCl+NaNO 3
- соль+щелочь CuSO 4 +2NaOH=Cu(OH) 2 +Na 2 SO 4
- соль+кислота Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2

Применение солей
1-5- производство химических веществ (соляной кислоты, гидроксида натрия, хлора, натрия, соды), 6- для консервирования, 7- приправа к пище, 8- производство мыла

Домашнее задание
- 1 уровень. Осуществите превращения: Ba → BaO → Ba(OH) 2 →BaCI 2 → BaSO 4
- 2 уровень. Из предложенных формул веществ составьте два любых генетических ряда и напишите уравнения реакций: Cu, AI 2 (CO 3 ) 3 , Na 2 SO 4 , AI(OH) 3 , AI 2 O 3 , CuO, NaOH, CuCI 2 , AI, S, O 2 , Cu(OH) 2 , CO 2 , HNO 3 , H 2 CO 3 , MgO, SO 2 .
- 3 уровень. Составьте уравнения реакций, иллюстрирующих взаимосвязь между различными классами неорганических соединений (цепочка из 4-6 звеньев), которая начинается неметаллом и заканчивается металлом.

Спасибо за внимание!


















![Классификация солей соли Средние Кислые Двойные Основные ZnOHCl KHSO 4 KNaSO 4 KCl Комплексные K 3 [Fe(CN) 6 ]](https://fsd.multiurok.ru/html/2021/10/11/s_61643fe34aec4/img12.jpg)










































