ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
А.М. БУТЛЕРОВА
Теория химического строения органических соединений раскрывает закономерности и порядок связи атомов друг с другом в молекулах. Разработана А.М. Бутлеровым в 1861г.
Основные положения теории.
Атомы в молекулах органических веществ соединены между собой химическими связями в определенной последовательности согласно их валентности. Углерод в органических соединениях всегда четырехвалентен.
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определенное число химических связей
Формулы строения:
а) структурная формула - описывает порядок соединения атомов в молекуле, т.е. ее химическое строение.
Н Н Н Н
׀ ׀ ׀ ׀
Н – С – С – С – С – Н СН3 – СН2 – СН2 – СН3
׀ ׀ ׀ ׀
Н Н Н Н
полная структурная формула сокращенная структурная формула
б) молекулярная (брутто) формула C4H10, показывает только, какие элементы и в каком соотношении входят в состав вещества (т.е. качественный и количественный элементный состав), но не отражает порядка связывания атомов.
Свойства органических веществ зависят не только от их качественного и количественного состава, но и от порядка их расположения атомов в молекуле, т.е. от химического строения молекулы.
Например, н-бутан и изобутан имеют одну молекулярную формулу C4H10, но разную последовательность связей
Н Н Н Н Н Н Н
׀ ׀ ׀ ׀ ׀ ׀ ׀
Н – С – С – С – С – Н Н – С – С – С – Н
׀ ׀ ׀ ׀ ׀
Н Н Н Н Н - С -Н
׀
н-бутан Н изо-бутан
Изомеры - вещества, имеющие одинаковый количественный и качественный состав молекул, но различное химическое строение и свойства
Существует два основных типа изомерии – структурная и пространственная.
1. Структурная изомерия определяется различным порядком соединения атомов в молекуле. Различают три вида структурной изомерии:
изомерия углеродного скелета - вид изомерии, связанный с изменение строения углеродной цепи, называется. Например, пентан имеет следующие изомеры:
С
׀
С – С – С – С – С С - С – С – С С - С – С
׀ ׀
С С
н-пентан, Tкип.= +36°С 2-метилбутан, Ткип.= +27°С 2,2 –диметилпропан, Ткип.= +5°С
Изомерия положения кратной связи или функциональной группы- вид изомерии, связанный с изменением места расположения кратной связи или атомов и групп атомов, заместивших атомы водорода в углеродной цепи. Например,
СН3 - СН2 – СН = СН2 и СН3 - СН = СН – СН
бутен-1 бутен-2
СН3 - СН2 – СН2-ОН и СН3 - СН – СН3
пропанол-1 ׀
ОН пропанол-2
межклассовая изомерия – это вид изомерии, при котором изомеры имеют одинаковую молекулярную формулу, но относятся к разным классам органических соединений. Например, этиловый спирт и диметиловый эфир отвечают формуле С2Н6О:
СН3 - СН2 - ОН СН3 - О - СН3
спирт Tкип.= +78,4°С эфир Tкип.= -23,7°С
2. Пространственная изомерия обусловливается различным расположением атомов и групп атомов в пространстве.
Пространственная изомерия подразделяется на:
а)геометрическую (цис- и транс-изомерию), она возможна при наличии двойной связи в корне молекулы:
СН3 СН3 СН3 Н
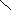
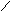
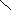
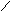
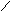
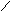 С = С С = С
С = С С = С
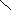
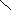
Н Н Н СН3
цис-изомер транс-изомер
б)Оптическая (зеркальная), она возможна при наличии ассиметричного атома углерода (т.е. при атоме углерода должно быть 4 разных заместителя)
Атомы или группы атомов, образующие молекулу, взаимно влияют друг на друга, от чего зависят и химические свойства соединения.