
«Вдруг раздались раскаты грома,
и от горного пламени покатились
вниз черные (серные) шары.
Все разбежались.
Плиний поднялся и, опираясь
на двух рабов, думал тоже уйти;
Но смертоносный пар окружил его со всех сторон, его колени подогнулись, он снова упал и задохнулся.»
Так погиб величайший ученый древности Плиний Старший.
Это случилось в 79 г н.э.
О каком событии идет речь?
Какова причина гибели людей?

Сера

Исторические сведения
- Сера известна с глубокой древности и упоминается Гомером в «Одиссее» как лекарство от недугов.
- В Древнем Египте серу использовали для приготовления красок, косметических средств.
- В Древней Греции, сжигая серу, дезинфицировали помещение и вещи.
- В Древнем Риме ее использовали для лечения кожных заболеваний.
- В средние века сера была одним из «начал» у алхимиков, считалась необходимой составной частью «философского камня».

Положение серы в периодической системе химических элементов Д.И. Менделеева

Строение атома серы
1 s 2 2 s 2 2 p 6 3 s 2 3 p 4 3 d 0
Размещение электронов по орбиталям (последний слой)
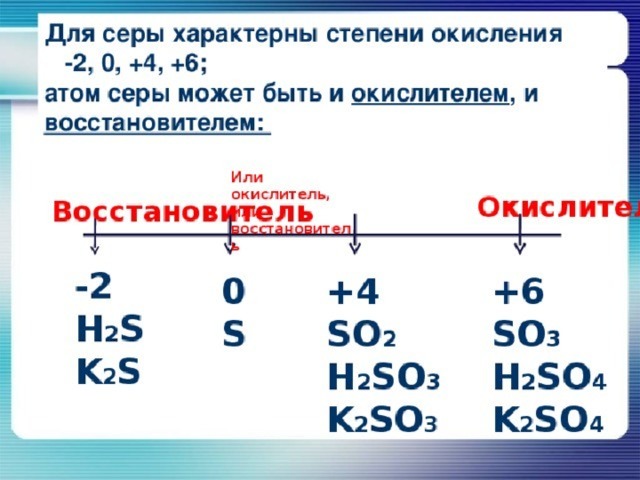
Степень окисления
+2, -2
+4
+6

Физические свойства серы
- Твёрдое кристаллическое вещество желтого цвета, без запаха
- Плохо проводит теплоту и не проводит электрический ток
- Сера в воде практически не растворяется
- Температура плавления 120 0 С

Нахождение серы в природе
Сера является на 16-м месте по распространённости в земной коре. Встречается в свободном (самородном) состоянии и связанном виде .

Сера также встречается в виде сульфатов - солей серной кислоты - мирабилит

Пирит – «огненный камень» (соединение серы в природе)

Сера в природе
Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.

Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
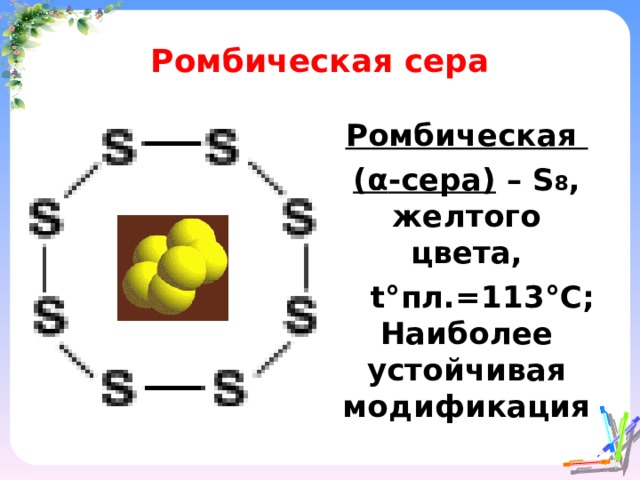
Ромбическая сера
Ромбическая
( α -с ера) – S 8 , желтого цвета,
t° пл.=113 °C ; Наиболее устойчивая модификация

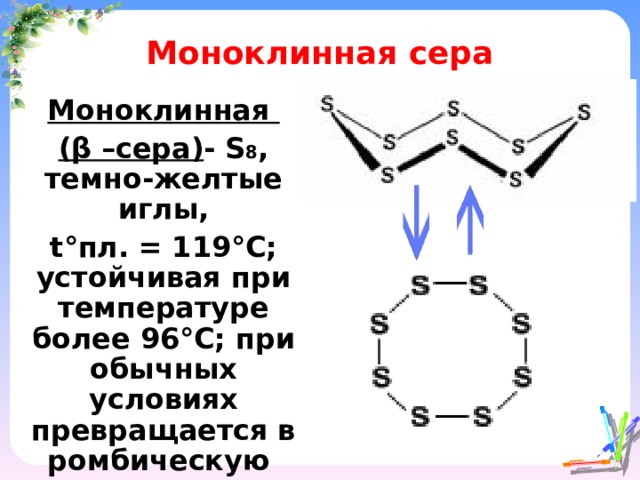
Моноклинная сера
Моноклинная
( β –сера) - S 8 , темно-желтые иглы,
t° пл. = 119 °C ; устойчивая при температуре более 96 ° С; при обычных условиях превращается в ромбическую

Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива и через некоторое время становится хрупкой, приобретёт желтый цвет, т.е
превращается в ромбическую серу

Химические свойства
Закончите уравнения реакций:
Сера – восстановитель
Сера – окислитель
S + O 2 =
S + F 2 =
S + H 2 =
S + Na =
S + Fe =
S + Hg =

Химические свойства
Закончите уравнения реакций:
Сера – восстановитель
Сера – окислитель
H 2 S
S + H 2 =
S + Na =
S + Fe =
S + Hg =
SO 2
S + O 2 =
S + F 2 =
Na 2 S
2
3
SF 6
FeS
HgS

Химические свойства серы (восстановительные)
Сера проявляет в реакциях с сильными окислителями:
S - 2ē S +2 ; S - 4ē S +4 ; S - 6ē S +6
1) C кислородом:
S + O 2 t S +4 O 2
2S + 3O 2 t ; Р t 2S +6 O 3
2) С галогенами (кроме йода)
S + Cl 2 S +2 Cl 2
3) С кислотами - окислителями:
S + 2H 2 SO 4(конц) 3S +4 O 2 + 2H 2 O
S + 6HNO 3(конц) H 2 S +6 O 4 + 6NO 2 + 2H 2 O
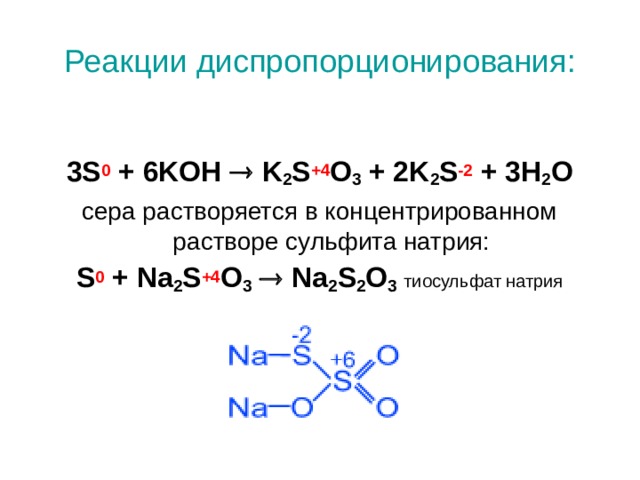
Реакции диспропорционирования:
3S 0 + 6KOH K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O
сера растворяется в концентрированном растворе сульфита натрия:
S 0 + Na 2 S +4 O 3 Na 2 S 2 O 3 тиосульфат натрия

Химические свойства серы (окислительные)
S 0 + 2ē S -2
4) Сера реагирует со щелочными металлами без нагревания:
2 Na + S Na 2 S
c остальными металлами (кроме Au , Pt ) - при повышенной t :
2Al + 3S – t Al 2 S 3
Cu + S – t CuS
5) С некоторыми неметаллами сера образует бинарные соединения:
H 2 + S H 2 S
2P + 3S P 2 S 3
C + 2S CS 2

Химические свойства
Составьте уравнение реакции взаимодействия серы с бертолетовой солью, зная, что в результате ее образуется хлорид калия и сернистый газ.
Рассмотрите эту реакцию как окислительно-восстановительную


ДОМАШНЕЕ ЗАДАНИЕ
§ 17 , задания 1-3 устно
Задача В зернохранилищах для истребления насекомых сжигают серу, исходя из нормы 24 г на 1 м 3 помещения. Рассчитайте, сколько килограмм оксида серы ( IV ) должно получиться при газации помещения 100 м 3
Напишите уравнения реакций
S → SO 2 → SO 3 → H 2 SO 4 → c а so 4

















































