СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

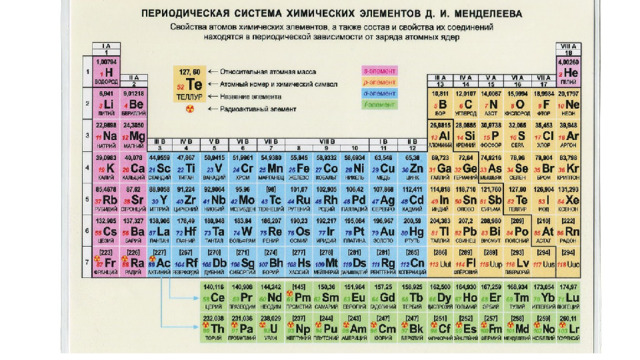
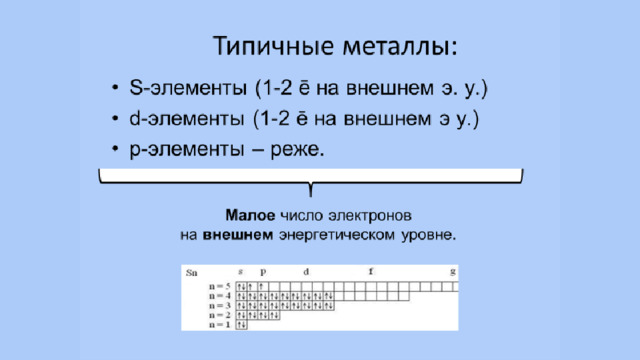
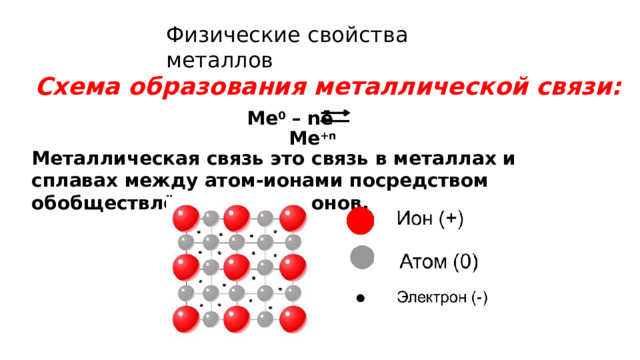
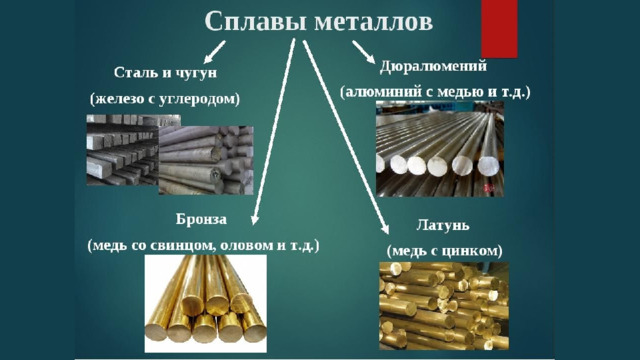
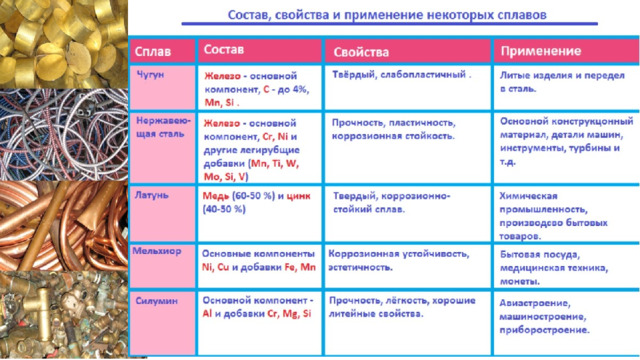
Урок по теме "Положение металлов в периодической системе химических элементов Д. И. Менделеева. Общие свойства металлов и их сплавов", 11 класс
Категория:
Химия
12.02.2023 21:01
Учебник:
Химия. Основы общей химии. 11 класс. Базовый уровень. Рудзитис Г.Е., Фельдман Ф.Г.-М.: 2012. - 159с.
Тема:
Глава V. Металлы