Урок на тему: Оксид фосфора(V). Фосфорная кислота и её соли. Фосфорные удобрения.
Подготовила и провела учитель химии 1КК . Калинина Е.И.
С.Новосильское 2022г
Тема урока: Оксид фосфора(V). Фосфорная кислота и её соли. Фосфорные удобрения.
Цели урока: формирование знаний о свойствах оксида фосфора(V), фосфорной кислоты, кислых солях фосфорной кислоты, реакциях неполной нейтрализации; продолжение формирования умений составлять уравнения химических реакций.
Задачи:
Образовательная : сформировать знания об оксиде фосфора(V), о фосфорной кислоте, ее физических и химических свойствах, получении и применении; обеспечить в ходе урока усвоение знаний о солях фосфорной кислоты, их свойствах, получении и применении.
Развивающая : способствовать развитию познавательного интереса, развитию выделять главное, логически излагать свои мысли.
Воспитательная : содействовать в ходе урока формированию научной картины мира, содействовать нравственному воспитанию школьников.
Тип урока: комбинированный
Оборудование: Учебник, ПСХЭ, химическая посуда.
Реактивы: фосфорная кислота, фосфат калия, нитрат серебра, гидроксид натрия, индикаторы, гранулы цинка
Ход урока
Организационный этап
Актуализация опорных знаний и мотивация учебной деятельности
Устный опрос учащихся по теме « Фосфор:
1. Где расположен фосфор в периодической таблице химических элементов Д. И. Менделеева?
2. Сколько энергетических уровней у атома фосфора?
3. Сколько электронов на внешнем энергетическом уровне находится у атома фосфора?
4. Заряд ядра атома фосфора?
5. Назовите высшую и низшую степени окисления фосфора?
6. В виде каких аллотропных модификаций встречается фосфор?
7. Чем отличается белый фосфор от красного?
8. Какие свойства фосфор проявляет в реакциях?
9. Где применяется фосфор?
Примерные ответы:
1. Фосфор расположен в 3 периоде, 5 группе главной подгруппе периодической таблицы химических элементов Д.И. Менделеева.
2. У атома фосфора 3 энергетических уровня
3. У атома фосфора на внешнем энергетическом уровне находится 5 электронов.
4. Заряд ядра атома фосфора равен + 15
5. Высшая + 5, низшая – 3.
6. Фосфор образует несколько аллотропных модификаций: белый, красный и черный фосфор.
7. Белый фосфор не растворим в воде, хорошо растворим в сероуглероде. Белый фосфор очень ядовит, светится в темноте. Красный фосфор не растворяется ни в воде, ни в сероуглероде. Неядовит и не светится в темноте.
8. Фосфор в реакциях чаще всего бывает восстановителем (с кислородом, галогенами, бертолетовой солью, азотной кислотой), с металлами проявляет окислительные свойства.
9. Фосфор применяют в производстве фосфорной кислоты, лекарственных препаратов, в производстве спичек.
Постановка целей урока
Изучение нового материала
Оксид фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O2 = 2P2O5
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания), образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании образуется ортофосфорная кислота H3PO4:
P2O5 + 3H2O = 2H3PO4 (t˚C)
При нагревании H3PO4 можно получить пирофосфорную кислоту H4P2O7:
2H3PO4 = H2O + H4P2O7 (t˚C)
Ортофосфорная кислота
Наибольшее практическое значение имеет ортофосфорная кислотаН3РO4.
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
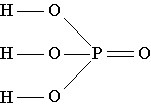
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O = 2H3PO4 (t˚C)
2) Взаимодействие природной соли – ортофосфата кальция с серной кислотой при нагревании:
Сa3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 (t˚C)
3) При взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
Применение
В производстве фосфорных удобрений
В производстве кормовых добавок для животноводства
В производстве моющих средств (фосфаты щелочных металлов)
Для создания защитных покрытий на металлах
Химические свойства:
Свойства, общие с другими кислотами
Специфические свойства
1. Водный раствор кислоты изменяет окраску индикаторов на красный:
Ортофосфорная кислота диссоциирует ступенчато:
H3PO4 ↔ H+ + H2PO4-(дигидроортофосфат-ион)
H2PO4- ↔ H+ + HPO42-(гидроортофосфат-ион)
HPO42- ↔ H+ + PO43-(ортофосфат-ион)
2. Взаимодействует с металлами в ряду активности до (Н2):
металл+ H3PO4=соль+Н2↑
3. Взаимодействует с основными оксидами:
оксид металла + H3PO4 = соль + Н2О
4. Взаимодействует с основаниями Ме(ОН)n:
основание + H3PO4 = соль + Н2О
если кислота в избытке, то образуется кислая соль:
H3PO4(изб) + NaOH = NaH2PO4+ H2O или
H3PO4(изб) + 2NaOH =Na2HPO4 + 2H2O
5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли:
H3PO4 + NH3 = NH3H2PO4
H3PO4 + 2NH3 = (NH3)2HPO4
H3PO4 + 3NH3 = (NH3)3PO4
6. Реагирует с солями слабых кислот:
2H3PO4+3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑
1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту:
2H3PO4 (t˚C) → H2O + H4P2O7
H4P2O7 (t˚C)→ H2O + 2HPO3
2. Качественная реакция наPO43- - фосфат ион.
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3
3. Играет большую роль в жизнедеятельности животных и растений. Её остатки входят в состав АТФ. При разложении АТФ выделяется большое количество энергии, что очень важно для живых организмов.
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавкиE338. Применяется как регулятор кислотности в газированных напитках.
Первичное закрепление
1) «Проверь себя»
Закончите высказывания:
Оксид фосфора (V) образуется при горении …
Формула фосфорной кислоты…
Фосфорную кислоту получают из …
Фосфорная кислота – это … вещество, …растворимое в воде
Качественная реакция на фосфорную кислоту и ее соли – это взаимодействие с … . Признак реакции - …
Фосфорная кислота применяется в производстве …
Фосфорная кислота может давать три ряда солей: кислые соли - … и … , средние соли – …
Осуществите цепочку превращений
I – в
Р2О5 → Н3РО4 → Na3PO4 → Ca3(PO4)2 → H3PO4 → Zn3(PO4)2
II – в
P → Ca3P2 → PH3 → Р2О5 → Na3PO4 → Ag3PO4
III - в
Ca3(PO4)2 → P → PCl5 → Н3РО4 → K3PO4 → Fe3(PO4)2
Решение:
I – в
1) P2O5 + 3H2O ® 2H3PO4
2) H3PO4 + 3NaOH → Na3PO4 + 3H2O
3) 2Na3PO4 + 3CaCI2 → Ca3(PO4)2 + 6NaCl
4) Ca3(PO4)2 + 3H2SO4 ® 3CaSO4 + 2H3PO4
5) 2H3PO4 + 3ZnCI2 → Zn3(PO4)2 + 6HCl
II – в
1) 2Р + 3Са → Са3Р2
2) Са3Р2 + 6НCI → 3CaCI2 + 2PH3
3) 2PH3 + 4O2 → P2O5 + 3H2O
4) P2O5 +6NaOH → 2Na3PO4 + 3H2O
5) Na3PO4 + 3AgNO3 → Ag3PO4 ↓ + 3NaNO3
III – в
1) Ca3(PO4)2 + 3SiO2 + 5C → 2P + 3CaSiO3 + 5CO
2) 2P + 5CI2 → 2PCI5
3) PCI5 + 4H2O → H3PO4 + 5HCI
4) H3PO4 + 3KOH → K3PO4 + 3H2O
5) 2K3PO4 + 3FeCI2 → Fe3(PO4)2 + 6KCI
Домашнее задание: § 30, читать, № 1, 3 письменно, подготовить сообщение об использовании или производстве фосфорных удобрений
Рефлексия



























