Контрольно-оценочные материалы по предмету «Химия» для 9 класса составлены на основании Рабочей программы по предмету «Химия» для 8-9 классов, утвержденной приказом МОБУ СОШ
д.Алексеевка от «___»_______20____г. № ______-ОД
Пояснительная записка
На выполнение контрольной работы отводится 45 минут. Работа состоит из 3 частей и включает 9 заданий.
Часть 1 включает 5 заданий базового уровня (А1 – А5). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ - 1 балл. Максимальный балл за 1 часть – 5 баллов.
Часть 2 состоит из 2 заданий повышенного уровня (В1 – В2), на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ - 2 балла. Максимальный балл за 2 часть – 4 балла.
Часть 3 содержит 2 задания (С1-С2) , которое требует полного ответа. За правильный ответ - 3 балла.
Баллы, полученные за выполненные задания, суммируются.
Максимальное количество баллов – 15.
Ответы
Итоговая контрольная работа по химии 9 класс
| Часть | Вариант 1 | Вариант 2 | Баллы |
| 1 | 2 | 3 | 1 |
| 2 | 3 | 2 | 1 |
| 2 | 3 | 3 | 1 |
| 4 | 1 | 4 | 1 |
| 5 | 1 | 4 | 1 |
| 6 | 23 | 13 | 2 |
| 7 | 241 | 214 | 2 |
| 8 | 1)Составлен электронный баланс: 2Cl-1 - 2 ē → Cl20 │ 2 │3 N+5 + 3 ē = N+2 │ 3 │2 2) Определён окислитель и восстановитель: N+5(HNO3) — окислитель, Cl-1(HCl) — восстановитель. 3) Составлено уравнение реакции: 6HCl + 2HNO3 → 2NO + 3Cl2 + 4H2O | 1) Составим электронный баланс: S+6 + 2ē = S+4 │2 │5 10 P0 - 5ē = P+5 │5 │2
2) Укажем, что S+6 (H2SO4) — окислитель, а P0(P) —восстановитель 3) Расставим коэффициенты в уравнений реакции: 2P + 5H2SO4 →2H3PO4 + 5SO2 + 2H20 | 3 |
| 9 | 89,6 | 4,48 | 3 |
Критерии оценки
| 0 - 7 | 8 - 10 | 11 - 12 | 13 - 15 |
| «2» | «3» | «4» | «5» |
Для детей с ОВЗ: "5"- 10баллов и выше; "4"-8-9 баллов;"3"-5-7 баллов; "2"-0-4 балла.
Итоговая контрольная работа по химии 9 класс
Вариант 1
Часть I Один правильный ответ
1. К реакциям разложения относиться реакция
1. CaO+SiO2=CaSiO3 2. 2HgO=2Hg+O2
3. Zn+2HCI=ZnCI2+H2 4. 2Mg+O2=2MgO
2. Вещества, формулы которых — Al2O3 и K2SO4, являются соответственно
1) оснόвным оксидом и кислотой 2) амфотерным гидроксидом и солью
3) амфотерным оксидом и солью 4) оснόвным оксидом и основанием
3. Оксиду N(III) соответствует кислота
1) HNO2 2) HNO3 3) NH3 4) NaNO2
4. Верны ли суждения о способах разделения смесей?
А. Выпаривание относят к физическим способам разделения смесей.
Б. Разделение смеси воды и этанола возможно способом фильтрования.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
5. В реакции 3CuO + 2NH3 =3Cu+ N2+ 3H2O
изменение степени окисления окислителя соответствует схеме
1) +2 → 0 2) −3 → 0 3) −2 → 0 4) 0 → +2
Часть 2
6. Выбрать 2 правильных ответа.
Для метилового спирта верны следующие утверждения
1) является газообразным веществом (н. у.)
2) в молекуле имеется гидроксильная группа
3) ядовит
4) плохо растворим в воде
5) вступает в реакцию с серебром
7. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
| ВЕЩЕСТВА | | РЕАКТИВ |
| А) NaNO3 и Ca(NO3)2 Б) FeCl2 и FeCl3 В) H2SO4 и HNO3
| | 1) BaCl2 2) Na2CO3 3) HCl 4) NaOH |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
8. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
P + H2SO4 →H3PO4 + SO2 + H20
Определите окислитель и восстановитель
9. Объём водорода (н.у.), образовавшийся при взаимодействии 26 г цинка с раствором серной кислоты, составляет ______ л.
Итоговая контрольная работа по химии 9 класс
Вариант II
Часть 1
1. Какая пара веществ не взаимодействует между собой?
1. Na и H2O 2. CuO и H2SO4 3. HCI и SO2 4.Ca(OH)2 и CO2
2. Оснόвному, амфотерному и кислотному оксидам соответствует ряд формул
1) Li2O – Na2O – K2O 2) MgO – Al2O3 – SiO2
3) B2O3 – CO2 - NO2 4) Na2O - MgO – Al2O3
3. Формула высшего оксида элемента, имеющего строение электронной оболочки 2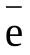 ,8
,8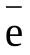 ,7
,7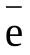
1) P2O3 2) SO3 3) Сl2O7 4) Al2O3
4. Верны ли следующие суждения о правилах безопасной работы в лаборатории?
А. При нагревании пробирки с раствором поваренной соли необходимо использовать защитные очки.
Б. При перемешивании жидкости в пробирке можно закрыть отверстие пробирки рукой.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
5. В реакции, схема которой CuCl2 + HI → I2 + HCl восстановителем является
1)Cu+2 2) Cl-1 3) H+1 4) I-1
Часть 2
6. Выбрать 2 правильных ответа.
Уксусная кислота обладает следующими свойствами:
1) состоит из трёх элементов
2) при комнатной температуре — твёрдое вещество, без запаха
3) хорошо растворима в воде
4) является очень сильной кислотой
5) входит в состав морской воды
7. Установите соответствие между названием вещества и реагентами, с каждым из которых это вещество может взаимодействовать
| НАЗВАНИЕ ВЕЩЕСТВА | | РЕАГЕНТЫ |
| А) магний Б) оксид цинка В) сульфит натрия | | 1) KOH , H2SO4 2) CO2 , H2O 3) NaCl, LiOH 4) BaCl2, HBr 5) H2SO4 , NaCl |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
8. Используя метод электронного баланса, составьте уравнение реакции, соответствующее схеме превращений
HCl + HNO3 → NO + Cl2 + H2O
Определите окислитель и восстановитель.
9. Объём кислорода (н.у.), необходимый для окисления 25,6 г меди, составляет ______ л.

























