Урок химии 9
Урок – исследование
Тема «Свойства серной кислоты»
Цель урка:
1.Расширение и углубление знаний о кислотах на примере серной кислоты.
2. Экспериментально исследовать свойства разбавленной серной кислоты, типичные для кислот.
3. Установить реактив на серную кислоту и ее соли и экспериментально осуществить данную качественную реакцию.
Задачи: образовательные: актуализировать опорные знания об основных классах неорганических веществ; расширить и углубить знания о кислотах, окислительно-восстановительных реакциях; продолжить формировать умение правильно составлять молекулярные и ионные уравнения реакций, расставлять коэффициенты методом электронного баланса; формировать умение выдвигать гипотезу, проверять ее, устанавливать закономерность, искать новые факты, объяснять причину этих изменений;
Обучающая:
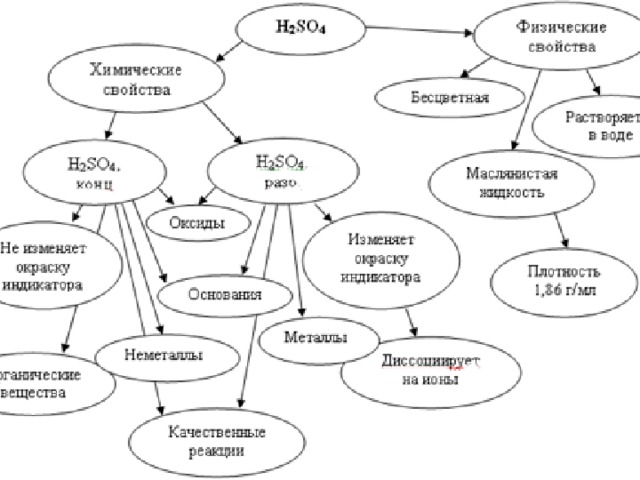
Знать физические и химические свойства серной кислоты
Знать области применения серной кислоты. Технику безопасности при обращении с серной кислотой.
Уметь составлять уравнения химических реакций характерные для серной кислоты с точки зрения окислительно- восстановитных процессов.
Развивающая: создать условия для понимания у учащихся взаимосвязи между свойствами
веществ, их получением и применением, развивать познавательную активность, умения наблюдать и
рассуждать, делать выводы, используя при этом проблемный, исследовательский,
Воспитывающая: Формирование интереса к учению, стремления добиваться успеха в учебе за счет добросовестного отношения к своему труду, создание положительной психологической атмосферы, воспитание чувства взаимного уважения между ребятами для максимального раскрытия их способностей на уроке.
Планируемые результаты:
Регулятивные УУД: определить последовательность действий для получения результата, наблюдать и делать необходимые выводы по наблюдениям во время проведения опытов, закрепить теоретические знания при выполнении химического эксперимента, выделять главное в изучаемом материале, логически излагать свои мысли.
Познавательные УУД: научиться проводить химический эксперимент, используя теоретические знания, знать свойства кислот в свете теории электролитической диссоциации и свойства солей серной кислоты.
Коммуникативные УУД: уметь работать в группах, уметь представить результаты своих опытов.
Личностные УУД: осознание своей роли каждым участником группы, осознание своей роли в группе для достижения общей цели.
Лабораторный опыт проводится по группам (2 группы по 4 человека).
Оборудование: Таблица «Техника безопасности», реактивы, пробирки,
Планируемые результаты:
Регулятивные УУД: определить последовательность действий для получения результата, наблюдать и делать необходимые выводы по наблюдениям во время проведения опытов, закрепить теоретические знания при выполнении химического эксперимента, выделять главное в изучаемом материале, логически излагать свои мысли.
Познавательные УУД: научиться проводить химический эксперимент, используя теоретические знания, знать свойства кислот в свете теории электролитической диссоциации и свойства солей серной кислоты.
Коммуникативные УУД: уметь работать в группах, уметь представить результаты своих опытов.
Личностные УУД: осознание своей роли каждым участником группы, осознание своей роли в группе для достижения общей цели.
Тип урока: урок освоения новых знаний; урок-исследование
Оборудование и наглядность: ПСХЭ Д.И. Менделеева, таблица «Растворимость кислот, оснований и солей в воде»,
таблица «Электрохимический ряд напряжений металлов», компьютер, проектор презентация к уроку и видеофрвгменты.
Оборудование к лабораторным опытам.
пробирки, спиртовка, штатив, пробиркодержатель, H2SO4 (в растворе ), лакмус, медь, цинк, магний, оксид меди (ІІ), оксид цинка, гидроксид натрия (раствор), гидроксид цинка, карбонат кальция (мел).
Формы работы: фронтальная, работа в группах, работа в парах, самостоятельная работа,
Девиз урока: «Познание начинается с удивления» (Аристотель).
Виды деятельности: поисковый и репродуктивный.
Использование современных технологий: информационно коммуникативные технологии, ЭОР, технология критического мышления.
Ход урока
Мотивация к учебной деятельности
Ребята, поприветствуем друг друга, улыбнёмся чтоб поднять настроение, ибо позитивный эмоциональный настрой нужен нам сегодня на протяжении всего урока.
Актуализация знаний
На столах лежат карточки с тестами, чтобы вспомнить пройденный материал, выполняем, затем группы поменяетесь карточками для взаимопроверки ответы и критерии оценивания будут на экране. (слайд №1)
Тест по теме “ Сера. Соединения серы со II, IV, VI валентностью”.
1) В ряду химических элементов O →S → Se →Te неметаллические свойства:
а) усиливаются
б) не изменяются
в) ослабевают
г) изменяются периодически
2) Найдите формулу, соответствующую электронной конфигурации внешнего электронного слоя атома серы.
а) ….3s23p4
б)…..4s24p4
в)…..6s26p4
г)…..4s24p5
3) Окислительные свойства серы проявляются в реакциях с
а) с кислородом
б) фтором
в) металлами
г) водородом
4) Определите вещество, с которым оксид серы (VI) не будет взаимодействовать.
а) гидроксид кальция
б) оксид бария
в) вода
г) оксид углерода (IV)
5) Укажите названия веществ, имеющих следующие формулы (по порядку)
Na2SO3, K2SO4, Na2S
а) сульфит натрия, сульфит калия, сульфид натрия
б) сульфат натрия, сульфат калия, сульфит натрия
в) сульфит натрия, сульфат калия, сульфит натрия
г) сульфит натрия, сульфат калия, сульфид натрия.
Формулирование темы урока, постановка цели
Первое упоминание об этом веществе появилось ещё в 10 веке. Когда алхимикам удалось получить его из купоросов и дали ему название купоросное масло, а в 1805 году производство этого вещества было поставлено на промышленную основу на заводе Голицина.
(Слайд №2) что это?
Формулировка темы и целеполагание: учащиеся формулируют тему урока.
Девиза урока
Слайды 3,4,5
Этап усвоения новых знаний
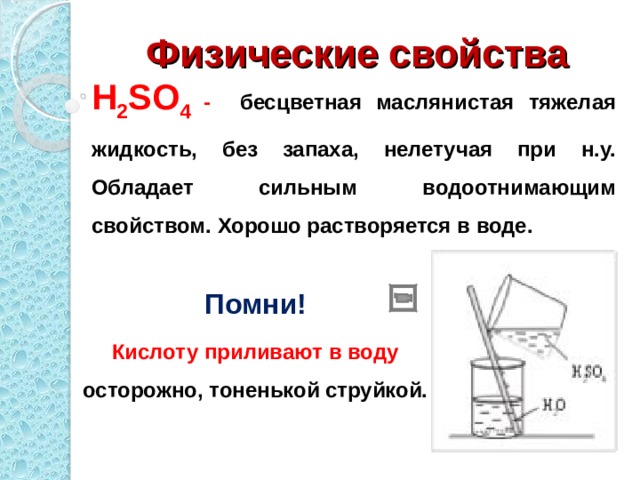
Используя учебник на стр. , установите структурную формулу кислоты и прочитайте информацию о физических свойствах кислоты.
Фронтальная работа. Слайд №6,7
Учитель:
Действительно, серная кислота очень гигроскопична, особенно концентрированная, вы убедитесь , просмотрев следующий видеофрагмент «Опыт с серной кислотой».
Вопросы после просмотра видео:
1 группа: 1)Почему концентрированная серная кислота обугливает органические вещества?
2)Какой атом в молекуле концентрированной серной кислоты является окислителем?
(Она сильный окислитель и отнимает воду у органических веществ)
2 группа: Что является продуктом восстановления серы в реакциях концентрированной серной кислоты с металлами и от чего это зависит?
Слайд № 9
3 этап. Химические свойства серной кислоты.
Беседа:
Вам известно, что серная кислота – электролит.
- Дайте ее характеристику.
Учащиеся пишут в тетрадях, затем сверяют свои записи по слайду №10
- Запишите уравнения ступенчатой диссоциации серной кислоты и суммарное уравнение
H2SO4 = H+ + HSO4 (гидросульфат-ион)
протекает нацело и практически необратимо.
HSO4 ↔ H+ + SO42- (сульфат-ион)
обратима , но протекает в значительной степени.

H2SO4 = 2H+ + SO42-
- Какие два ряда солей образует серная кислота?
- Назовите вещества, формулы которых:
NaHSO4, KHSO4, Na2SO4, K2SO4.
Теперь предлагаю вам исследовать свойства разбавленной серной кислоты, пользуясь инструкцией.
ИНСТРУКЦИЯ по исследованию свойств серной кислоты.
С какими из предложенных веществ будет реагировать разбавленная серная кислота: лакмус, цинк, оксид углерода (IV), оксид меди (II), гидроксид натрия, гидроксид меди (II), карбонат натрия. Обоснуйте ваш выбор. Слайд № 11
Осуществите эксперименты. Результаты исследования, наблюдения и уравнения химических реакций оформите в виде таблицы:
| Вещества | Наблюдения. | Уравнения химических реакций. |
|
|
|
|
Осуществите качественную реакцию на серную кислоту.
Сделайте вывод о химических свойствах разбавленной серной кислоты.
Теперь предлагаю исследовать свойства разбавленной серной кислоты, пользуясь инструкцией.
Практикум №1 «Химические свойства разбавленной серной кислоты»
Цель : подтвердить, что в разбавленных растворах серная кислота проявляет все типичные свойства кислот; закрепить навык работы с кислотами, т. е. соблюдать правила техники безопасности ; показать умение работать в группах
Планируемый результат работы группы: Составить уравнения взаимодействия разбавленной серной кислоты с указанным веществом в инструктивной карточке, сделать вывод об отношении разбавленной серной кислоты к указанным веществам и озвучить, вынести на доску уравнение реакции в молекулярной форме, конспектировать выступления каждой группы.
Общий эксперемент Как обнаружить серную кислоту и её соли среди других веществ?
Химический эксперимент
Перед вами в 2х пробирках находятся растворы солей натрия – сульфата, карбоната Ваша задача определить каждое вещество и результаты записать себе в тетрадь в молекулярном и ионном виде.
Ответ подтвердить опытом и записать необходимые уравнения реакции
Реактивы и оборудование:
Н 2SO4(р-р); (р-р) BaCI2; (р-р) Na2SO4 ; (р-р)НCI; штатив для пробирок; пипетка.
Закрепление нового материала:
Вопросы для закрепления по группам
1.Царица Сера разрешила двум принцам поздороваться с принцессой Серной кислотой, поцеловав ей ручку. Первым к ней подошел Алюминий, но его поцелуй ничем не тронул сердце принцессы. Вторым был принц Лакмус. Поцеловав ручку, он покраснел от смущения. Почему так произошло?
2.Серная кислота – загадочная незнакомка. Кто-нибудь знает ее родителей? Союз газа и воды привел к появлению необыкновенной особы. Ее назвали Серной кислотой.
3.Почему концентрированную серную кислоту хранят в стальных резервуарах, для хранения меньше 75% - резервуары покрываются кислотоупорными материалами?
4.Можно ли с помощью кусочка мела определить, в какой склянке разбавленная соляная, а в какой – разбавленная серная кислота? Почему?
На каждую букву слова кислота (написано вертикально) придумать слово, звучавшее на уроке, характеризующее серную кислоту и ее свойства.
Технологическая карта№2
Выберите вещества, вступающие в реакцию с разбавленной серной кислотой. Поставьте знак + или ‑
| Вещество | Реакция |
Оксид серы (4) |
|
Оксид алюминия |
|
Соляная кислота |
|
Хлорид бария |
|
Гидроксид калия |
|
Силикат лития |
|
Гидроксид железа (2) |
|
Рефлексия:
Лист самооценки знаний ученика______________________________________
| № | Вид работы Смог ли я… | Самооценка (0-5 баллов) | Надо ли мне заниматься по этой теме еще?(+\-) |
| 1 | Правильно провести эксперименты |
|
|
| 2 | Рассуждать, анализировать, сравнивать и делать выводы. |
|
|
| 3 | Определить окислитель и восстановитель в о-в реакции. |
|
|
| 4 | Написать полное ионное и сокращенное уравнения. |
|
|
| 5 | Моя общая оценка |
|
|
Домашняя работа:§ и тесты
Оценочный лист группы 1
Оценочный лист группы 2
Вопросы после просмотра видео:
1 группа: 1)Почему концентрированная серная кислота обугливает органические вещества?
2)Какой атом в молекуле концентрированной серной кислоты является окислитель?
Вопросы после видео
2 группа:
1.Что является продуктом восстановления серы в реакциях концентрированной серной кислоты с металлами и
2. от чего это зависит?
1 группа: 1)Почему концентрированная серная кислота обугливает органические вещества?
2)Какой атом в молекуле концентрированной серной кислоты является окислителем?
(Она сильный окислитель и отнимает воду у органических веществ)
2 группа: Что является продуктом восстановления серы в реакциях концентрированной серной кислоты с металлами и от чего это зависит?
1 группа
1.Царица Сера разрешила двум принцам поздороваться с принцессой Серной кислотой, поцеловав ей ручку. Первым к ней подошел Алюминий, но его поцелуй ничем не тронул сердце принцессы. Вторым был принц Лакмус. Поцеловав ручку, он покраснел от смущения. Почему так произошло?
2 Почему концентрированная серная кислота является сильным окислителем?
Выберите вещества, вступающие в реакцию с разбавленной серной кислотой. Поставьте знак + или ‑
| Вещество | Реакция |
Оксид серы (4) |
|
Оксид алюминия |
|
Соляная кислота |
|
Хлорид бария |
|
Гидроксид калия |
|
Силикат лития |
|
Гидроксид железа (2) |
|
Группа№ 2
1.Можно ли с помощью кусочка мела определить, в какой склянке разбавленная соляная, а в какой – разбавленная серная кислота? Почему?
2.Почему концентрированную серную кислоту хранят в стальных резервуарах, для хранения меньше 75% - резервуары покрываются кислотоупорными материалами?
Выберите вещества, вступающие в реакцию с разбавленной серной кислотой. Поставьте знак + или ‑
| Вещество | Реакция |
Оксид серы (4) |
|
Оксид алюминия |
|
Соляная кислота |
|
Хлорид бария |
|
Гидроксид калия |
|
Силикат лития |
|
Гидроксид железа (2) |
|
1. Концентрированная серная кислота при комнатной температуре не действует на каждое из двух веществ:
А) Mg, Cu; Б) Na, Zn; В) Ca, Li; Г) Fe, Al.
2. Разбавленная серная кислота реагирует с каждым из веществ:
А) Cu и KO H; Б) Na2CO3 и Al(OH)3
В) AlCl3 и Ag; Г) FeSO4 и H2SO4
3. При разбавлении серной кислоты всегда приливают кислоту к воде. Чем опасно разбавление концентрированной серной кислоты приливанием к ней воды?:
А) Может возникнуть пожар;
Б) Может произойти разложение воды;
В) Может выделиться ядовитое вещество;
Г) Может произойти разбрызгивание раствора вследствие выделения теплоты.
4. Водный раствор серной кислоты реагирует с каждым из веществ:
А) С цинком и оксидом натрия;
Б) С железом и оксидом углерода (II);
В) С алюминием и хлоридом натрия;
Г) С медью и гидроксидом калия.
1. Концентрированная серная кислота при комнатной температуре не действует на каждое из двух веществ:
А) Mg, Cu; Б) Na, Zn; В) Ca, Li; Г) Fe, Al.
2. Разбавленная серная кислота реагирует с каждым из веществ:
А) Cu и KO H; Б) Na2CO3 и Al(OH)3
В) AlCl3 и Ag; Г) FeSO4 и H2SO4
3. При разбавлении серной кислоты всегда приливают кислоту к воде. Чем опасно разбавление концентрированной серной кислоты приливанием к ней воды?:
А) Может возникнуть пожар;
Б) Может произойти разложение воды;
В) Может выделиться ядовитое вещество;
Г) Может произойти разбрызгивание раствора вследствие выделения теплоты.
4. Водный раствор серной кислоты реагирует с каждым из веществ:
А) С цинком и оксидом натрия;
Б) С железом и оксидом углерода (II);
В) С алюминием и хлоридом натрия;
Г) С медью и гидроксидом калия.
ИНСТРУКЦИЯ по исследованию свойств серной кислоты.
Группа I
Осуществите эксперименты. Результаты исследования, наблюдения и уравнения химических реакций оформите в виде таблицы:
При выполнении эксперимента соблюдать технику безопасности.
| Вещества | Наблюдения. | Уравнения химических реакций. |
| Zn + H2SO4 |
|
|
| Cu + H2SO4 |
|
|
| CuO + H2SO4 |
|
|
Смеси подогреть слегка.
Перед вами в 2х пробирках находятся растворы солей натрия – сульфата, карбоната Ваша задача определить каждое вещество и результаты записать себе в тетрадь в молекулярном и ионном виде.
ИНСТРУКЦИЯ по исследованию свойств серной кислоты.
Группа II
При выполнении эксперимента соблюдать технику безопасности.Осуществите эксперименты. Результаты исследования, наблюдения и уравнения химических реакций оформите в виде таблицы:
| Вещества | Наблюдения. | Уравнения химических реакций. |
| NaOH + H2SO4 |
|
|
| Cu(OH)2 + H2SO4 |
|
|
| CaCO3 + H2SO4 |
|
|
Для реакций ионного обмена составьте ионные уравнения.
Перед вами в 2х пробирках находятся растворы кислот: серной и соляной Ваша задача определить каждое вещество и результаты записать себе в тетрадь в молекулярном и ионном виде.
Тест по теме “ Сера. Соединения серы со II, IV, VI валентностью”.
1) В ряду химических элементов O →S → Se →Te неметаллические свойства:
а) усиливаются б) не изменяются в) ослабевают г) изменяются периодически
2) Найдите формулу, соответствующую электронной конфигурации внешнего электронного слоя атома серы.
а) ….3s23p4 б)…..4s24p4 в)…..6s26p4 г)…..4s24p5
3) Окислительные свойства серы проявляются в реакциях с
а) с кислородом б) фтором в) металлами г) водородом
4) Определите вещество, с которым оксид серы (VI) не будет взаимодействовать.
а) гидроксид кальция б) оксид бария в) вода г) оксид углерода (IV)
5) Укажите названия веществ, имеющих следующие формулы (по порядку)
Na2SO3, K2SO4, Na2S
а) сульфит натрия, сульфит калия, сульфид натрия
б) сульфат натрия, сульфат калия, сульфит натрия
в) сульфит натрия, сульфат калия, сульфит натрия
г) сульфит натрия, сульфат калия, сульфид натрия.