
Химия Лекция Дисперсные системы. Коллоидные растворы.

ПЛАН
- История изучения растворов.
- Дисперсные системы.
- Коллоидные растворы.
- Свойства коллоидных систем.
- Значение коллоидных растворов.

В середине XIX века английский химик Томас Грэм обнаружил вещества с загадочными свойствами. При выпаривании их растворов получались аморфные студенистые массы. Они имели клеющие свойства. Клей по-гречески – «колла», поэтому Грэй назвал эти «аномальные вещества « коллоидами ».
В начале ХХ века выяснилось, что из одного и того же вещества можно приготовить и обычный и коллоидный раствор. В обычных растворах вещество находится в виде отдельных молекул или ионов, а в коллоидных - в виде более крупных частиц. Например, поваренная соль в органическом растворителе (бензоле) образует типичную коллоидную систему.
Томас Грэм
1805 - 1869

В 1903 г. австрийские ученые Рихард Зигмонди и Генри Зидентопф сконструировали щелевой ультрамикроскоп, с помощью которого можно было разглядеть частицы диаметром менее 0,01 мкм. Они-то и выдвинули идею универсальности коллоидного , или дисперсного (от лат. dispersus – измельченный), состояния вещества.
В любом коллоиде выделяются две фазы: сплошная (дисперсионная среда) и дисперсная – мелкие твердые частицы, капли жидкости либо пузырьки газа.
Фундаментальность открытия была отмечена в 1925 году присуждением Зигмонди Нобелевской премии по химии.
Рихард Адольф Зигмонди
Генри Фридрих Зидентопф
1865 - 1929
1865 - 1929

Мир коллоидных систем широк и разнообразен. Крайне редки газы, жидкости или твердые материалы, в которых отсутствуют коллоидные частицы. Получить их также сложно, как и совершенно химически чистое вещество.
В газообразной дисперсионной среде образуются аэрозоли (от гр. «аэр» – воздух и лат. «sovere» - растворять). Когда в ней распределены твердые частицы, получается дым, когда жидкие – туман, а смесь тех и других даёт смог.
Коллоидные растворы называются золями . В них твердые частицы, размером от 1 до 100 нм, распределены в жидкой дисперсионной среде.

Например, если к кипящей воде добавить несколько капель раствора FeCl 3 , то в результате гидролиза (FeCl 3 + 3H2O = Fe(OH) 3 + 3HCl) образуется совершенно прозрачный желтый золь.
Восстанавливая водный раствор AuCl 3 , можно получить окрашенный в разные цвета (в зависимости от размера частиц) золь металлического золота. Дисперсные системы с более крупными частицами (свыше 1000 нм = 1 мкм) имеют специальное название – суспензии (от лат. «suspensio» – подвешивание). Например, черная тушь – это суспензия.

Очень мелкие капли одной жидкости, находящейся в другой, не смешивающейся с ней жидкостью, образуют эмульсии (от лат «emulgere» – доить). Одна из первых изученных эмульсий – молоко, отсюда и название. Эмульсиями являются кровь, многие лекарственные средства (синтомициновая мазь).
Если в жидкости находятся изолированные пузырьки газа, система называется газовой эмульсией . А когда объёмная доля пузырьков очень велика, образуются пены .

Дисперсионная среда может быть и твердой. Примеры – всевозможные пористые материалы (пенопласт, пенополиуретановая губка); минералы с различными твердыми и жидкими включениями. Окраска цветных стекол часто тоже создается мелкими коллоидными частицами.
При высоких концентрациях частицы в жидких коллоидах начинают соприкасаться и образуют сеточные структуры. Так получаются студни или гели (от лат. «gelare» – застывать). Фруктовое желе и гель для укладки волос – типичные примеры подобных систем. Гелеобразную структуру имеет головной мозг. Видный представитель отечественной коллоидной химии И. И. Жуков говорил, что «человек – ходячий коллоид».
Уникальное свойство гелей заключается в том, что они имеют многие свойства твердого тела – прочность и упругость. Гели способны восстанавливать исходную структуру после её временного разрушения.

Это свойство называется тиксотропией (от греч. «тиксис» – прикосновение и «тропс» – изменение). Оно обеспечивается жидкими прослойками между частицами, образующими гель.
Чтобы кефир вылился из бутылки с узким горлышком, его надо потрясти. Если после этого бутылка постоит некоторое время, то кефир из нее снова не выльется. Причина – тиксотропный эффект. В неподвижном кефире постепенно восстанавливаются контакты между частицами вещества-загустителя, которые были разрушены при тряске. Поэтому на некоторых микстурах написано: «Перед употреблением взбалтывать».
Капли в аэрозолях и эмульсиях, пузырьки в жидкостях совершают броуновское движение, периодически соприкасаются и сливаются в более крупные. Такой процесс называется коалесценция (от лат. «coalesco» – срастаюсь, соединяюсь). Твердые частицы прилипают друг к другу, причем каждая сохраняет свою исходную форму. Этот процесс называется коагуляцией (от лат. «coagulatio» – сгущение, свёртывание).
Коалесценция и коагуляция ведут к агрегации (от лат. «аggrego» - присоединяю), т.е. укрупнению дисперсных частиц. Постепенно они становятся настолько большими, что особенности, присущие коллоидным системам, исчезают. Крупные капли и агрегаты твердых частиц или выпадают в осадок, или всплывают, если образующее их вещество легче дисперсионной среды. Наступает «гибель» коллоидной системы.
Проблемой устойчивости коллоидных систем занимались многие видные ученые. Они выявили решающие факторы устойчивости . Один из них – принцип стабилизации коллоидов основан на введении в них особых поверхностно-активных веществ (ПАВ). Молекулы ПАВ имеют особое строение. Они прилипают к поверхности коллоидных частиц и образуют на их поверхности тонкую, но прочную оболочку. Она препятствует контакту частиц, пузырьков или капель друг с другом и защищает их от слипания.

Примером могут служить белки, находящиеся в молоке: молекулы белков адсорбируются на капельках жира и на длительный срок предотвращают их слипание. Чтобы удалить с жировых капель защитный слой белка и получить таким образом сливочное масло, необходимо приложить значительные механические усилия.
Д. И. Менделеев в 1871 г. сказал: «Вопросы коллоидной химии должно считать передовыми и могущими иметь значение во всей физике и химии».

Коллоидная химия очень важна для решения многих проблем биологии и медицины. Например, немало людей страдают от образования тромбов в кровеносной системе и в сердце. Тромбы – это сгустки крови, которые формируются при определенных биохимических отклонениях, оседают на стенках сосудов и прочно закрепляются на них. Они сужают сечение артерий и капилляров, сильно затрудняя кровообращение, и в конце концов могут привести к полной закупорке сосудов. Чтобы предотвратить это заболевание, кроме чисто медицинских аспектов необходимо учитывать и особенности коллоидно-химических процессов. Поскольку кровь – типично коллоидная система, образование тромба нужно рассматривать как потерю устойчивости с последующей коагуляцией. Исходя из этого и разрабатываются современные методы профилактики и лечения.

Вопросы
- Почему в сметане появляется вода, если сметана постоит некоторое время?
- Почему трудно вылить из пакета скисшее молоко?
- Почему на некоторых микстурах написано: «Перед употреблением взбалтывать»?
- Для чего добавляют в смеси веществ поверхностно-активные вещества?
- Почему «умирают» гели?
6. Почему образуются тромбы?
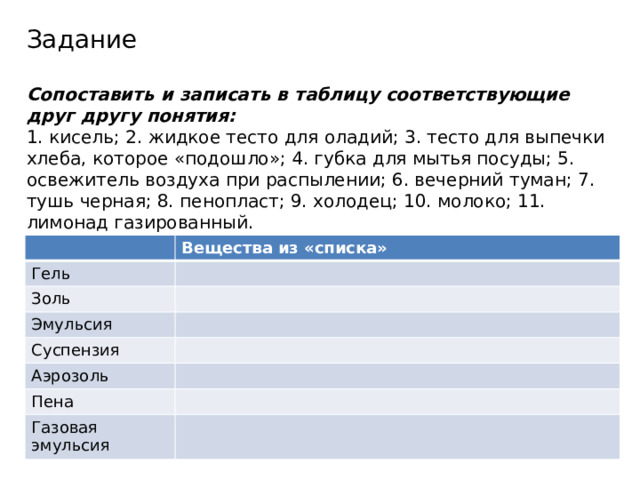
Задание
Сопоставить и записать в таблицу соответствующие друг другу понятия:
1. кисель; 2. жидкое тесто для оладий; 3. тесто для выпечки хлеба, которое «подошло»; 4. губка для мытья посуды; 5. освежитель воздуха при распылении; 6. вечерний туман; 7. тушь черная; 8. пенопласт; 9. холодец; 10. молоко; 11. лимонад газированный.
Гель
Вещества из «списка»
Золь
Эмульсия
Суспензия
Аэрозоль
Пена
Газовая эмульсия

Решите задачи.
1. Какая масса раствора с массовой долей гидроксида натрия 4% потребуется для полной нейтрализации соляной кислоты массой 30 г с массовой долей НСl 5%.

2. Вычислите массу смеси оксидов, которая образуется при сгорании 200 г смеси порошка магния и алюминия. Массовая доля алюминия в смеси составляет 54%.





































