Конспект урока «Классификация химических реакций»
11 класс
Цель урока: систематизировать знания обучающихся о подходах к классификации химических реакций.
Прогнозируемые результаты:
личностные:
· учить проверять себя;
· учить давать оценку своим действиям;
метапредметные:
· учить анализировать и выделять общее;
· учить находить наиболее оптимальный алгоритм действий;
предметные:
· вспомнить понятия химия, химическая реакция, эндо-и экзотермическая реакции, каталитическая и некаталитическая реакции, ОВР и неОВР, гомогенная и гетерогенная реакции;
· учить находить отличительные признаки химических реакций;
·уметь давать классификацию химическим реакциям по различным параметрам.
Дистанционный ресурс: программа ZOOM режим видеоконференция, платформа Google-формы».
ХОД УРОКА
«Множество реакций роднит критерий – любая реакция – это форма движения вечных материй».
I.Организационный момент.
Учитель: Здравствуйте! Вы изучаете химию уже четвёртый год, и надеюсь, убеждаетесь в том, что химия – удивительная наука! Скажите мне, пожалуйста, что изучает химия? (слайд №1)
Ответ учащихся: Химия- наука о веществах, их свойствах, превращениях и явлениях, сопровождающие эти превращения.
Учитель: Представьте себе такую ситуацию: вы вчера переехали на новую квартиру. Сегодня вам понадобился свежий носовой платок. И вот вы начинаете перебирать содержимое бесконечных узелков, коробочек, пакетиков, до чего-то вообще не добраться, уже пора уходить, но платка вы так и не находите. Это реальная ситуация? Возможно такое? Тогда мама говорит: «Ладно, возьми пока мой, потом найдём.» Когда наступит это потом?
Предполагается ответ учащихся: «Когда в квартире наведут порядок.»/
Не только вещи, но и мысли тоже требуют порядка. Можно сколь угодно долго искать в уголках нашей памяти какую-либо информацию и так и не найти её, пока мы не приведём все наши знания в порядок или в систему.
Учитель: В организме человека и в окружающем нас мире протекает огромное число реакций, без них невозможна жизнь. Чтобы ориентироваться в огромном царстве реакций, необходимо знать …. Как вы думаете, о чем сегодня на уроке пойдет речь?(подсказки выведены на слайд №2 презентации)
вода = водород + кислород
Соединение
–Q, +Q
C2H4 + H2 ––––– C2H4
C2H4 + HBr = C2H5Br
H2 + N2 ↔ NH3
медь + кислород = оксид меди (II)
Гетерогенные
Ответ учащихся: Сегодня мы рассмотрим классификацию химических реакций.
Учитель: Правильно, итак, запишите тему урока: «Классификация химических реакций». Дайте определение понятию химическая реакция? (слайд №3)
Ответ учащихся: Химическая реакция–это такое изменение вещества, при котором разрываются старые и образуются новые связи между атомами.
II. Актуализация знаний.
На слайде №4 у вас выведены ответы на мои вопросы, ваша задача услышав вопрос, ответить на него, используя заготовленные ответы со слайда.
1.Атомы простого вещества замещают атомы одного из элементов в сложном веществе (Реакции замещения).
2.Исходные вещества и продукты реакции находятся в разных агрегатных состояниях (Гетерогенные)
3.Реакции протекают с выделением энергии (Экзотермические)
4.Реакции протекают в данных условиях только в одном направлении (Необратимые)
5. Реакции, идущие без изменения степени окисления (Неокислительно-восстановительные)
6.Два сложных вещества обмениваются составными частями (Реакции обмена)
7.Реакции протекают с поглощением энергии (Эндотермические)
8.Из нескольких простых или сложных веществ образуется одно сложное (Реакции соединения)
9. Исходные вещества и продукты реакции находятся в одном агрегатном состоянии (Гомогенные)
10.Из одного сложного вещества образуется несколько более простых (Реакции разложения)
11. Реакции протекают в данных условиях одновременно в двух противоположных направлениях (Обратимые)
12.Реакции, идущие с участием вещества, которое изменяет её скорость или направление, но по окончании реакции остающиеся неизменным качественно и количественно. (Каталитические)
13. Реакции, идущие с изменением степени окисления (Окислительно-восстановительные)
14. Реакции, идущие без участия катализатора (Некаталитические)
Учитель: Молодцы! При изучении курсов органической и неорганической химии мы изучали множество химических реакций. Опираясь на ответы, полученные при выполнении химического диктанта, вспомните, пожалуйста, какие признаки могут быть выделены при классификации Х.Р.?
Признаки классификации химических реакций (Слайд №5)
По числу и составу исходных веществ и продуктов реакции.
По тепловому эффекту.
По признаку обратимости.
По признаку изменения степеней окисления.
По агрегатному состоянию веществ.
По наличию катализатора.
По механизму.
III Изучение нового материала.
Учитель: Все ли химические процессы протекают с образованием новых веществ? (нет, есть те, в которых состав веществ не изменяется)
- Реакции, идущие без изменения состава веществ: (Слайд №6)
1) Аллотропизация – взаимопереход аллотропных модификаций
Sn (белое) ↔ Sn (серое) (уч-ся приводят свои примеры аллотропизации)
2) изомеризация
СН3–СН2–СН2–СН3→СН3–СН(СН3)–СН3
бутан изобутан
– реакции, в которых изменилось строение вещества
Учитель: Какие типы реакций, идущих с изменением состава вещества можно выделить в каждой группе, вы мне скажите сами, видя на слайде общие схемы типов. (слайд №7).
1. По числу и составу реагентов.
- Реакции, идущие с изменением состава вещества (слайд №8-10).
А) Р-я соединения (SO3 + H2O = H2SO4)
Важно отметить, что в органической химии нет понятия соединения, а есть понятие присоединение. А кто мне скажет, почему именно присоединения? (присоединение происходит к конкретным атомам углерода)
Примером реакции присоединения является:
CH2 = CH2 + H2 = CH3–CH3 реакция гидрирование
CH2 = CH2 + H2O = CH3–CH2–OH реакция гидратация
Б) Р-я разложения (слайд 8)
СаСО3= СаО + СО2
Учитель: Почему в органической химии это типичная реакция? (все органические в-ва при нагревании без доступа воздуха разлагаются)
Приведём простой пример.
C3H8 = 3C + 4H2
В) Р-я замещения
Zn + 2НСl = ZnCl2+ Н2
Г) Р-я обмена
NaOH + НСl = NaCl + Н2О
Na2CO3+CaCl2→2NaCl+CaCO3
2. По изменению степеней окисления химических элементов
(Слайд №11-12)
Теперь вы знаете типы реакций, попробуйте определить какой же это тип.
Fe(NO3)2+2HNO3(конц)=Fe(NO3)3+NO2+H2O
(учащиеся пытаются определить, говорят к какому типу относится реакция.)
Учитель: данную реакцию нельзя классифицировать по примеру рассмотренным выше, но для неё характерна другая классификация.
(слайд №9)
– Окислительно – восстановительные (С. О. у элементов меняется)
2Cu+2(N+5O3-2)2→2CuO+4N+4O2+O20
– Неокислительно- восстановительные (С. О. – const)
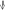 Ca+2Cl2-1 + Na2+1C+4O3-2= Ca+2 C+4O3-2 + 2Na+1Cl-1
Ca+2Cl2-1 + Na2+1C+4O3-2= Ca+2 C+4O3-2 + 2Na+1Cl-1
3. По направлению: (Слайд №13-14)
-Обратимые реакции - протекают одновременно в двух противоположных направлениях
СО2 + Н2О↔Н2СО3
В органической химии обратимыми являются реакции
гидрирования↔дегидрирования
гидратация↔дегидратация
полимеризация↔деполимеризация
- Необратимые реакции - протекают только в одном направлении
Na2CO3 + 2НСl → 2NaCl + Н2О + СО2↑
Признаки необратимости (по правилу Бертоле): (Слайд №14)
образование осадка,
образование слабого электролита (Н2О …),
выделение газа
образование комплексного соединения.
4.По тепловому эффекту(Q): (Слайд №15)
- Экзотермические (+ Q)
С + О2 = СО2+Q
-Эндотермические (-Q)
СаСО3= СаО + СО2↑–Q
В данном случае нужно запомнить несколько правил:
1) все реакции разложения – эндотермические
2) все реакции соединения, кроме N2+О2 =2NO–Q и H2+I2→2HI–Q ЯВЛЯЮТСЯ ЭКЗОТЕРМИЧЕСКИМИ.
5. По участию катализатора различают: (Слайд №16)
– каталитические реакции -протекают с участием катализатора, например:
N2+ 3H2 ––––2NН3
– некаталитические реакции — протекают без участия катализатора, например:
2H2+ О2 –––––2H2O
6. По агрегатному состоянию участвующих в реакции веществ различают: (Слайд №17)
– гомогенные реакции, в которых реагирующие частицы не отделены друг от друга какими-либо граничными поверхностями, а составляют единое целое, например:
2СО + О2 = 2СО2
– гетерогенные реакции, в которых реагирующие вещества разделены граничными поверхностями, например:
2Na + 2Н2О = 2NaOH + H2↑
IV. Закрепление. (Слайд №18-19)
Просмотрев видеоопыт, запишите уравнение протекающего процесса, охарактеризуйте реакцию по всем признакам. (Опыт: Получение кислорода в лабораторных условиях путём разложения перманганата калия).
2КМnO4=K2MnO4+MnO4+O2
1) реакция разложения
2) эндотермическая
3) некаталитическая
4) ОВР
5) Необратимая
6) гетерогенная
V. Домашнее задание (слайд 20)
§11, решить тест в Google-форме, перейдя по ссылке https://forms.gle/3BCnzxLj6cWBCgwX8
VI. Рефлексия. Выберите свой путь настроения на уроке
Перед завершением урока учитель предлагает учащимся проанализировать свое эмоциональное состояние.
Задание: поднимите руку или ответьте реакцией в ZOOMе, понравился ли вам данный урок.
Интернет-ресурсы: (слайд 21)
https://youtu.be/dT1P4Rp8ma4 видеоурок
https://chemege.sdamgia.ru/search?keywords=1&cb=1&search=1.4.1%20Классификация%20химических%20реакций%20в%20неорганической%20и%20органической%20химии задания ЕГЭ (№19).







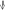 Ca+2Cl2-1 + Na2+1C+4O3-2= Ca+2 C+4O3-2 + 2Na+1Cl-1
Ca+2Cl2-1 + Na2+1C+4O3-2= Ca+2 C+4O3-2 + 2Na+1Cl-1

















