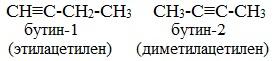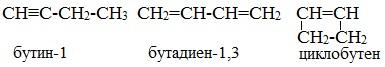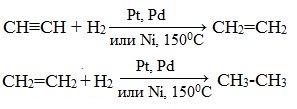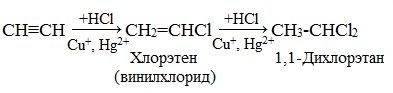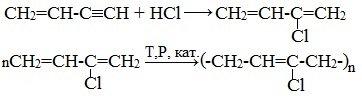Севастопольское государственное бюджетное образовательное учреждение
профессионального образования
«Севастопольский медицинский колледж имени Жени Дерюгиной»
| «СОГЛАСОВАНО» на заседании МЦК математических и естественнонаучных дисциплин
Протокол № от «___» _______ 201_ г. Председатель ЦМК Смирнова З.М._______________ | «УТВЕРЖДАЮ» Зам. директора по учебной работе __________Полстянко Н.Н. «____» _____________ 201_ г.
|
УЧЕБНО-МЕТОДИЧЕСКАЯ РАЗРАБОТКА
(ТЕОРЕТИЧЕСКОГО ЗАНЯТИЯ)
Учебная дисциплина: Химия
Тема «Алкины»
Специальность: 34.02.01Сестринское дело
Курс I
Автор:
Преподаватель химии
Звягинцева О.В.
Севастополь 2019 г.
Севастопольское государственное бюджетное образовательное учреждение
профессионального образования
«Севастопольский медицинский колледж имени Жени Дерюгиной»
Учебно-методическая разработка занятия
Учебная дисциплина «Химия»
Тема «Алкины»
Курс: 1
Специальность: 34.02.01 Сестринское дело
Количество учебных часов: 2
Тип урока: комбинированный урок
1. Актуальность темы
Ацетилен является важнейшим сырьем для многочисленных промышленных синтезов. Некоторая часть ацетилена из-за его наркотического воздействия применяется в медицинской практике (нарцилен).
Изучение алкинов необходимо для дальнейшего освоения основной профессиональной образовательной программы, так как они являются ненасыщенными углеводородами, содержащими тройную связь. Тема актуальна, так как изучение последующих тем органической химии базируется на ней
2. Цели занятия
а) Образовательные (обучающие) цели
Знать:
--понятие алкины, их общую формулу;
-электронное и пространственное строение молекул этина и других алкинов;
- гомологический ряд, номенклатуру и изомерию алкинов;
- химические свойства, способы получения и применения алкинов.
Уметь:
- составлять структурные формулы гомологов и изомеров алкинов;
-составлять уравнения химических реакций, подтверждающих химические свойства и способы получения алкинов;
-составлять химические уравнения качественных реакций алкинов.
б) Развивающие цели:
- развивать логическое мышление при установлении причинно-следственных связей между строением, составом, свойствами и применением ацетилена;
- развивать умение работать с дополнительными источниками информации, анализировать, отбирать и представлять необходимую информацию;
- формировать познавательный интерес к изучению органической химии, развивать пространственное воображение, химическое мышление, память, умение систематизировать, анализировать, выделять главное и делать выводы.
- продолжить развитие навыков работы на опережение;
в) Воспитательная:
- воспитывать интерес к изучению органической химии
- воспитывать аккуратность в процессе выполняемой работы;
- воспитание культуры общения через работу в парах
- воспитывать информационную компетентность.
2.1 Формирование общих компетенций:
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их выполнение и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность;
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), результат выполнения
Междисциплинарные связи: общая и неорганическая химия
Внутридисциплинарные связи:«Алканы», «Алкены»,
Методы обучения:
3. Содержание темы занятия
План
1.История открытия
2. Алкины, определение
3. Гомологичнский ряд, номенклатура, изомерия
4. Строение алкинов
5.Нахождение в природе и физиологическая роль алкинов
6.Физические свойства
7. Электронное и пространственное строение молекулы ацетилена
8. Получение ацетилена
9. Химические свойства
а) реакции присоединения (галогенирование, гидрогалогенирование, гидрирование, гидратация)
б) реакции окисления (горение, неполное)
в) реакции полимеризации
г)образование солей)
10. Области применения ацетилена
4. Организационно-деятельностная структура занятия
| №
п/п | Основные этапы занятия, их функции и содержание | Деятельность обучающихся | Деятельность преподавателя | Время в мин. |
| 1 | 2 | 3 | 4 | 5 |
| I | Подготовительный этап 1. Организационный момент: проверка внешнего вида обучающихся, заполнение журнала 2. Проверка домашнего задания
3. Подготовка к усвоению материала
3. Постановка учебных целей и мотивация занятия. |
Проверяют готовность рабочего места к занятию.
Отвечают устно (фронтальный), письменно (химический диктант) Решают задачу
Слушают преподавателя. Фокусируют внимание на выделенных этапах занятии.
|
Проверка готовности к занятию, фиксация отсутствующих.
Контроль усвоения знаний по теме «Алканы», «Алкены». Предлагает решить задачу и определить тему урока. Сообщает тему и цели урока. Сообщает об основных этапах занятия. Обращает внимание на актуальность темы. |
3'
15'
10'
5' |
| II | Основной этап Объяснение нового материала План изложения теоретического материала: 1.История открытия 2. Алкины, определение 3. Гомологичнский ряд, номенклатура, изомерия 4. Строение алкинов 5.Нахождение в природе и физиологическая роль алкинов 6.Физические свойства 7. Электронное и пространственное строение молекулы ацетилена 8. Получение ацетилена 9. Химические свойства а) реакции присоединения (галогенирование, гидрогалогенирование, гидрирование, гидратация) б) реакции окисления (горение, неполное) в) реакции полимеризации г)образование солей) 10. Области применения ацетилена |
Слушают преподавателя. Записывают необходимый материал.
| Знакомит студентов с алкинами, как о классе непредельных углеводородов. Рассказывает об особенностях их строения и изомерии, номенклатуре, получении, физико-химических свойствах и применении.
. | 45'
|
| III | Заключительный этап
1. Резюме урока, общие выводы 2. Контроль усвоения знаний 3. Рефлексия результатов обучения:
- подведение итогов занятия:
- ответы на возможные вопросы - отмечаются лучшие обучающиеся
4.Домашнее задание.
5.Задание к самостоятельной работе |
Отвечают на вопросы для закрепления знаний. Самостоятельно оценивают результаты проделанной на занятии работы.
Записывают домашнее задание Задают вопросы.
|
Организует работу по закреплению первичных знаний.
Проведение фронтального опроса по изученной теме, с целью контроля усвоения знаний. Оценивание ответов. Оценка учебного занятия преподавателем. Формулирует домашнее задание. Проводит инструктаж по самостоятельной работе. Объявляет задания. |
10'
1-3' |
5. Конспект изучаемой темы (прилагается)
6. Материалы методического обеспечения занятия:
6.1. Вопросы актуализации опорных знаний (в течение занятия):
а) Задача для определения темы занятия:
Это вещество под названием нарцилен было предложено в 1923 г. для получения наркоза Гаусом и Виландом, после того как Виланд за год перед тем описал его наркотические свойства.
Установите молекулярную формулу углеводорода, если в его состав входит углерод с массовой долей 92,31 % и водород 7,69 %. Известно, что относительная плотность по водороду данного вещества составляет – 13.
Задание. Исходя из молекулярной формулы предложите структурную формулу вещества. К какому классу веществ оно относится?
Ответ: С2Н2, алкины
б) актуализация опорных знаний по вопросам исходного контроля:
1.Фронтальный опрос:
Классы веществ, какой группы органических соединений мы с вами изучаем?
Что такое углеводороды?
На какие группы делятся углеводороды?
Какие классы углеводородов вы помните?
Какие классы углеводородов вы уже изучили?
2.Химический диктант
|
| 1 вариант | 2 вариант |
| 1. | Основное состояние атома углерода | Возбужденное состояние атома углерода |
| 2. | Тип гибридизации атома углерода в молекуле |
| метана | этилена |
| Дать определение. Пояснить |
| 3. | Валентный угол (дать определение, привести примеры) | Длина связи (дать определение, привести примеры) |
| 4. | Расположение в пространстве электронных облаков атомов углерода в молекуле |
|
| этилена | Метана |
| 5. | Дать определение: |
|
| σ-связь (сигма-связь) | π-связь (Пи-связь) |
|
|
|
|
6. 2. Материалы контроля для заключительного этапа:
Вопросы для закрепления знаний:
6.2.1. Вопросы фронтального устного опроса:
- Какие реакции наиболее характерны для алкинов?
6.2.2. Задание:
Выберите формулы : гомологов, изомеров. Дайте названия всем алкинам по современной номенклатуре

6.2.3. Игра “Крестики-нолики”. Выигрышный путь составляют формулы, которые могут соответствовать алкинам:
| С2Н2 | С10Н22 | С7Н16 |
| С6Н12 | С4Н6 | С5Н10 |
| С5Н8 | С4Н8 | С3Н4 |
6.2.4. Из букв, соответствующих правильным ответам, получите название радикала 
| Применение реакции или ее продуктов | Химические свойства ацетилена |
| Реакция с бромной водой | Реакция горения | Реакция с водой | Реакция с хлоро-водородом | Реакция с перманганатом калия |
| Идентификация непредельных соединений | В | А | М | Т | И |
| Резка и сварка металлов | Е | Н | О | С | Е |
| Получение мономера для производства поливинилхлорида | Ы | Ч | Б | И | Ю |
| Производство уксусного альдегида | Г | С | Л | Ш | З |
6. 3. Материалы к самостоятельной работе обучающихся по теме занятия:
а) внеаудиторная самостоятельная работа обучающихся:
Химия: задачи и упражнения: учеб.пособие/Ю.М.Ерохин. – 2-е изд., стер. – М.: Издательский центр «Академия»,2014, стр.215-216 № 17-20.
7. Оборудование: компьютер, проектор, экран, презентация.
Программные средства, с помощью которых создан дидактический материал – Microsoft Office Power Point.
8. Материалы домашнего задания студентов по теме занятия:
Ерохин Ю.М.Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студ.учреждений сред.проф.образования/Ю.М.Ерохин, И.Б.Ковалева. – 2-е изд., стер. – М.: Издательский центр «Академия»; 2014, стр.350-353
ЛИТЕРАТУРА
Основная:
1. Ерохин Ю.М.Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студ.учреждений сред.проф.образования/Ю.М.Ерохин, И.Б.Ковалева. – 2-е изд., стер. – М.: Издательский центр «Академия»; 2014
Дополнительная:
1. Химия: задачи и упражнения: учеб.пособие/Ю.М.Ерохин. – 2-е изд., стер. – М.: Издательский центр «Академия»,2014
Интернет-ресурсы
http://medobook.ru/load/medicina/stati/narcilen_i_ehtilen_v_anesteziologii/49-1-0-5653#ixzz5iokazuRB
http://himija-online.ru/organicheskaya-ximiya/alkiny/nomenklatura-alkinov.html
Приложение 1
Тема «Алкины»
I. Организационный момент .
II. Актуализация знаний
1.Фронтальный опрос:
Классы веществ, какой группы органических соединений мы с вами изучаем?
Что такое углеводороды?
На какие группы делятся углеводороды?
Какие классы углеводородов вы помните?
Какие классы углеводородов вы уже изучили?
2.Химический диктант
|
| 1 вариант | 2 вариант |
| 1. | Основное состояние атома углерода | Возбужденное состояние атома углерода |
| 2. | Тип гибридизации атома углерода в молекуле |
| метана | этилена |
| Дать определение. Пояснить |
| 3. | Валентный угол (дать определение, привести примеры) | Длина связи (дать определение, привести примеры) |
| 4. | Расположение в пространстве электронных облаков атомов углерода в молекуле |
|
| этилена | Метана |
| 5. | Дать определение: |
|
| σ-связь (сигма-связь) | π-связь (Пи-связь) |
|
|
|
|
Для определения темы нашего урока решите следующую задачу:
Задача. Это вещество под названием нарцилен было предложено в 1923 г. для получения наркоза Гаусом и Виландом, после того как Виланд за год перед тем описал его наркотические свойства.
Установите молекулярную формулу углеводорода, если в его состав входит углерод с массовой долей 92,31 % и водород 7,69 %. Известно, что относительная плотность по водороду данного вещества составляет – 13.
Задание. Исходя из молекулярной формулы предложите структурную формулу вещества. К какому классу веществ оно относится?
Ответ: С2Н2, алкины
НАРЦИЛЕН (Narcylen), очищенный ацетилен, во избежание опасности взрыва растворенный под давлением в 15—20 атмосфер в ацетоне и содержащийся в стальных сосудах. Смеси нарцилена с воздухом и кислородом, содержащие 5-8% нарцилена, взрываются. По своим анестетическим свойствам нарцилен близок к закиси азота, но он является несколько более мощным анестетиком, чем последняя. Значительно ограничивает применение этого анестетика взрывоопасность.
Запишите тему урока: «Алкины»
? Какие вопросы мы должны будем рассмотреть по данному классу веществ?
? Сформулируйте цель нашего сегодняшнего урока?
III. Изучение нового материала
История открытия
Впервые ацетилен был получен в 1836 году Эдмундом Дэви, двоюродным братом знаменитого английского химика Гемфри Дэви, нагреванием уксуснокислого калия с древесным углем и последующей реакцией с водой образовавшегося карбида калия. Дэви назвал свой газ «двууглеродистым водородом», что обусловлено его формулой «С2Н2».
В 1862 году немецкий химик и врач Ф. Вёлер вновь открыл ацетилен, действуя водой на карбид кальция.
В 1863 году французский химик Марселен Бертло получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами. Именно он дал газу имя ацетилен. Название ацетилен связано не с алканом, а с ацетатом, то есть происходит от латинского acetum — уксус. Эдмунд Дэви, открывший ацетилен в 1836 году, конечно, не мог предположить, что Михаил Григорьевич Кучеров в 1881 году откроет путь превращения ацетилена в уксусную кислоту (через уксусный альдегид).
Русское название «ацетилен» впервые было применено Д. И. Менделеевым.
Номенклатура алкинов
Алкины – непредельные углеводороды, молекулы которых содержат одну тройную углерод-углеродную связь. Состав отражает формула: CnH2n-2.
По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин.
Правила составления названий алкинов по международной номенклатуре аналогичны правилам составления алкенов.
1. При составлении названия алкина выбирается самая длинная цепь, включающая тройную связь. Нумерация цепи идет с того конца, к которому ближе находится кратная связь, ее местоположение указывается наименьшим из двух номеров углеродных атомов.
Если тройная связь находится на одинаковом расстоянии от концов цепи, нумерацию ведут с того конца, к которому ближе находится заместитель.

2. В названии соответствующего алкана окончание –ан заменяют на –ин.
3. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя.
4. Цифра, обозначающая положение тройной связи, ставится после суффикса –ин.

В номенклатуре различных классов органических соединений наиболее часто используется радикал, образованный от ацетилена (НС≡С─) – этинил.
Образование названий алкинов по номенклатуре ИЮПАК
Для первого члена гомологического ряда применяется исторически сложившееся название – ацетилен (этин).
Низшие члены гомологического ряда, имеющие простое строение, часто называют как производные ацетилена, у которого один или оба атома водорода замещены на алкильные группы.
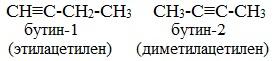
Изомерия алкинов
Для алкинов характерна структурная изомерия. Первые два члена гомологического ряда – этин и пропин – изомеров не имеют.
1. Изомерия углеродного скелета (начиная с С5Н8):

2. Изомерия положения тройной связи (начиная с С4Н6):
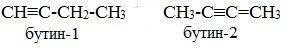
3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
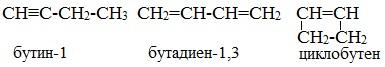
Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом — вдоль линии связи.
Электронное и пространственное строение молекулы ацетилена
Работая в парах, ответьте на вопросы (при затруднении смотрите стр. 350-353):
Особенности строения алкинов?
Вид гибридизации у простейшего алкина?
Валентный угол?
Длина связи С≡С?
Типы связей в молекулах алкинов?
Пространственное строение простейшей молекулы алкинов.
Форма молекулы у алкинов.
По окончании работы самопроверка по ответу учащегося.
Ациклические соединения, имеющие в своем строении одну тройную связь.
Наличие тройной связи связи.
sp гибридизация
Тройная связь и одинарные
σ-связь и 2 π-связи
| 
| Валентный угол – 1800 Форма – линейная Длина С≡С св. – 0.120 нм
|
В алкинах атомы углерода при тройной связи находятся в третьем валентном состоянии (sp-гибридизация).
Это означает, что каждый атом углерода обладает двумя гибридными sp-орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две негибридных р-орбитали, расположенны под углом 90° по отношению друг к другу и к sp-гибридным орбиталям:

Расположение орбиталей атома углерода в состоянии sp-гибридизации
По одной из двух гибридных орбиталей каждого атома углерода взаимно перекрываются, приводя к образованию σ-связи между атомами углерода. Каждая оставшаяся гибридная орбиталь перекрывается с s-орбиталью атома водорода, образуя σ-связь С–Н.

Схема образования σ-связей в молекуле ацетилена
Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям σ-связей. В этих плоскостях p-орбитали взаимно перекрываются, и образуются две π-связи, которые относительно непрочные и в химических реакциях легко разрываются.
Таким образом, тройная связь характеризуется сочетанием одной σ- и двух π-связей.
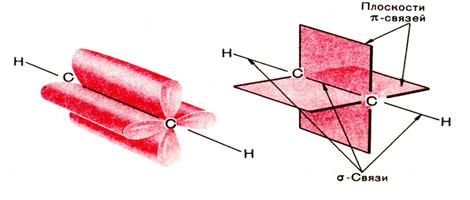
Расположение π-связей во взаимно перпендикулярных плоскостях

тройная связь в ацетилене
Дополнительное связывание двух атомов углерода приводит к тому, что расстояние между ядрами уменьшается, поскольку тройная связь является сочетанием одной σ- и двух π-связей. Длина тройной связи С≡С составляет 0,120 нм.
σ-Cвязи, образуемые sp–гибридными орбиталями углерода, располагаются на одной прямой, поэтому молекула ацетилена имеет линейное строение:

Нахождение в природе и физиологическая роль алкинов
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения, содержащие полиацетиленовые структуры.
Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги.
Длительная работа специалистов с ацетиленом в промышленных условиях могут привести к функциональным нарушениям нервной системы. Высокие концентрации ацетилена при незначительном содержании кислорода приводят к отеку легких и потере сознания.
Физические свойства алкинов похожи на свойства алканов и алкенов.
Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы.
При обычных условиях алкины С2Н2-С4Н6– газы, С5Н8-С15Н28 – жидкости, с С16Н30 – твердые вещества. Алкины имеют специфический запах.
Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами. Они хорошо растворяются в органических неполярных растворителях.
Ацетилен (С2Н2) – бесцветный газ, в чистом виде почти без запаха, технический ацетилен обладает неприятным запахом. Неприятный запах ацетилена, полученного из карбида кальция, обусловлен примесями главным образом мышьяковистого и фосфористого водорода. Ацетилен плохо растворим в воде. Хорошо растворим в ацетоне. По своей массе он близок к атмосферному воздуху. Ацетилен взрывоопасен!
Получение ацетилена
Ацетилен является важным исходным продуктом для производства многих органических веществ и материалов.
1. Крекинг метана
Основным промышленным способом получения ацетилена является крекинг метана и его ближайших гомологов. В качестве сырья используется природный газ. В 1868 г. французский химик М. Бертло получил ацетилен, пропуская через метан электрический разряд:

2. Гидролиз карбида кальция
В лаборатории ацетилен получают гидролизом карбида кальция (взаимодействие с водой).
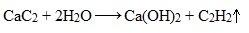
Видеоопыт «Получение ацетилена»
Карбид кальция образуется при нагревании смеси оксида кальция СаО (негашеная известь, жженая известь, едкая известь) и кокса до 2500°С:

Вследствие большой энергоемкости этот метод экономически менее выгоден.
Химические свойства алкинов
Учитель: Учитывая особенности строения ацетилена, предположите, какими свойствами это вещество может обладать?
Ученики: Т.к. ацетилен является непредельным соединением, поэтому он может вступать в реакции присоединения, как все углеводороды горит, а также обесцвечивает бромную воду и перманганат калия.
Алкины во многих реакциях обладают большей реакционной способностью, чем алкены. Для алкинов, как и для алкенов, характерны реакции присоединения. Так как тройная связь содержит две π-связи, реакции присоединения к алкинам могут происходить в две стадии.
Вначале идет присоединение по месту двойной π-связи с образование производных олефинов, а затем по месту второй π-связи с образованием производных алканов.
Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что π-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
Реакции присоединения
1. Гидрирование
Присоединение водорода происходит при нагревании в присутствии металлических катализаторов. Реакция протекает в две стадии: алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем образованием алканов (разрывается вторая π-связь):
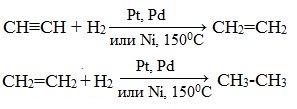
2. Галогенирование
Присоединение галогенов протекает также в две стадии. На первой стадии образуются дигалогеналкены, на второй – тетрагалогеналканы:
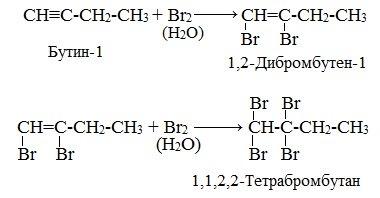
Реакция алкинов с бромной водой является качественной реакцией на алкины. Бромная вода обесцвечивается.
Видеоопыт «Взаимодействие ацетилена с бромной водой»
3. Гидрогалогенирование
Галогеноводороды присоединяются к алкинам в две стадии. Вторая стадия идет по правилу Марковникова. Присоединение НCl в отсутствии катализатора идет очень медленно. Катализатором этой реакции служат кислоты Льюиса – соли меди (I) и ртути (II):
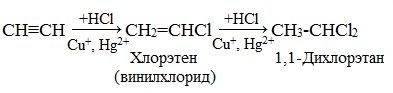
Получаемый продукт – хлористый винил (винилхлорид) – подобно этилену легко полимеризуется, образуя полимер – поливинилхлорид, который широко применяется в производстве поливинилхлоридных смол:

Сообщение студента.
Поливинилхлорид по своему составу и строению можно рассматривать как хлорпроизводное полиэтилена. ПВХ устойчив к действию кислот и щелочей, обладает хорошими диэлектрическими свойствами, большой механической прочностью, он практически не горит, однако сравнительно легко разлагается при нагревании, выделяя хлороводород.
На основе ПВХ получают пластмассы 2-х типов:
- винипласт, обладающий значительной жесткостью, и
- пластикат – более мягкий материал.
Из винипласта готовят химически стойкие трубы, детали химической аппаратуры, аккумуляторные банки. Пластикат идет на изготовление линолеума, искусственной кожи, клеенки, изоляции проводов.
Важной экологической проблемой, связанной с использованием ПВХ, является скопление твердых отходов, изготовленных из этого полимера. Они препятствуют газообмену в почвах и водоемах, выделяют токсичные для живых организмов вещества, медленно окисляются кислородом, очень медленно разрушаются под воздействием солнечных лучей. Конечным продуктом разложения являются углекислый газ, вода, хлороводород. Время разложения полимера на земле и в пресной воде составляет несколько сотен лет. Способов вторичной переработки его не существует. ПВХ категорически запрещено сжигать, так как при этом образуются ядовитые хлорорганические соединения. Ученые установили, пребывание у костра в течение часа, где сжигают ПВХ, для организма равнозначно нахождению на оживленной автомагистрали.
4. Гидратация (реакция Кучерова)
Присоединение воды протекает в присутствии солей ртути (II) при нагревании – HgSO4, Hg (NO3)2 – с образованием уксусного альдегида (при обычных условиях ацетилен с водой не взаимодействует):

На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято назвать виниловыми или енолами.
Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) - водород гидроксильной группы переходит к соседнему атому углероду. При этом π-связь между атомами углерода разрывается и образуется π-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С=О по сравнению с двойной связью С=С.
Правило Эльтекова: спирты, у которых гр.ОН находится при углероде с двойной связью, неустойчивы, водород гидроксильной группы переходит к соседнему углероду.
Гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны:

5. Реакции полимеризации
В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты.
1.Димеризация под действием водно-аммиачного раствора CuCl:

Винилацетилен обладает большой реакционной способностью – присоединяя хлороводород, он образует хлоропрен (2-хлорбутадиен-1,3), используемый для получения искусственного хлорпренового каучука:
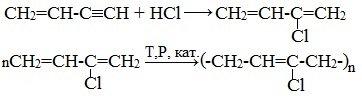
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
В аналогичные реакции тримеризации могут вступать также и ближайшие гомологи ацетилена, например пропин:
Реакции окисления
1. Горение
При сгорании алкинов происходит их полное окисление до СО2 и Н2О. Горение ацетилена сопровождается выделением большого количества тепла:
Видеоопыт «Горение ацетилена»
Температура ацетиленово-кислородного пламени достигает 2800- 3000°С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси.
Видеоопыт «Взрыв смеси ацетилена с кислородом»
В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара. Поэтому ацетилен хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест.
2. Неполное окисление
Ацетилен и его гомологи легко окисляются окислителями — КMnO4, K2Cr2O7. Алкины окисляются с разрывом молекулы по тройной связи. Строение продуктов окисления зависит от природы окислителя и условий проведения реакций.
Алкины обесцвечивают разбавленный раствор перманганата калия, что доказывает их ненасыщенность.
а) мягкое окисление
Мягкое окисление алкинов происходит без разрыва σ-связи С─С (разрушаются только π-связи).
Например, при взаимодействии ацетилена с разбавленным раствором КMnO4 при комнатной температуре образуется двухосновная щавелевая кислота:
В нейтральной и слабощелочной средах на холоде образуются соли карбоновых кислот. При взаимодействии ацетилена с водным раствором перманганата калия образуется соль щавелевой кислоты (оксалат калия):
б) Жесткое окисление
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты.
Окисление алкинов перманганатом калия в кислой среде при нагревании сопровождается разрывом углеродной цепи по месту тройной связи и приводит к образованию карбоновых кислот:
Окисление алкинов, содержащих тройную связь у крайнего атома углерода, сопровождается в этих же условиях образованием карбоновой кислоты и выделением углекислого газа:
В кислой среде окисление ацетилена идет до щавелевой кислоты или углекислого газа:
Видеоопыт«Взаимодействие ацетилена с раствором перманганата калия»
Реакция КMnO4 является качественной реакцией на алкины. Раствор перманганата калия обесцвечивается.
3. Образование солей
Особенностью алкинов, имеющих концевую тройную связь (алкины-1), является их способность проявлять слабые кислотные свойства.
Атомы водорода, связанные с sp-гибридизированными атомами углерода в молекулах алкинов, обладают значительной подвижностью, что объясняется поляризацией σ-связи ≡С─Н. В связи с этим атомы водорода могут замещаться атомами металлов, в результате чего образуются соли — ацетилениды.
Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена.
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I).
Образование серовато- белого осадка ацетиленида серебра (или красно-коричневого – ацетиленида меди) служит качественной реакцией на концевую тройную связь.
Видеоопыт «Получение ацетиленида серебра»
Видеоопыт «Получение ацетиленида меди»
Ацетилениды серебра и меди как соли слабых очень кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина.
Ацетилиниды серебра и меди в сухом виде взрываются от удара. Однако карбид кальция, который также является ацетиленидом, очень устойчив к удару. Он широко используется для получения ацетилена.
Видеоопыт «Неустойчивость ацетиленидов»
Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются.
По мере объяснения химических свойств, студенты помогают преподавателю составлять уравнения, называть продукты реакций, расставлять коэффициенты, давать определения типам реакций.
ОБЛАСТИ ПРИМЕНЕНИЯ АЦЕТИЛЕНА
(Сообщение студента)
Из алкинов особое значение имеет ацетилен.
1. Ацетилен из-за достигаемой высокой температуры пламени широко используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена).
При его горении в кислороде пламя его достигает температуры 28000С.
2. Как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (карбидная лампа). В самом начале ацетилен применялся на улицах для внешнего освещения. Газ мог гореть, выделяя много тепла, и, соответственно, света, но при этом стоит совсем немного. Например, горелка для уличного освещения после заправки ацетиленом могла работать до нескольких недель. Спектр света был максимально естественным, то есть белым. Это было прогрессивным решением, ведь до этого не удавалось создать подобное уличное освещение. С появлением электричества горелки с ацетиленом уже не требовались. Спрос на них постепенно упал до нуля. Но всё же технический газ ещё применяли для освещения загородных поместий, экипажей.
Карби́дная лампа — лампа, где источником света служит открытое пламя струи сжигаемого ацетилена, который, в свою очередь, получается из химической реакции карбида кальция с водой.
Данный тип ламп был широко распространён в прошлом. Их устанавливали на кареты, автомобили и даже на велосипеды. В наши дни карбидная лампа используется только в случае нужды в мощном автономном источнике света, например, в спелеологии, на отдалённых маяках, т. к. это освещение выгоднее, чем подвод линии электропередачи или автономная энергетическая установка. До сих пор такие лампы используются на судах, бакенах.
3. В ракетных двигателях (вместе с аммиаком).
4. Простота получения, относительно низкая стоимость, химическая активность сделали ацетилен важнейшим сырьем для многочисленных промышленных синтезов:
в производстве взрывчатых веществ (ацетилениды);
для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов;
винилацетат – мономер для получения поливинилацетата (ПВА);
Поливинилацетат – основа для клеев, водоэмульсионных и акриловых красок, используется в производстве лаков.
акрилонитрил – мономер для получения синтетического волокна «нитрон»;
винилхлорид – мономер для получения поливинилхлорида (основа линолеума, разнообразной упаковки, труб и др.).
Применение алкинов (ацетиленовых углеводородов) в медицине:
1. Некоторая часть ацетилена из-за его наркотического воздействия применяется в медицинской практике (нарцилен)
2. При конденсации ацетилена с пирролидоном получают N-винилпирролидона, который легко полимеризуется с синтезом поливинилпирролидона (ПВП):
Полимерные соединения на основе винилпирролидона нашли широкое применение в медицинской практике как вещества при производстве лекарственных препаратов, а многие из них сами являются лекарственными. Например низкомолекулярный поливинилпирролидон (12000-13000 молекулярная масса) образует коллоидные растворы в воде и используется в процессе приготовления гемодеза (кровезаменителя), среднемолекулярные поливинилпирролидон (с молекулярной массой 35000-40000) применяется в фармации как связующее вещество для изготовления таблеток.
При сополимеризации винилпирролидона, акриламида и этилкрилата получают биорастворимый полимер, который обеспечивает удлиненное действие лекарственных препаратов (пролонгируя эффект), например, лекарственных пленок для глаз.
3. ПВХ в медицине.
ПВХ используется в медицине уже более 50 лет. При этом его потребление в этой сфере постоянно растет. Толчком к широкому применению ПВХ в этой области стала насущная потребность заменить резину и стекло предварительно стерилизованными предметами одноразового (и не только) использования. Медицинские продукты из ПВХ могут быть использованы внутри человеческого тела, легко стерилизуются, не трескаются и не протекают.
Вот далеко не полный перечень медицинской продукции, производимой из ПВХ: контейнеры для крови и внутренних органов, катетеры, трубки для кормления, приборы для измерения давления, хирургические перчатки и маски, хирургически шины, блистер-упаковка для таблеток и пилюль.
Основные преимущества ПВХ, позволившие этому материалу стать наиболее применимым в медицине.
ПВХ легко совместим с практически всеми фармацевтическими продуктами. Он также устойчив к воде и химическим реакциям. Из ПВХ легко производить упаковку любой формы, будь то трубы, гибкая или жесткая упаковка.
IV.Закрепление изученного материала
1.Вопросы фронтального устного опроса:
- Какие реакции наиболее характерны для алкинов?
2.Задание:
Выберите формулы гомологов, изомеров. Дайте названия всем алкинам по современной номенклатуре

3.Давайте поиграем с вами в игру “Крестики-нолики”. Выигрышный путь составляют формулы, которые могут соответствовать алкинам:
| С2Н2 | С10Н22 | С7Н16 |
| С6Н12 | С4Н6 | С5Н10 |
| С5Н8 | С4Н8 | С3Н4 |
4. Задание: Из букв, соответствующих правильным ответам, получите название радикала 
| Применение реакции или ее продуктов | Химические свойства ацетилена |
| Реакция с бромной водой | Реакция горения | Реакция с водой | Реакция с хлоро-водородом | Реакция с перманганатом калия |
| Идентификация непредельных соединений | В | А | М | Т | И |
| Резка и сварка металлов | Е | Н | О | С | Е |
| Получение мономера для производства поливинилхлорида | Ы | Ч | Б | И | Ю |
| Производство уксусного альдегида | Г | С | Л | Ш | З |
V.Подведение итогов занятия, комментирование оценок, домашнее задание.
6